

Содержание
1. Введение…………………………………………………………………….3
2. Методика решения задач ………………………………………………….4
3. Алгоритмы для решения задач……………………………………………10
4. Примеры решения задач с оформлением ……….………......................14
5. Расчетные задачи и их решение ………………………………………….21
6. Задачи для самостоятельной работы ……………………………………..23
7. Ответы к задачам…………………………………………………………..27
Введение
Химические задачи — познавательные задания с вопросной ситуацией, включающие в себя условия, функциональные зависимости и требование ответа. По своему дидактическому назначению задачи — это средство интегративного применения знаний и умений, установления целостности между количественными и качественными характеристиками химического языка. Процесс решения химических задач должен быть увлекательным и приносить удовлетворение, подобное тому, которое получают любители разгадывания кроссвордов.
Решение задач позволяет:
· расширять кругозор учащихся;
· развивать умение логически мыслить;
· воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
· устанавливать связь химии с другими науками: физикой, математикой, биологией, экологией и др.;
· способствует политехнической подготовке учащихся, готовиться к успешной аттестации по предмету.
Решая задачи, учащиеся более глубоко усваивают учебный материал, учатся применять приобретённые теоретические знания на практике.
Развить умение решать задачи можно только одним путем — постоянно, систематически решая задачи. В процессе этой работы обучающиеся осуществляют сложную мыслительную деятельность, которая определяет развитие как содержательной стороны мышления (знания), так и действенной (умение). Теснейшее взаимодействие знаний и умений — основа формирования различных приемов мышления. На уроках химии учащиеся усваивают символический язык этой науки.
В курсе предусмотрено решение задач, которые объединены по типам. С алгоритмами решения всех типов химических задач учащиеся знакомятся в основной школе, в старших классах дополнительно решают лишь задачи на вывод молекулярных формул. Обучающиеся должны научиться устанавливать логические связи, видеть зависимость между химическими явлениями, находить рациональные приёмы решения задач.
Очень важно научить ребят видеть практическую значимость знаний по химии: применение химических процессов в промышленности, сельском хозяйстве, медицине, быту.
Методика решения задач по химии
В данной работе показываются примеры решения некоторых основных типов задач, которые раскрывают суть методического подхода в обучении . При решении задач необходимо руководствоваться несколькими простыми правилами:
- записать, что дано;
- перевести, если это необходимо, единицы физических величин в единицы системы СИ (некоторые внесистемные единицы допускаются, например, литры);
- записать, если это необходимо, уравнение реакции и расставить коэффициенты;
- решать задачу, используя понятие о количестве вещества, а не метод составления пропорций;
- записать ответ.
Любая
задача по химии решается через количество вещества. Необходимо помнить основную
формулу:
ν(x) = m(x)/ М(х) = V(x)/Vm =
N/NA,
где V(x) – объем вещества Х(л), Vm – молярный объем газа (л/моль), N – число
частиц, NA – постоянная Авогадро.
Основные формулы физических величин и их взаимосвязи, которые обучающиеся должны знать в обязательном порядке и использовать их при решении.
1. Относительная атомная масса (Ar):
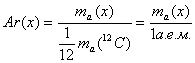
где x – любой химический элемент.
2. Относительная молекулярная масса
(Mr): ;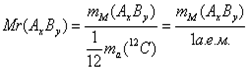
![]() .
.
3. Плотность вещества (ρ) позволяет
связать собой массу (m) и объем (V) вещества: ![]() .
.
4. Масса, объем, число частиц (N), количество теплоты (Q) связаны между собой универсальной физической величиной – количеством вещества – n(или ν):
![]()
![]()
![]()
![]()
5. Относительная плотность
(D): ![]()
![]()
6. Массовая доля ω:
элемента в веществе: ![]() ;
; 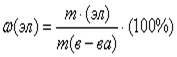 ;
;
примеси в веществе: ;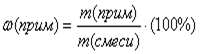
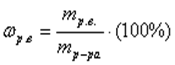
растворенного вещества в растворе: ;
m р-ра = mр.в.+ mр-ля
m р-ра=Vр-ра· ρр-ра.
7. Объемная доля вещества в смеси (φ)
(для газов): 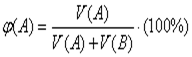 .
.
8. Молярная концентрация (Сm или С): 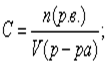 .
.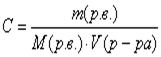
9. Уравнение Клапейрона -
Менделеева: ![]() .
.
Учащиеся могут пользоваться такой подсказкой

Расчеты по химическим формулам.
Решение данного типа задач начинается с осмысления понятия записи химической формулы, с осмыслением того, что обучающиеся могут узнать по записи химической формулы. Молекулярная (истинная) формула показывает действительное число атомов каждого элемента в молекуле.
Молярная
масса – это отношение массы вещества к количеству вещества, т.е.
М(х) =
m(x)/ν(x),
где М(х) – молярная масса вещества Х, m(x) – масса вещества Х, ν(x) –
количество вещества Х. Единица СИ молярной массы – кг/моль, однако обычно
используется единица г/моль. Единица массы – г, кг. Единица СИ количества
вещества – моль.
Алгоритм решения базовой задачи.
1. Заданный по условиям параметр переводим в количество вещества (n или ν).
2. По индексам определяем количество вещества искомого химического элемента (n(х) или ν(х)).
3. По формулам, отображающим взаимосвязь величин, рассчитываем неизвестный параметр.
Графическая схема решения базовой задачи.

Расчёты по химическим уравнениям.
Химическими уравнениями называют условную запись химической реакции посредством химических знаков, формул и коэффициентов.
Уравнение химической реакции показывает, какие вещества вступают в реакцию и какие образуются, а также соотношение количеств этих веществ. Иными словами, химическое уравнение – это способ выражения (передачи) качественной и количественной информации о химическом явлении.
Запишем уравнение реакции в общем виде: aA + bB ® cC +dD, где А и В – исходные вещества, С и D – продукты реакции, a, b, c, d – стехиометрические коэффициенты.
Стехиометрические коэффициенты подбирают на основе того, что число атомов каждого элемента до и после реакции остается неизменным. Это можно рассматривать как следствие закона сохранения массы.
Рассмотрим информацию, содержащуюся в стехиометрических коэффициентах.
Отношение стехиометрических коэффициентов равно:
отношению числа частиц, вступивших в реакцию и образовавшихся в результате реакции
a : b : c : d = N(A) : N(B) : N(C) : N(D)
отношению молярных количеств веществ, вступивших в реакцию и образовавшихся в результате реакции a : b : c : d = n(A) : n(B) : n(C) : n(D)
отношению объемов, вступивших в реакцию и образовавшихся в результате реакции газообразных веществ a : b : c : d = V(A) : V(B) : V(C) : V(D).
Последнее отношение выполняется, если:
1. это газообразные вещества, близкие по свойствам к идеальному газу,
2. объемы этих газов измерены при одинаковом давлении и температуре.
Несмотря на большое разнообразие задач данного типа, принцип решения их одинаков: по известному параметру (N, m, V) одного вещества рассчитывается неизвестный параметр X (Nx, mx, Vx) другого вещества. Такая задача является простейшей (базовой).
Алгоритм решения базовой задачи (последовательность действий).
1. Составляем уравнение химической реакции и выписываем мольные соотношения прореагировавших и получившихся веществ.
2. По формулам, отображающим взаимосвязь физических величин, переводим заданную по условию величину в количество (n или ν) исходного вещества.
3. По мольным отношениям рассчитываем n определяемого вещества (Х).
4. По формулам, отображающим взаимосвязь физических величин, рассчитываем неизвестный параметр X.
Графическая схема решения базовой задачи.
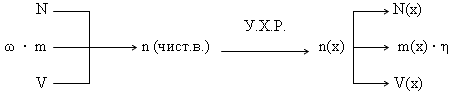
Усложнение базовой задачи.
Расчет массы реагирующих или образующихся химических соединений на практике осложнен. Это обусловлено несколькими причинами:
1. Исходные вещества или продукты реакции задаются в условиях. отличающихся от нормальных.
2. Исходные вещества вводятся в виде растворов.
3. Во многих случаях реагенты содержат примеси, которые в данной конкретной реакции либо не участвуют вообще, либо образуют отличные от целевого продукта вещества.
4. Выход продуктов не соответствует теоретическому, т.к. очистка целевого вещества приводит не только к освобождению от многочисленных примесей, но и к частичной потери основного вещества.
Таким образом, перед использованием исходных данных для решения задачи и подстановки их в основную цепь расчетов необходимо провести те или иные дополнительные преобразования. Для перевода условий, отличных от нормальных (для газообразных веществ) используется исходная формула 9 - расчеты физико-химических величин по управлению Клапейрона - Менделеева.
Расчет количественных параметров продуктов реакции, если исходные вещества содержат примеси, расчет массовой доли примеси.
Абсолютно чистого вещества в природе не бывает, поэтому в химических производствах вынуждены использовать исходные вещества, содержащие примеси. Эти примеси обычно имеют отличные от основного вещества свойства и, поэтому не образуют в процессе производства нужные продукты.
В связи с этим, чтобы определить количественные параметры получаемого продукта, необходимо вначале рассчитать количественные параметры вступающего в реакцию чистого вещества, которое содержится в исходном объекте. После этого решается базовая задача.
Обратные задачи заключаются в оценке чистоты исходных веществ по количеству продуктов реакции.
Содержание примеси обычно выражают в частях от единицы (или выражают в %). Эта величина показывает массовую долю чистого вещества (примеси) в исходном образе (формула 1).
Для вычисления массы чистого вещества (или примесей), содержащегося в смеси, используют формулу 2.
![]() (1)
(1)
m(смеси) = m(осн.в.) + m(прим.) (2)
Используйте алгоритмы для решения задач
Алгоритм №1 Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
Дано:
ν(Н2О)=6моль
_____________
Найти:
ν(О2)=?
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
Решение:
М(О2)=32г/моль
3. Запишем уравнение реакции
и расставим коэффициенты
2Н2О=2Н2+О2
4. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –
стехиометрические коэффициенты,
отображаемые уравнением реакции
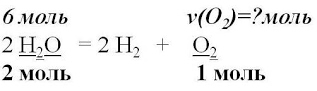
5. Для вычисления искомого количества вещества,
составим соотношение
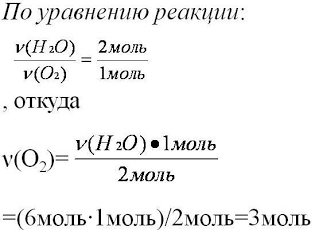
6. Записываем ответ
Ответ: ν (О2)=3моль
Алгоритм №2 Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
Дано:
ν(Al2O3)=8моль
___________
Найти:
m(Al)=?
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
M(Al2O3)=102г/моль
3. Запишем уравнение реакции
и расставим коэффициенты
4 Al + 3O2 = 2Al2O3
4. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –
стехиометрические коэффициенты,
отображаемые уравнением реакции
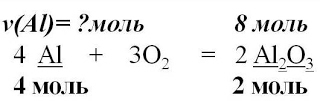
5. Вычислим количества вещества, массу которого
требуется найти. Для этого составим соотношение.

6. Вычисляем массу вещества, которую требуется найти
m=ν∙M,
m(Al)=ν(Al)∙M(Al)=16моль∙27г/моль=432г
7. Записываем ответ
Ответ: m (Al)=432 г
Алгоритм №3 Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Дано:
m(Cu)=19,2г
___________
Найти:
ν(Cu2O)=?
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
М(Cu)=64г/моль
3. Найдём количество вещества, масса которого
дана в условии задачи
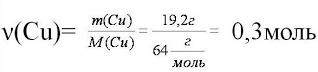
4. Запишем уравнение реакции
и расставим коэффициенты
4 Cu + O2 = 2 Cu2O
5. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –
стехиометрические коэффициенты,
отображаемые уравнением реакции
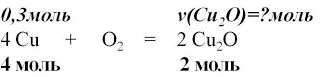
6. Для вычисления искомого количества вещества,
составим соотношение

7. Запишем ответ
Ответ: ν(Cu2O)=0,15 моль
Алгоритм №4 Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Дано:
m(P)=0,31г
_________
Найти:
m(O2)=?
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
М(P)=31г/моль
M(O2)=32г/моль
3. Найдём количество вещества, масса которого дана в условии задачи
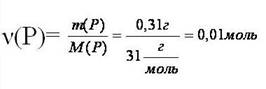
4. Запишем уравнение реакции
и расставим коэффициенты
4P + 5O2 = 2P2O5
5. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –
стехиометрические коэффициенты,
отображаемые уравнением реакции
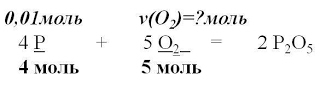
6. Вычислим количества вещества, массу которого необходимо найти
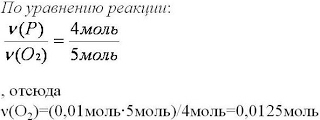
7. Найдем массу вещeства, которую требуется вычислить
m(O2)=ν(O2)∙M(O2)=
0,0125моль∙32г/моль=0,4г
8. Запишем ответ
Ответ: m(O2)=0,4г
Решение задач с оформлением
Не
для муки, а для науки.
Народная мудрость
1. Вычисление относительной молекулярной и относительной формульной масс веществ по химическим формулам .
Пример 1. Вычислите относительные молекулярные массы веществ: H2S, HNO3, C6H12O6 и относительные формульные массы веществ: Fe2O3, K2CO3, Cu(NO3)2.
Решение. Mr(H2S) = 2Ar(H) + Ar(S) = 2·1 + 32 = 34;
Mr(HNO3) = Ar(H) + Ar(N) + 3Ar(O) = 1+ 14 + 3·16 = 63;
Mr(C6H12O6) = 6Ar(C) + 12Ar(H) + 6Ar(O) = 6·12 + 1·12 + 6·16 = 180;
Mr(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2·56 + 3·16 = 160;
Mr(K2CO3) = 2Ar(K) + Ar(C) + 3Ar(O) = 2·39 + 12 + 3·16 = 138;
Mr(Cu(NO3)2) = Ar(Cu) + 2(Ar(N) + 3Ar(O)) = 64 + 2(14 + 3·16) = 188.
2. Вычисление массовой доли элемента по формуле вещества.
Пример 2. Вычислите массовые доли элементов в серной кислоте.
Дано:
H2SO4
Решение
1.
Для решения задачи используем формулу: w =![]() .
.
2. Вычисляем относительную молекулярную массу серной кислоты:
Mr(H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O) = 2·1 + 32 + 4·16 = 98;
3. Определяем массовые доли каждого элемента:
w(H)
= ![]() =
= ![]() = 0,02
(2%);
= 0,02
(2%);
w(S) = ![]() =
= ![]() = 0,33
(33%);
= 0,33
(33%);
w(O) = 100% - w(H) - w(S) = 100% - 2% - 33% = 65%.
Ответ: w(H) = 2%; w(S) = 2%; w(O) = 65%.
Найти
w(H), w(S),
w(O)
3. Вычисление химического количества вещества по его массе и массы вещества по его химическому количеству.
Пример 3. Вычислите химическое количество углекислого газа массой 8,8 г.
Дано:
m(CO2) = 8,8 г
Решение
1.
Для решения задачи используем формулу: n =![]() .
.
2. Вычисляем молярную массу CO2:
Mr(CO2) = Ar(C) + 2Ar(O) = 12+ 2·16 = 44;
M(CO2) = 44 г/моль;
3. Определяем химическое количество CO2:
n(CO2)
= 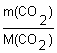 =
= ![]() = 0,2 моль;
= 0,2 моль;
Ответ: химическое количество углекислого газа массой 8,8 г составляет 0,2 моль.
Найти
n(CO2)
Пример 4. Вычислите массу углекислого газа, химическое количество которого составляет 0,2 моль.
Дано:
n(CO2) = 0,2 моль
Решение
1. Для решения задачи используем формулу: m = n· M.
2. Вычисляем молярную массу CO2:
Mr(CO2) = Ar(C) + 2Ar(O) = 12+ 2·16 = 44;
M(CO2) = 44 г/моль;
3. Определяем массу CO2:
m(CO2) = n(CO2) · M(CO2) = 0,2 моль· 44 г/моль = 8,8 г;
Ответ: масса порции углекислого газа химическим количеством 0,2 моль равна 8,8 г.
Найти
m(CO2)
4. Вычисление химического количества газа по его объему и объема газа по его химическому количеству.
Пример 5. Вычислите химическое количество углекислого газа объемом 4,48 дм3.
Дано:
V(CO2) = 4,48 дм3
Решение
1.
Для решения задачи используем формулу: n =![]() .
.
2. Определяем химическое количество CO2:
n(CO2)
= 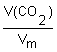 =
= 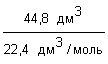 = 0,2 моль;
= 0,2 моль;
Ответ: химическое количество углекислого газа объемом 8,8 дм3 составляет 0,2 моль.
Найти
n(CO2)
Пример
6. Вычислите
объем углекислого газа, химическое количество которого составляет 0,2 моль.![]()
Дано:
n(CO2) = 0,2 моль
Решение
1. Для решения задачи используем формулу: V = n· Vm.
2. Определяем объем CO2:
V(CO2) = n(CO2) · Vm = 0,2 моль· 22,4 дм3/моль = 44,8 дм3;
Ответ: объем порции углекислого газа химическим количеством 0,2 моль равен 44,8 дм3.
Найти
V(CO2)
5. Вычисление по химическим уравнениям массы, химического количества и объема (для газов) по известным массе, химическому количеству и объему (для газов) одного из вступивших в реакцию или полученных веществ.
Пример 7. Вычислите массу хлорида калия и объем кислорода, образовавшихся в результате реакции разложения хлората калия (KClO3) массой 4,9 г.
Дано:
m(KClO3) = 4,9 г
Решение
1. Составляем уравнение реакции разложения хлората калия:
0,04 моль 0,04 моль 0,06 моль
2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
2 моль 2 моль 3 моль
2. Для
решения используем формулы: n =![]() ; m = n· M; V = n· Vm.
; m = n· M; V = n· Vm.
Найти
m(KCl),V(O2)
3. Вычисляем молярные массы KClO3 и KCl:
Mr(KClO3) = Ar(K) + Ar(Cl) + 3Ar(O) = 39 + 35,5 + 3·16 = 122,5;
M(KClO3) = 122,5 г/моль;
Mr(KCl) = Ar(K) + Ar(Cl) = 39 + 35,5 = 74,5;
M(KCl) = 74,5 г/моль;
4. Определяем химическое количество KClO3:
n(KClO3)
= 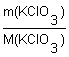 =
= ![]() = 0,04 моль;
= 0,04 моль;
5. По уравнению реакции находим химические количества образовавшихся KCl и O2:
n(KCl) = n(KClO3) = 0,04 моль;
n(O2)= 1,5n(KClO3) = 0,06 моль;
6. Вычисляем массу хлорида калия и объем кислорода:
m(KCl) = n(KCl) · M(KCl) = 0,04 моль · 74,5 г/моль = 2,98 г;
V(O2) = n(O2) · Vm = 0,06 моль· 22,4 дм3/моль = 1,34 дм3.
Ответ: образуется хлорид калия массой 2,98 г составляет кислород объемом 1,34 дм3.
1.Вычисление по химическому уравнению реакций массы вещества по известной массе одного из вступающих в реакцию веществ
Пример 1. Смешали два раствора: 33,3г хлорида кальция и достаточное количество фосфата натрия. Вычислите массу осадка.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
Дано:
m(CaCl2)=33,3
Найти: m(Ca3(PO4)2) =?
2. Вычислим молярные массы для формул, записанных в дано
M(CaCl2)=111г/моль
M(Ca3(PO4)2) =310г/моль
3. Вычислим количества веществ, масса которых дана в условии
ν(CaCl2)=m/M=33,3г/111г/моль=0,3моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
3CaCl2 +2NaPO4=_Ca3(PO4)2 +6NaCl
6моль 1 моль
5. Вычислим количество вещества, массу которого нужно найти
По УХР
V (CaCl 2) /V (Ca3(PO4)2 =3/1
Следовательно
V(Ca3(PO4)2) = (0,3 моль .1моль)/3моль= 0,1 моль
6. Вычислим искомую массу
m(Ca3(PO4)2)= ν(Ca3(PO4)2 ∙ M(Ca3(PO4)2) = 0,1моль ∙ 310г/моль =31г
7. Запишем ответ
Ответ: m(Ca3(PO4)2) =31г
2. Вычисление по химическому уравнению реакций объёма вещества по известной массе, одного из продуктов реакции
Пример2 Вычислите объём кислорода при (н.у.), который потребуется для неполного сжигания сероводорода, если в реакции образовалась сера массой 64 г.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
Дано:
н.у.
Vm = 22, 4 л/моль
m (S)= 128г
________________
Найти: V (O2) =?
2. Вычислим молярные массы для формул, записанных в дано
M(S)=32 г/моль
3. Вычислим количества веществ, масса которых дана в условии
ν(S)=m/M= 128/32 г/моль= 4 моль
4. Запишем УХР. Расставим коэффициенты.Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
2 H2S+ _O2 = 2S + 2H2O
1 моль 2 моль
5. Вычислим количество вещества, массу которого нужно найти
По УХР
V (O2)/ V (S) = ½
V (O2) = (4моль .1 моль)/ 2 моль = 2 моль
6. Вычислим искомую массу
V(O2) = ν(O2) · Vm = 2 моль · 22,4 л/моль = 44,8 л
7. Запишем ответ
Ответ: V(O2) = 44,8 л
3. Вычисление по химическому уравнению реакций массовых долей в смесях, где одно из веществ не участвует в реакции
Пример 3. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
Медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
Последовательность выполнения действий
Оформление решения задачи
Находим количество водорода
![]() моль
моль
Запишем уравнение химической реакции
1. По уравнению реакции:
![]()
Количество железа тоже 0,25 моль. Можно найти его массу:
![]() г
г
Теперь можно рассчитать массовые доли металлов в смеси:
![]()
Ответ:
70% железа, 30% меди
5. Вычисление массовой доли и массы растворенного вещества (растворителя).
Пример 6. В воде массой 200 г растворили поваренную соль массой 50 г. Вычислите массовую долю поваренной соли в полученном растворе.
Дано:
m(NaCl) = 50 г
m(H2O) = 200 г
Решение
1.
Для решения задачи используем формулы: w(в-ва) =![]() ;
;
m(р-ра) = m(в-ва) + m(р-ля).
2. Определяем массу раствора:
m(р-ра) = m(NaCl) + m(H2O) = 50 г + 200 г = 250 г.
3. Определяем массовую долю соли в растворе:
w(NaCl) = ![]() =
=![]() = 0,2 (20%).
= 0,2 (20%).
Найти
w(NaCl)
Ответ: массовая доля поваренной соли в полученном растворе составляет 0,2 (20%).
Пример 7. Необходимо приготовить водный раствор сахара массой 200 г с массовой долей сахара 0,05 (5%). Рассчитайте, массу сахара и массу воды, которые для этого потребуются.
Дано:
m(р-ра) = 200 г
w(сахара) = 0,05 (5%)
Решение
1. Для решения задачи используем формулы:
m(в-ва) = w(в-ва) · m(р-ра); m(р-ля) = m(р-ра) – m(р-ля).
2. Определяем массу сахара:
m(сахара) = w(сахара) · m(р-ра)= 0,05 · 200 г = 10 г.
3. Определяем массу воды:
m(H2O) = m(р-ра) – m(сахара) = 200 г – 100 г = 190 г
Найти
m(сахара),
m(H2O)
Ответ: для приготовления раствора потребуется сахар массой 10 г и вода массой 190 г.
Расчетные задачи и их решение
Задача 1. При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
BaO + H2SO4 = BaSO4 + H2O
m(BaSO4) = 100 г; M(BaSO4) = 233 г/моль
n(BaO) = ?
n(H2SO4) = ?
В соответствии с коэффициентами уравнения реакции, которые в нашем случае все равны 1, для получения заданного количества BaSO4 требуются:
n(BaO) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100 : 233
[г : (г/моль)] = 0,43 моль
n(H2SO4) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100 : 233
[г : (г/моль)] = 0,43 моль
Ответ. Для получения 100 г сульфата бария требуются 0,43 моль оксида бария и 0,43 моль серной кислоты.
Задача 2. Прежде чем вылить в канализацию жидкие отходы лабораторных работ, содержащие соляную кислоту, полагается их нейтрализовать щелочью (например, гидроксидом натрия) или содой (карбонатом натрия). Определите массы NaOH и Na2CO3, необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?
Решение. Запишем уравнения реакций и условия задачи в формульном виде:
(1) HCl + NaOH = NaCl + H2O
(2) 2HCl + Na2CO3 = 2NaCl + H2O + CO2
n(HCl) = 0,45 моль; M(NaOH) = 40 г/моль;
M(Na2CO3) = 106 г/моль; VM = 22,4 л/моль (н.у.)
n(NaOH) = ? m(NaOH) = ?
n(Na2CO3) = ? m(Na2CO3) = ?
V(CO2) = ? (н.у.)
Для нейтрализации заданного количества HCl в соответствии с уравнениями реакций (1) и (2) требуется:
n(NaOH) = n(HCl) = 0,45 моль;
m(NaOH) = n(NaOH) . M(NaOH) = 0,45 . 40
[моль . г/моль] = 18 г
n(Na2CO3) = n(HCl) / 2 = 0,45 : 2 [моль] = 0,225 моль;
m(Na2CO3) = n(Na2CO3) / M(Na2CO3) = 0,225 . 106
[моль . г/моль] = 23,85 г
Для расчета объема углекислого газа, выделившегося при нейтрализации по реакции (2), дополнительно используется уравнение, связывающие между собой количество газообразного вещества, его объем и молярный объем:
n(CO2) = n(HCl) / 2 = 0,45 : 2 [моль] = 0,225 моль;
V(CO2) = n(CO2) . VM = 0,225 . 22,4 [моль . л/моль] = 5,04 л
Ответ. 18 г NaOH; 23,85 г Na2CO3; 5,04 л CO2
Задача 3. Антуан-Лоран Лавуазье открыл природу горения различных веществ в кислороде после своего знаменитого двенадцатидневного опыта. В этом опыте он сначала длительное время нагревал в запаянной реторте навеску ртути, а позже (и при более высокой температуре) - образовавшийся на первом этапе опыта оксид ртути(II). При этом выделялся кислород, и Лавуазье стал вместе с Джозефом Пристли и Карлом Шееле первооткрывателем этого важнейшего химического элемента. Рассчитайте количество и объем кислорода (при н.у.), собранный при разложении 108,5 г HgO.
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
2HgO = 2Hg + O2
m(HgO) = 108,5 г; M(HgO) = 217 г/моль
VM = 22,4 л/моль (н.у.)
V(O2) = ? (н.у.)
Количество кислорода n(O2), который выделяется при разложении оксида ртути(II), составляет:
n(O2) = 1/2 n(HgO) = 1/2 m(HgO) / M(HgO) = 108,5 / (217 . 2}
[г : (г/моль)] = 0,25 моль,
а его объем при н.у. - V(O2) = n(O2) . VM = 0,25 . 22,4
[моль . л/моль] = 5,6 л
Ответ. 0,25 моль, или 5,6 л (при н.у.) кислорода.
Задача 4. Важнейшая проблема в промышленном производстве удобрений - получение так называемого "связанного азота". В настоящее время ее решают путем синтеза аммиака из азота и водорода. Какой объем аммиака (при н.у.) можно получить в этом процессе, если объем исходного водорода равен 300 л, а практический выход (z) - 43 %?
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
N2 + 3H2 = 2NH3
V(H2) = 300 л; z(NH3) = 43% = 0,43
V(NH3) = ? (н.у.)
Объем аммиака V(NH3), который можно получить в соответствии с условием задачи, составляет:
V(NH3)практ = V(NH3)теор . z(NH3) = 2/3 . V(H2) . z(NH3) =
= 2/3 . 300 . 0,45 [л] = 86 л
Ответ. 86 л (при н.у.) аммиака.
Задачи для самостоятельного решения
1. 50 г йодистого метила в гексане подействовали металлическим натрием, при этом выделилось 1,12 л газа, измеренного при нормальных условиях. Определите массовую долю йодистого метила в растворе.
2. Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 13,2 г этой кислоты получили углекислый газ, для полной нейтрализации которого потребовалось 192 мл раствора КОН с массовой долей 28%. Плотность раствора КОН равна 1,25 г/мл. Определите формулу спирта.
3. Газ , полученный при взаимодействии 9,52 г меди с 50 мл 81 % раствора азотной кислоты, плотностью 1,45 г/мл, пропустили через 150 мл 20 % раствора NaOH плотностью 1,22 г/мл.
Определите массовые доли растворенных веществ.
4.Определите объем выделившихся газов при взрыве 10 г нитроглицерина.
5. Образец органического вещества массой 4,3 г сожгли в кислороде. Продуктами реакции являются оксид углерода (IV) объемом 6,72 л (нормальные условия) и вода массой 6,3 г. Плотность паров исходного вещества по водороду равна 43. Определите формулу вещества.
6. Оконные стекла и дверцы вытяжных шкафов в химической лаборатории часто бывают покрыты белым налетом, состоящим из кристаллов хлорида аммония. Причина этого явления - постоянное присутствие в воздухе лабораторий аммиака и хлороводорода. Рассчитайте количество и объем (при н.у.) этих газов, если образовалось 5 г хлорида аммония.
7. Природный газ содержит главным образом метан CH4, но в нем присутствуют и примеси, например, ядовитый сероводород H2S - до 50 г на 1 кг метана. Чтобы удалить примесь сероводорода, можно провести его окисление перманганатом калия в кислой среде до серы. Рассчитайте количество серы, которую можно таким образом выделить из 1 т природного газа. Определите также, какая масса серной кислоты может быть получена, если всю выделенную серу направить в цех производства H2SO4.
8. Толщи известняка на земной поверхности и под землей медленно "размываются" под действием почвенных вод, где растворен диоксид углерода. Какую массу карбоната кальция CaCO3 может перевести в растворимый гидрокарбонат кальция состава Ca(HCO3)2 вода, в которой растворено 10 моль CO2? Практический выход для реакции химического растворения считайте равным 90%.
9. Предельно допустимая среднесуточная концентрация монооксида углерода в воздухе составляет 3,0 мг/м3. Простейший газоанализатор, позволяющий определить наличие в воздухе ядовитой примеси СО, содержит белый порошок оксида иода(V), нанесенный на пемзу и помещенный в стеклянную трубочку. При взаимодействии I2O5 c CO идет окислительно-восстановительная реакция с выделением иода, который окрашивает содержимое трубочки в черный цвет. Какое количество монооксида углерода вызовет выделение 0,1 г иода в трубке газоанализатора? Какой объем воздуха (при н.у.), содержащего 3,0 мг/м3 CO, надо будет пропустить через трубку, чтобы в ней выделилось 0,1 г иода?
10. Коррозия железа на воздухе в присутствии большого количества воды приводит к образованию метагидроксида железа состава FeO(OH). Рассчитайте, какая масса железа подверглась коррозии, если количество полученного в результате этого процесса FeO(OH) составило 11,5 моль. Определите также объем (при н.у.) кислорода, участвовавшего в реакции.
11. При выпечке печенья в качестве разрыхлителя теста используют пищевую соду (гидрокарбонат натрия) с добавкой уксусной кислоты. Эта смесь при нагревании разлагается, выделяя углекислый газ. Рассчитайте объем (при н.у.) CO2, который выделится при использовании 1 чайной ложки (5 г) NaHCO3 и избытка CH3COOH.
12. Взаимодействие минерала магнетита (оксида железа состава Fe3O4) с монооксидом углерода CO приводит к получению железа и выделению углекислого газа CO2. В результате реакции было выделено 65,3 кг железа. Рассчитайте практический выход железа, если масса исходного магнетита составляла 110 кг. Определите объем (при н.у.) полученного газа.
13. Жженую известь, применяемую в строительстве, получают прокаливанием известняка. Определите массовую долю основного вещества (карбоната кальция) в известняке, если прокаливание его образца массой 5,0 кг привело к выделению 1,0 м3 углекислого газа (при н.у.).
14. Карл-Вильгельм Шееле в 1774 году получил кислород термическим разложением перманганата калия KMnO4. Помимо кислорода, при этом получаются оксид марганца(IV) и манганат калия K2MnO4. Кислород, выделенный при разложении 33,5 г перманганата калия, использовали для сжигания серы и при этом получили 2,1 л (при н.у.) диоксида серы SO2. Определите практический выход кислорода при разложении перманганата калия. Рассчитайте массу серы, затраченной на сжигание.
15. Разбитый термометр, в котором было 20,5 г ртути, выбросили в пруд. Прошло 4 месяца, и вследствие сложных биохимических процессов около 5% этого опасного металла перешло в раствор в виде солей ртути(II) типа нитрата ртути(II) Hg(NO3)2. Определите количество и массу катионов ртути(II) в пруду. Определите, представляет ли опасность прудовая вода, если объем воды в пруду 80 м3, а санитарная норма предусматривает содержание не более чем 0,01 г Hg2+ в 1 м3.
16. Для обеззараживания воды ее часто хлорируют. При этом неизбежна утечка ядовитого газа в атмосферу. Чтобы удалить хлор из вентиляционного воздуха, используют "антихлор" - увлажненный сульфит натрия Na2SO3. Какая масса сульфита натрия потребуется для поглощения всего хлора из 5000 м3 воздуха, если содержание в нем Cl2 в 10 раз превышает среднесуточное предельно допустимое и составляет 0,3 мг/м3?
17. Рассчитайте объем (при н.у.) хлора, который идет на обеззараживание 10 м3 воды, если на каждый литр воды расходуется 0,002 мг хлора. Напишите уравнение реакции взаимодействия хлора с водой и поясните, на чем основано его обеззараживающее действие.
18. При сильных отравлениях белым фосфором пострадавшему назначают прием очень разбавленного раствора сульфата меди(II). Процессы, протекающие в организме больного, сводятся к окислительно-восстановительной реакции фосфора с катионами меди(II) с выделением металлической меди и образованием относительно безвредных количеств ортофосфорной и серной кислоты. Какое количество и массу сульфата меди(II) должен получить пострадавший для полного окисления 0,1 мг фосфора, если считать выход этого процесса 100%-ным?
19. Пролитую ртуть можно собрать с помощью медной проволоки, алюминиевой фольги и даже листом бумаги, но во всех этих случаях собранную ртуть нужно обезвредить (например, обработать концентрированной азотной кислотой). Какое количество HNO3 потребуется для обезвреживания 19,5 г ртути, собранной на полу после того, как в доме был разбит термометр? Каков объем выделяющегося при этом газа (при н.у.)? Если ртуть была собрана не полностью, рекомендуют обработать трещины и щели пола и другие "подозрительные" места в комнате порошком серы. Напишите уравнение реакции, протекающей с участием ртути и серы.
20. Оксид диазота ("веселящий газ"), обладающий слабонаркотическим действием был открыт английским химиком Гемфри Дэви в начале XIX века. Для получения N2O Дэви использовал реакцию термического разложения нитрата аммония. При этом, помимо основных продуктов разложения, образуются и другие газы (например, NO и NO2). Рассчитайте практический выход оксида диазота, если масса нитрата аммония была равна 11,5 г, а объем полученного N2O - 2,1 л (при н.у.)
21. Установлено, что для очистки газовых выбросов от диоксида азота применяется карбонат натрия, который при взаимодействии с NO2 дает нитрат натрия, нитрит натрия и углекислый газ. Рассчитайте массу карбоната натрия, который обезвреживает выбросы, содержащие 5 л диоксида азота (при н.у.).
22. Органические вещества растений образуются из углекислого газа, присутствующего в воздухе, и воды, поступающей из почвы. В зеленых листьях растений эти неорганические вещества превращаются в органическое вещество глюкозу C6H12O6. Этот процесс сопровождается выделением кислорода. Рассчитайте, какой объем кислорода (при н.у.) выделяется в атмосферу зелеными растениями при образовании 1 кг глюкозы.
23. Сжигая органическое топливо, человечество ежегодно отправляет в атмосферу 12 млн. т оксида азота(II) NO. Какую массу азотной кислоты можно было бы получить из всего этого количества NO при условии, что практический выход составит 80%?
24. Каждый автомобиль расходует в год примерно 4 т кислорода. Какую массу оксида ртути(II) HgO следует подвергнуть разложению с выделением кислорода, чтобы обеспечить годовую потребность одного автомобиля?
25. Известно, что сероводород, циркулируя в биосфере, может окисляться под действием аэробных бактерий до свободной серы. Именно это, как полагают геохимики, было причиной возникновения залежей самородной серы. Рассчитайте, какой объем (при н.у.) сероводорода был поглощен и переработан бактериями, если образовалось 450 т серы.
Ответы
1. 28,4 %
2. бутанол
3. 12,5% NaOH; 6,48% NaNO3; 5,26% NaNO2.
4. 7,15 л
5. С6 Н14
6. 0,093 моль (2,09 л) NH3 и 0,093 моль (2,09 л) HCl
7. 50 кг серы и 153 кг H2SO4
8. 900 г CaCO3
9. 0,0020 моль CO; 18 м3 воздуха
10. 644 г железа,193,2 л O2
11 . 33 л CO2
12. . Практический выход 82%
13. 0,893, или 89,3% карбоната кальция в известняке
14. Практический выход 88,4%, масса серы 3,0 г
15. 0,051 моль (1,025 г) Hg2+; вода опасна для здоровья, так как в ней содержится 0,013 г/м3 Hg2+ (выше нормы)
16. 2,66 г Na2SO3
17. 6,3 мл Cl2
18. 8,01 . 10--6 моль; 1,29 мг CuSO4
18. 0,39 моль HNO3; 4,35 л NO2
29. Практический выход 65,2%
21. 11,8 кг Na2CO3
22. 746,7 л кислорода
23. 20,2 млн.т азотной кислоты
24. 54,1 т HgO
25 . 315000 м3 H2S (при н.у.)
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.