
19 № Сабақ / Урок № 19
Сабақ жоспары / План урока
Сабақтың тақырыбы / Тема урока
Насыщенный и ненасыщенный пар. Влажность воздуха. Фазовые диаграммы, тройная точка, критическое состояние вещества.
1. Насыщенные и ненасыщенные пары
У отдельной части молекул всегда имеется возможность покинуть жидкость, срываясь с ее поверхности за счет избытка кинетической энергии теплового движения. Процесс перехода вещества из жидкого состояния в газообразное, называется парообразованием. Чем выше температура жидкости, тем быстрее идет парообразование.
Различают два вида парообразования: испарение и кипение. Парообразование, происходящее при любой температуре и только с поверхности жидкости, называется испарением. Пар – это газ, образующийся за счет испарения. При испарении жидкость охлаждается.
Определенная часть испарившихся молекул, совершая хаотическое движение, должна вновь попасть на поверхность жидкости и превратиться в ее молекулы. Таким образом, наряду с процессом испарения одновременно происходит и обратный процесс, который называется конденсацией.
Конденсация – это процесс перехода вещества из газообразного состояния в жидкое, вследствие его охлаждения или сжатия. Число конденсирующихся при данной температуре молекул тем больше, чем выше давление пара над жидкостью.
В открытом сосуде процесс испарения жидкости преобладает над процессом конденсации. В закрытом же сосуде устанавливается, так называемое, динамическое равновесие между жидкостью и паром, при котором процессы испарения и конденсации компенсируют друг друга. Пар, находящийся в динамическом равновесии со своей жидкостью называется насыщенным паром.
Ø При постоянной температуре, давление насыщенного пара не зависит от занимаемого им объема.
Ø При постоянном объеме, давление насыщенного пара сильно зависит от температуры, так что закон Шарля к насыщенным парам неприменим. При повышении температуры жидкость испаряется быстрее, чем конденсируется пар. Именно увеличение плотности пара вносит основной вклад в резкое повышение давления.
Если испарение жидкости преобладает над конденсацией или жидкость полностью испарилась, то находящийся над ней пар называется ненасыщенным.
К парам жидкости можно применять законы, установленные для идеального газа, но лишь в тех случаях, когда пар далек от насыщения.
2. Относительная и абсолютная влажность воздуха
Величина, характеризующая наличие водяных паров в атмосфере Земли, называется влажностью.
Масса водяных паров, содержащаяся в 1м3 воздуха при данных условиях, называется абсолютной влажностью f воздуха. Обычно ее выражают не в системе единиц СИ, а в единицах (г/м3):
f = ρпар (г/м3) ≈ p (мм.рт.ст).
Здесь под давлением водяного пара понимается его парциальное давление, т.е. давление, которое создавал бы водяной пар, если не было бы других компонент, составляющих атмосферу – азота, кислорода и т.д.
Относительной влажностью φ воздуха называется величина, равная отношению давления водяного пара в воздухе p к давлению насыщенного пара воды pн при температуре атмосферы:
φ=(p/pн)·100%.
Значения величины pн определяются из соответствующих таблиц. Относительная влажность воздуха повышается с понижением его температуры, так как чем ниже температура воздуха, тем водяной пар ближе к насыщению.
Для измерения относительной влажности используется специальный прибор - психрометр.
3. Точка росы
Температура, при которой ненасыщенный ранее пар становится в процессе охлаждения насыщенным, называется точкой росы. При температуре, равной точке росы водяной пар атмосферы начинает конденсироваться. Возникает туман, выпадает роса, твердые поверхности запотевают.
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
|
|
|
Рисунок 1 |
Если изотермически сжимать ненасыщенный пар при T < Tкр, то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Кипение – это интенсивное испарение жидкости, происходящее не только со свободной поверхности, но и во всем объеме жидкости внутрь полости образующихся пузырьков пара
Если жидкость прогрета неравномерно, то при всплытии пузырьков давление внутри них падает за счет конденсации пара и они захлопываются. Когда жидкость достаточно прогреется, пузырьки перестают схлопываться и свободно всплывают на поверхность. Жидкость закипает (Рисунок 1).
Давление внутри пузырька определяется тремя слагаемыми:
p = p0 +ρgh +2σ/r,
где p0 – внешнее давление, ρgh – гидростатическое давление вышележащих слоев жидкости высотой h, 2σ/r – давление, связанное с искривлением поверхности пузырька радиуса r, ρ и σ - плотность и коэффициент поверхностного натяжения жидкости).
Кипение начинается при выполнении условия:
pн ≥ p0 +ρgh +2σ/r,
где pн – давление насыщенного пара.
Обычно 2σ/r<< p0 и ρgh << p0. Тогда условие кипения принимает вид:
pн ≥ p0
Таким образом, кипение жидкости наступает в том случае, когда температура всей жидкости одинакова, а давление насыщенного пара обычно равно или чуть больше внешнего давления на ее поверхность.
Температура, при которой давление насыщенного пара жидкости равно внешнему давлению, называется температурой кипения.
Температура кипения жидкости при нормальном атмосферном давлении называется точкой кипения.
Температура кипения повышается с ростом внешнего давления на поверхность жидкости и понижается при его уменьшении. У различных жидкостей температура кипения различна при прочих равных условиях.
Изображенная на Рисунке 2 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние.
При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия.
Примером может служить кривая равновесия p0 (T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (Рисунок 2). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
|
|
|
Рисунок 2 - Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество |
Кривая 0T, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 105 Па. Такие вещества при нагревании при атмосферном давлении плавятся.
Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·102 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина.
Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Домашнее задание:
· составить конспект;
· прочесть «Физика 10 класс. 1 часть», с. 234 – 244;
· выполнить практическую работу (представлена ниже) с нового листа в рабочей тетради, оформить как лабораторную работу: тема, цель, оборудование, задания, контрольный вопрос, вывод.
· сфотографировать конспект и практическую домашнюю работу поместить в ворд!!! и прикрепить на портал
Практическая домашняя работа
Тема: «Определение относительной влажности воздуха с помощью психрометра»
Цель: изучить устройство и принципы работы психрометра, научиться определять влажность воздуха с помощью психрометра.
Оборудование, средства измерения:
1) психрометр, 2) таблицы: психрометрическая и давления насыщенных паров воды при разных температурах, 3) фото психрометров
Теоретическое обоснование
Влажность воздуха характеризуется содержанием в нем определенного количества водяных паров.
Различают абсолютную и относительную влажность воздуха.
Абсолютная влажность - это масса водяного пара в 1 м3 влажного воздуха, кг/м3.
Относительная влажность φ - это отношение количества водяных паров, содержащихся в воздухе, к количеству водяных паров, насыщающих воздух при данной температуре и давлении, выражаемое в процентах. Относительная влажность определяется по формуле:
![]()
где: ρп - плотность пара при его парциальном давлении и температуре влажного воздуха, кг/м3; ρн - максимально возможное количество пара в 1м3 насыщенного влажного воздуха, кг/м3 .
Иначе относительную влажность можно определить в процентах следующим образом:
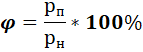
где: рп - парциальное давление; рн - давление насыщенного водяного пара при температуре воздуха.
Психрометры - приборы для измерения влажности воздуха и его температуры. Существуют несколько типов: стационарные, аспирационные, дистанционные. Нашли применение два их типа: станционный психрометр без принудительного обдува и аспирационный психрометр, в котором применяется обдув резервуара смоченного термометра с постоянной скоростью.
Стационарный психрометр Августа предназначен для измерения относительной влажности воздуха в стационарных условиях.
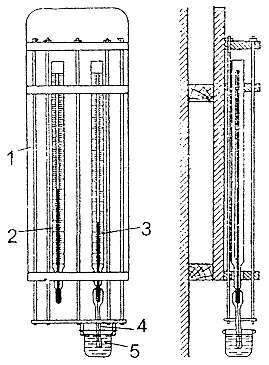 Принцип действия этого прибора основан на разности
показаний "сухого" (2) и "влажного" (3) термометров в
зависимости от влажности окружающего воздуха.
Принцип действия этого прибора основан на разности
показаний "сухого" (2) и "влажного" (3) термометров в
зависимости от влажности окружающего воздуха.
Прибор состоит из двух термометров, укрепленных на щите (1). Чувствительная часть одного из них обернута тканью (4), конец которой опускается в трубку с дистиллированной водой (5). Таким образом, ртутный резервуар одного из термометров всегда остается смоченным, а другой - сухим. Вода, пропитывающая ткань, испаряясь с различной скоростью в зависимости от влажности и скорости движения воздуха, отнимает тепло у термометра и охлаждает его. В результате "влажный" термометр показывает более низкую температуру, чем "сухой".
Чем суше воздух, тем энергичнее происходит испарение, тем больше будет разница между показаниями "сухого" и "влажного" термометров.
Затем для определения влажности воздуха пользуются психрометрическими таблицами по разности между "сухим" и "влажным" термометрами и показанию "влажного" термометра с помощью психрометрической таблицы определяют относительную влажность при скорости движении воздуха до 0,3 м/с.
Внимание! Подвешивать психрометр надо в таком месте, где имеется ток воздуха (на сквозняке). Кроме того, надо следите, чтобы вода смачивала всю марлю, охватывающую шарик термометра.
Задание №1
1) На фотографии представлены два психрометра, используемые для определения относительной влажности воздуха. Ниже приведена психрометрическая таблица, в которой влажность указана в процентах.
|
|
Ответ оформить в виде: Относительная влажность воздуха в помещении, в котором проводилась съемка, равна Рис.1 ___________________; Рис.2___________________.
|
|
|
Рис.1 |
|
Рис.2 |
2) Объясните, почему температура влажного термометра меньше, чем температура сухого.
3) Напишите вывод, используя полученные результаты.
4) Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.