
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
БИРСКИЙ ФИЛИАЛ
ФАКУЛЬТЕТ БИОЛОГИИ И ХИМИИ
КАФЕДРА ХИМИИ И МЕТОДИКИ ОБУЧЕНИЯ ХИМИИ
НАУЧНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА
Лыгин Сергей Александрович
Никитина Диана Станиславовна
Исследование родников Бирского района
Республики Башкортостан
![]() Бирск-2017
Бирск-2017
Содержание
Введение.......................................................................................................... 4
Глава I. Литературный обзор........................................................................... 6
1.1. Строение молекулы воды и свойства воды............................................... 6
1.1.1. Строение молекулы воды....................................................................... 6
1.1.2. Физические свойства воды................................................................... 11
1.1.3. Аномальные физические свойства воды............................................... 11
1.1.4. Химические свойства воды................................................................... 13
1.2. Виды питьевой воды................................................................................ 14
1.2.1. Питьевая вода....................................................................................... 15
1.2.2. Техническая вода.................................................................................. 16
1.2.3. Подземные воды.................................................................................. 17
1.2.3.1. Классификация подземных вод.......................................................... 19
1.3. Проблема загрязнения биосферы ........................................................... 20
1.3.1. Загрязнение гидросферы....................................................................... 21
1.3.1.1 Основные виды загрязнения вод ........................................................ 21
1.3.1.2 Основные источники загрязнения поверхностных и подземных води24
1.4. Гигиенические требования и нормативы качества питьевой воды......... 27
1.4.1. Органолептические показатели............................................................ 27
1.4.2. Химические показатели........................................................................ 29
1.4.2.1. Водородный показатель воды............................................................ 29
1.4.2.2. Общая минерализация....................................................................... 30
1.4.2.3. Жёсткость воды.................................................................................. 30
1.4.2.4. Окисляемость воды............................................................................ 30
1.4.2.5. Органические и неорганические вещества........................................ 31
1.4.3. Микробиологические показатели ........................................................ 31
1.4.4. Радиологические показатели................................................................ 32
1.5. Влияние качества питьевой воды на здоровье человека......................... 33
1.6. Системы критериев качества пресной воды............................................ 34
ГЛАВА II. Объекты и методики исследования ............................................. 35
2.1. Общие требования к отбору проб ........................................................... 35
2.2. Определение органолептических показателей ....................................... 35
2.2.1.Определение температуры..................................................................... 35
2.2.2. Определение мутности воды ............................................................... 35
2.2.3. Определение цветности ..................................................................... 36
2.2.4. Определение запаха воды..................................................................... 37
2.2.5. Определение вкуса и привкуса ........................................................... 37
2.3. Определение физико-химических показателей проб ............................. 38
2.3.1. Измерение водородного показателя и общей ..................................... 38
2.3.2. Измерение массовых концентраций тяжелых металлов .................... 38
2.3.3. Определение радиационного загрязнения .......................................... 38
ГЛАВА III. Результаты и их обсуждение ..................................................... 40
3.1. Органолептические показатели проб воды ........................................... 40
3.2. Физико-химические показатели проб воды .......................................... 41
3.2.1. Измерение и результаты величины водородного показателя ............. 41
3.2.2. Результаты анализов проб воды на показатель общей жесткости ..... 42
3.2.3. Общая минерализация ........................................................................ 43
3.2.4. Результаты измерений массовых концентраций металлов в воде ..... 44
3.2.5. Результаты радиологических исследований ....................................... 46
3.2.3. Расход (дебит) родников....................................................................... 46
ВЫВОДЫ....................................................................................................... 47
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И ЛИТЕРАТУРЫ........... 49
ПРИЛОЖЕНИЯ............................................................................................ 50
Введение
В настоящее время, когда воздействие человека на природу приобрело огромный размах, мы сталкиваемся с измененной человеком природой, со следами его воздействия на окружающую природную среду. Это воздействие бывает разумным, целенаправленным, ориентированным на улучшение свойств окружающей среды. Но чаще всего это оказывает неблагоприятное изменения в окружающей среде, например, потеря способности её самовосстановления и самоочищения, в результате чего возникают проблемы выживания человека или экологические проблемы.
Реже всего человек изменяет гидросеть, но и здесь мы наблюдаем его вторжение в естественную природную среду.
Подземные воды, хотя и скрыты от глаз, но роль их велика как в природе, так и в жизни человека. Они пробиваются на дне рек холодными ключами, выходят на поверхность родниками[1].
Среди множества проблем, стоящих перед человечеством - проблема воды стала одной из наиболее сложно решаемых. Ни одна из проблем, таких как: социально-экономическая, продовольственная, энергетическая не может быть решена, если не будет найдено приемлемое решение водных проблем. Актуальность выбранной темы состоит в важности подземных вод для питания рек, использования их для бытовых и иных нужд. Также велика их дренирующая роль. Проходя через почву, вода обогащается углекислотой и минеральными веществами, поэтому нередко обладает целебными свойствами и применяется для лечения целого ряда заболеваний человека. В последнее время для России жизненно важной проблемой является возвращение к истокам нашей культуры, возрождение идеи чуткого и бережного отношения к различным природным объектам, в том числе и к родникам.
Вода обеспечивает жизнедеятельность человека, играет большую роль в круговороте природы, обеспечивает физиологические, гигиенические, эстетические потребности человека. Для решения этих потребностей необходимо бережное отношение к воде, как следствие, обеспечение ее необходимого качества.
Население Бирского района использует воду различных источников: поступающую к потребителю из централизованного водоснабжения, из скважин, родниковую.
В Бирском районе Республики Башкортостан (РБ) насчитывается несколько родников, из которых жители используют воду в питьевых целях. Для определения качества родниковой воды проведён сравнительный физико-химический анализ трех родников, таких как «Святая вода» деревни Гребени, а также родников села Бахтыбаево и села Новокульчубаево Бирского района Республики Башкортостан.
Основной целью данной работы является исследование эколого-химического состояния родников деревни и двух сел Бирского района Республики Башкортостан.
Для достижения поставленной цели были определены следующие задачи:
- изучить учебную, научную литературу по тематике работы;
- дать оценку органолептическим характеристикам проб воды;
- определить физико-химические показатели проб воды и сравнить с нормативами ПДК.
Мониторинг воды родников проводился по временам года с февраля по январь 2016-2017 годов на базе аналитической лаборатории «Центр лабораторного анализа и технических измерений по Приволжскому федеральному округу» филиал «ЦЛАТИ по Республике Башкортостан» ФГУ «ЦЛАТИ по ПФО» (Аттестат аккредитации выдан 28.10.2011 Федеральному государственному учреждению).
ГЛАВА I. Литературный обзор
1.1. Строение молекулы воды и свойства воды
Вода относится к самым распространённым веществам в природе (около 71 % поверхности Земли – это гидросфера). Вода играет важнейшую роль в геологии, истории планеты. Вода необходима живым организмам, в том числе и для человека, для нормального функционирования и существования в такой же степени, как кислород и пища. Известно то, что тело человека почти на 62% – 69% состоит из воды. Многие биохимические реакции в живых клетках происходят исключительно в водных растворах. Кроме того технологические процессы протекают преимущественно в водных растворах. Так вода используется в различных химических предприятиях, для изготовления лекарственных препаратов и пищевых продуктов в фармацевтической и пищевой промышленности. Водные ресурсы необходимы в металлургии, причём не только для охлаждения. Не случайно гидрометаллургия — извлечение металлов из руд и концентратов с помощью растворов различных реагентов — стала важной отраслью промышленности.
1.1.1. Строение молекулы воды
Поведение воды "нелогично". Получается, что переходы воды из твёрдого состояния в жидкое и газообразное происходит при температурах, намного более высоких, чем следовало бы. Этим аномалиям найдено объяснение. Молекула воды Н2О состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода. Молекула H2O представляет собой треугольник: угол между двумя связками кислород — водород не прямой (90°), а немного больше - 104°, поскольку атомы водорода друг от друга отталкиваются. Таким образом, молекула воды представляет собой маленький диполь, структура которой во многом определяет ее необычные свойства. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. В результате вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода - положительный. Кислород подтягивает к себе отрицательно заряженные электроны, а водород - положительно заряженные электроны.
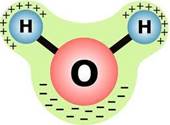
При этом ядра водорода “оголяются”. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр. Атомы водорода в молекуле H2O, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называется водородной. Она объединяет молекулы H2O в своеобразные полимеры пространственного строения; плоскость, в которой расположены водородные связи, перпендикулярны плоскости атомов той же молекулы H2O. Взаимодействием между молекулами воды и объясняются в первую очередь незакономерно высокие температуры её плавления и кипения. Нужно подвести дополнительную энергию, чтобы расшатать, а затем разрушить водородные связи. И энергия эта очень значительна. Вот почему, кстати, так велика теплоёмкость воды.
В молекуле воды имеются две полярные ковалентные связи Н–О.
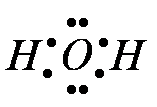
Они образованы за счёт перекрывания двух одноэлектронных р — облаков атома кислорода и одноэлектронных S — облаков двух атомов водорода.
В молекуле воды атом кислорода имеет четыре электронных пары. Две из них участвуют в образовании ковалентных связей, т.е. являются связывающими. Две другие электронные пары являются не связывающими. В молекуле имеются четыре полюс зарядов: два — положительные и два — отрицательные. Положительные заряды сосредоточены у атомов водорода, так как кислород электроотрицательнее водорода. Два отрицательных полюса приходятся на две не связывающие электронные пары кислорода[2].
Подобное представление о строении молекулы позволяет объяснить многие свойства воды, в частности структуру льда. В кристаллической решётке льда каждая из молекул окружена четырьмя другими. В плоскостном изображении это можно представить так:
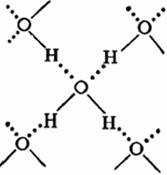
На схеме видно, что связь между молекулами осуществляется посредством атома водорода:
Положительно заряженный атом водорода одной молекулы воды притягивается к отрицательно заряженному атому кислорода другой молекулы воды. Эту связь называют водородной (обозначаются точками). По прочности водородная связь примерно в 15 — 20 раз слабее ковалентной связи. Поэтому водородная связь легко разрывается, что наблюдается, например, при испарении воды.
По структуре жидкая вода схожа со льдом. Молекулы воды также связаны друг с другом посредством водородных связей, однако структура воды менее "жёсткая", чем у льда. Вследствие теплового движения молекул в воде одни водородные связи разрываются, другие образуются.
Рассматривая отдельные молекулы воды можно сказать, что атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его — сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, — по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.1.
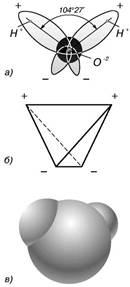
Рис. 1.1.
Строение молекулы воды
а — угол между связями О-H;
б — расположение полюсов заряда;
в — внешний вид электронного облака молекулы воды.
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно — в нем можно различить отдельные сгущения и разрежения. У ядра кислорода ядра накапливается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром — ядром О2- (рис.1.1 а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра — ядра О2-. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра — протоны — оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, молекула воды представляет собой четыре полюса зарядов: два отрицательных (электронная плотность стянута к ядру кислорода) и два положительных (недостаток электронной плотности в ядрах водородов). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.1 б).
Общий вид электронного облака молекулы воды показан на рис. 1.1в. Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким дипольным моментом — 1,87 дебая. Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода является диэлектриком. Поэтому она является хорошим растворителем. Вода относительно хорошо растворяет многие твердые вещества, а так же жидкости и газы в той или иной степени.
Взаимодействие воды с различными веществами сопровождается с получением растворов сложных по составу.
Не исключаем тот факт, что свежевыпавшие осадки несут в себе различные минеральные и органические вещества, растворенные в ней (десятки мг на литр). Пресные природные воды — речные, а так же озерные содержат до 1 грамма на литр этих примесей. Морская вода несет в своем составе до десятков грамм на литр этих солей. К примеру, Балтийское море около 5 г/л, Черное море до 18, Красное море в среднем 40 г/л. На один литр вод океана в среднем приходиться 36 г солей. Высушив все воды океанов, земной шар можно было бы покрыть толщиной около ста метров.
Солевой состав речных и морских вод различен не только количественно, но и качественно. Соли морской воды почти на 89% состоят из хлоридов (в основном это - натрий и кальций), 10% - это сульфаты (натрий, калий и магний), 1% - это карбонаты, а также незначительных количество других солей. Солевой состав пресных вод иной. Он почти на 80% состоит из карбонатов, 13% от сульфатов, около 7% это хлориды и другие соли.
Газовый состав пресных и морских вод представлен зачастую из кислорода (до 6 мг/л в горных реках), азота, углекислого газа, сероводорода (например, глубокие слои Черного моря около 100 мг/л).
Пресные и морские воды в небольших количествах так же содержат и разнообразные органические компоненты — растворимые соединения типа белков, сахаров, спиртов, углеводородов и т. п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства[3].
1.1.2. Физические свойства воды
Вода, H2O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая) у которой нет энергетической ценности; плотность 1 г/см3 (при 3,98 градусах), tпл=0 градусов, tкип=100 градусов.
Три агрегатных состояния воды в земных условиях:
жидкое — вода
твёрдое — лёд
газообразное — пар
Советский учёный В. И. Вернадский писал: "Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могли бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества — минерала горной породы, живого тела, которое её бы не заключало. Всё земное вещество ею проникнуто и охвачено".
1.1.3. Аномальные физические свойства воды
Вода – ценнейший природный ресурс, играющий исключительную роль в функционировании различных физических, химических и биологических процессов. Кроме того, вода – это основа для большинства существующих технологий. Она незаменима в сельском хозяйстве, химической и целлюлозно-бумажной промышленности, черной и цветной металлургии. При этом большая часть используемой в различных сферах человеческой деятельности воды, получив изрядную долю загрязняющих веществ, возвращается в реки в виде стоков.
Современные биолого - химические методы очистки сточных вод такие, как биофильтр и аэротенк, позволяют существенно уменьшить выбросы загрязнений. Однако рост городов, развитие промышленности, сельского хозяйства и связанная с этим возрастающая потребность в воде приводят к тому, что использование существующих технологий начинает требовать непомерных материальных затрат, делая их, таким образом, экономически невыгодными. Проблемы нехватки чистой пресной воды с хорошим количественным и качественным составом стали наиболее сложно решаемыми.
На новый уровень решения сложившихся проблем может помочь перейти новое направление в науке – нанотехнология. Однако здесь мы сталкиваемся с весьма неожиданными трудностями. Несмотря на свою распространенность и повсеместность, а также сотни тысяч научных трудов, посвященных исследованию воды, свойства этого простого вещества до сих пор непонятны до конца. Это связано, прежде всего, с известными аномалиями воды[4], по поводу которых у ученых всего мира по сей день не сложилось единого мнения.
Например, для воды характерно аномально высокая температура кипения и плавления. Плотность воды возрастает в интервале от ста до 4ºС. Это характерно для большинства жидкостей. Однако, вода достигнув максимального значения при температуре 3,98ºС, при дальнейшем охлаждении уменьшается, а при замерзании скачкообразно падает, тогда как почти у всех остальных веществ кристаллизация сопровождается увеличением плотности. Аномальные свойства воды наблюдаются при рассматривании удельной теплоемкости, удельной теплоты плавления и кипения воды. Они сравнительно большие по показателям, чем другие вещества. Минимальную удельную теплоемкость воды наблюдаем, исключительно при 40ºС. Кроме того, вязкость воды с ростом давления уменьшается, а не повышается, как следовало бы ожидать по аналогии с другими жидкостями. Вода способна к значительному переохлаждению, т.е. может оставаться в жидком состоянии ниже температуры плавления.
Как правило, аномалии физических свойств воды связывают со строением и структурой ее молекулы, а также свойственным воде специфическим типом межмолекулярного взаимодействия (водородным связям). Водородные связи возникают по причине неравномерного распределения электронной плотности в молекуле воды. Электронное облако молекулы стягивается в сторону более тяжелого атома кислорода, таким образом, молекула становится полярной. Принципиально водородные связи делятся на два типа: энергетические и геометрические. В первом случае молекулы считаются связанными, если их суммарная потенциальная энергия меньше некоторого порогового значения. В случае геометрического критерия учитываются расстояния и углы между молекулами.
Среднее время жизни водородной связи существенно зависит от термодинамического состояния системы. Эта величина пропорционально возрастает с увеличением температуры, однако имеет обратно пропорциональную зависимость от внешнего давления. При повышении давления наблюдается уменьшение среднего времени жизни водородных связей, что может говорить о связи аномалии вязкости воды с особенностями сетки водородных связей[5].
1.1.4. Химические свойства воды
Молекула воды проявляет свойство дисоциации (распад) молекулы на ионы, а так же вода растворяет многие вещества разной химической природы. Одно из универсальных свойств является растворение, определяемое, прежде всего полярностью её молекулы (смещение центров положительных и отрицательных зарядов) и, как следствие, её чрезвычайно повышенной диэлектрической проницаемостью. Разноименные электрические заряды, и в частности ионы, притягиваются друг к другу в воде в 80 раз слабее, чем притягивались бы в воздухе. Силы взаимного притяжения между молекулами или атомами погружённого в воду тела также слабее, чем на воздухе. Тепловому движению в этом случае легче разобщить молекулы. Оттого и происходит растворение, в том числе многих трудно растворимых веществ: капля камень точит…
Диссоциация (распадение) молекул воды на ионы:
H2O → H++НO-, или 2H2O → H3O+ (ион гидроксония) +ОН
в обычных условиях диссоциация проявляется крайне редко; лишь одна из 500 миллионов молекул. Однако первое уравнение можно считать условным. Так как протон не может существовать без электронной оболочки в водной среде. Он сразу соединяется с молекулой воды, образуя ион гидроксония H3O+. Кроме того, ассоцианты водных молекул обычно распадаются на значительно более тяжёлые ионы. К примеру:
8H2O → HgO4 + H7O4, а реакция H2O → H+ + OH– – всего лишь упрощенный вариант реального процесса.
Реакционная способность воды сравнительно невелика. Правда, некоторые активные металлы способны вытеснять из неё водород:
2Na + 2H2O → 2NaOH + H2↑,
горение воды происходит в атмосфере свободного фтора:
2F2 + 2H2O → 4HF + O2.
Подобные молекулярные ассоциаты являются так же основой кристаллов обычного льда. "Упаковка" атомов в таком кристалле не ионная, и лёд плохо проводит тепло. Плотность жидкой воды при температуре близкой к нулю, больше чем у льда. Объем одного грамма льда при 0°C занимает 1,0905 см3, а 1 грамм жидкой воды — 1,0001 см3. Лёд покрывает поверхность жидкой воды, а сам водоем насквозь не промерзает. В этом проявляется ещё одна аномалия воды: после плавления она сначала сжимается, и лишь достигнув 4 градусов, при дальнейшем увеличении температуры расширяется. При высоких давлениях обычный лёд можно превратить в так называемый лёд — один, лёд — два, лёд — три, и т. д. — более тяжёлые и плотные кристаллические формы этого вещества. Самый твёрдый, плотный и тугоплавкий пока лёд — семь — полученный при давлении 3 кило Паскаль. Температура его плавления достигает 190 градусов.
Природная вода имеет неоднородный изотопный состав: примерно 99,73% легкого изотопа водорода и 0,27 % тяжелых молекул воды. Содержание тяжелых изотопов в воде непостоянно и в зависимости от региона, климатических условий и характера местности варьирует от 0,243 % в зоне Арктики до 0,268 % — в океанической зоне. Процессы замерзания, таяния (также как испарения и конденсации) приводят к изменению количественного состава тяжелых изотопов водорода и кислорода. Наименьшее количество в легкой талой воде, максимальное в тяжелой воде, как и в природной. От наличия тяжелой талой воды и обычной талой (легкой с тяжелой) воды варьируют значения роста растений[6].
1.2. Виды питьевой воды
В природе имеется множество видов воды. Каждый из них отличается рядом свойств: физическими показателями, структурой молекул, химическим составом, биологическим действием на организм человека.
Считается, что наилучшая вода для постоянного употребления - родниковая. Виды воды, ухудшающие здоровье: снежная вода (особенно - несвежая), болотная вода, не свежая кипячёная вода (хранящаяся более суток), водопроводная городская вода[7].
Водопроводная вода (вода из городского водопровода, городского водоснабжения) поступающая для потребления из крана, доставляется в дома коммунальным предприятием по водоснабжению. Как правило, это вода из речных водозаборов. Водопроводная вода очищается от вредных веществ. Но характеризуется содержанием растворенных солей кальция, магния, железа и других элементов.
Дождевая вода хорошо усваивается организмом, способствует более качественному перевариванию и усвоению пищи, сохраняет влагу кожи и поддерживает её в равновесии. Это отличная питьевая вода, но при условии, что она чистая. Состав дождевой воды во многом зависит от территории, над которой образовалось облако, насколько сильно загрязнённая там атмосфера.
Родниковая вода представляет собой грунтовые и подземные воды, имеющие выходы на поверхность. Пробиваясь на поверхность, вода проходит через слои гравия и песка, что обеспечивает ей естественную природную фильтрацию. При данной очистке вода не теряет своих целебных свойств и не меняет структуру и гидрохимический состав. Это отличная питьевая вода, но при условии, что она чистая. В настоящее время практически невозможно гарантировать хорошее качество родниковой воды, так как чистота воды зависит как от сезонных обстоятельств (ливни, паводки, грунтовые воды), так и от выбросов близлежащих промышленных предприятий. Существуют два водоносных горизонта:
• песчаный залегает на глубине 15 - 40 м и отделен от верхнего слоя почвы глинистыми пластами, которые и защищают его от загрязнений;
• артезианский залегает на глубине 30 - 230 м и более, его также называют известняковый водоносный слои.
Артезианская вода надежно защищена от внешнего загрязнения и широко используется в промышленной добыче питьевой воды[8].
Дистиллированная вода практически не содержит примесей и посторонних включений. Её получают перегонкой в дистилляторах. Она не пригодна для питья, так как она не содержит необходимого количества минеральных элементов, а также вымывает из организма не только шлаки и токсины, но и полезные вещества и микроэлементы, следовательно, способна разбалансировать работу организма и может нарушить обмен веществ.
Талая вода способствует выведению из организма шлаков и токсинов. Придаёт энергетическое пополнение у организма. Её свойства сохраняются в течение 7-8 часов после размораживания льда. Талая вода обладает целым комплексом лечебных свойств. С давних пор широко используется в целительной практике[9]. Но в настоящее время чистую талую воду практически невозможно. Это связано с антропогенными факторами загрязнения окружающей среды.
1.2.1. Питьевая вода
Питьевая вода - важнейший фактор здоровья человека. Понятие «питьевая вода» сформировалось сравнительно недавно. Питьевая вода - вода, соответствующая по своему качеству в естественном состоянии или после обработки (очистки, обеззараживания) установленным нормативным требованиям и предназначенная для питьевых и бытовых нужд человека либо для производства пищевой продукции. Речь идёт о требованиях к совокупности свойств и состава воды, при которых она не оказывает неблагоприятного влияния на здоровье человека как при употреблении внутрь, так и при использовании в гигиенических целях, а также при производстве пищевой продукции[10].
Питьевая вода предназначена для ежедневного безопасного потребления человеком и другими живыми существами.
Питьевая вода, полученная непосредственно из высококачественных природных водных источников без применения методов водоподготовки и изначально соответствующая установленным к питьевой воде требованиям, может быть условно названа «натуральной питьевой водой».
Вода, качество которой на уровне питьевого может быть достигнуто лишь после соответствующей водоподготовки, в результате которой изменяются её первоначальный состав и свойства, может быть названа «подготовленной питьевой водой»[11].
1.2.2. Техническая вода
Промышленность является одним из самых крупных потребитель воды. Для выработки 1 т алюминия необходимо 1400 м3 воды, а для выработки 1 т синтетического волокна - 2100 м3. Огромные запасы воды потребляет также и теплоэнергетика. Например: для превращения 1 т угля в электроэнергию тепловой электростанции требуется 1 000 т воды.
Диапазон требований к воде используемой промышленностью довольно широк. В этом отношении показательно изменение технологии подготовки воды для питания паровых котлов. Было время, когда для предохранения котлов и коммуникаций от накипи ограничивались удалением механических примесей и солей, обусловливающие жёсткость воды. Вода умягчалась содоизвестковым методом, далее стали применять фосфатную обработку, катионирование и др. Затем появилась необходимость удалять из воды газы и органические примеси, которые способствовали вскипанию воды в котлах, загрязнению системы питания водой, развитию коррозии.
С переводом электростанций на котлы с паром высоких параметров для питания парогенераторов понадобилась вода по качеству схожая с дистиллированной водой. По трубам современного парового котла ежечасно проходят сотни тонн особо чистой воды. Растворимых солей в ней допускается не более 1 мг/л. Строгими стали требования к содержанию углекислого газа, кислорода, железа, цинка. Дело в том, что в котлах высоких давлений испарение воды происходит в узких трубках топочных экранов, где вместе с кальциево-магниевыми накипями возможно образование алюмо-железо-силикатных и медных отложений. Данные явления доставили много проблем энергетикам и конструкторам турбин[12].
В дополнение к химическим и сорбционным способам борьбы с накипью разработаны чисто физические, безреагентные методы. Эти методы основаны на следующем явлении: при воздействии на воду внешних полей (магнитного, ультразвукового, высокочастотного) тормозится образование накипи или изменяется её структура: кристаллы становятся мелкодисперсными и слабо сцепляются с поверхностью нагрева. Такую накипь, имеющую вид хлопьев шлама, легко удалить продувкой. В практику все шире внедряется экономичный магнитный метод, который основан на изменении структуры накипи. Для удаления газов применяют термическую деаэрацию или продувку смесью азота и окиси углерода. Промышленное применение имеют также методы связывания кислорода восстановительными веществами, такими как сульфит натрия, гидразин. Обработка обескислороженной воды аминами предотвращает коррозионное действие углекислоты. Одни амины (бензи-ламин, морфолин, циклогексиламин) химически связывают свободную углекислоту, другие образуют на поверхности металла защитную пленку.
В промышленности искусственного и синтетического волокна, фото- и кинопленки, органического стекла, на текстильных и бумажных фабриках водопроводную воду для некоторых операций дополнительно очищают от железа, марганца, кремния и взвешенных частиц. На химико-фармацевтических заводах используют дистиллированную воду. Еще более чистая вода нужна в производстве люминофоров, полупроводников, сцинтилляционных, оптических и иных монокристаллов. Она должна быть глубоко обессолена и полностью лишена газов, содержать не более 10-7% железа, тяжелых и цветных металлов.
В настоящее время методами химического обессоливания можно получить техническую воду любой степени очистки. Однако роль физических методов очистки продолжает оставаться значительной, а в ряде случаев самой необходимой[13].
1.2.3. Подземные воды
Подземные воды — это воды, находящиеся в верхней части земной коры (до глубины 12-16 км) в жидком, твердом и парообразном состояниях. Основная масса их образуется вследствие просачивания с поверхности дождевых, талых и речных вод. Подземные воды постоянно перемещаются как в вертикальном, так и в горизонтальном направлениях. Глубина их залегания, направление и интенсивность движения зависят от водопроницаемости пород. К водопроницаемым породам относят галечники, пески, гравий. К водонепроницаемым (водоупорным), практически не пропускающим воду — глины, плотные без трещин горные породы, мерзлые грунты. Слой горной породы, в котором заключена вода, называется водоносным.
По условиям залегания подземные воды подразделяют на три вида: почвенные, находящиеся в самом верхнем, почвенном слое; грунтовые, залегающие на первом от поверхности постоянном водоупорном слое; межпластовые, находящиеся между двумя водоупорными пластами. Грунтовые воды питаются просочившимися атмосферными осадками, водами рек, озер, водохранилищ. Уровень грунтовых вод колеблется по сезонам года и различен в разных зонах. Так, в тундре он практически совпадает с поверхностью, в пустынях находится на глубине 60-100 м. Распространены они почти повсеместно, не обладают напором, перемещаются медленно (в крупнозернистых песках, например, со скоростью 1,5-2,0 м в сутки). Химический состав подземных вод неодинаков и зависит от растворяемости прилегающих пород. По химическому составу различают пресные (до 1 г солей на 1 л воды) и минерализованные (до 50 г солей на 1 л воды) подземные воды. Естественные выходы подземных вод на земную поверхность называется источниками (родниками, ключами). Они образуются обычно в пониженных местах, где земную поверхность пересекают водоносные горизонты. Источники бывают холодными (с температурой воды не выше 20°С, теплыми (от 20 до 37°С) и горячими, или термальными (свыше 37°С). Периодически фонтанирующие горячие источники называются гейзерами. Они находятся в областях недавнего или современного вулканизма (Исландия, Камчатка, Новая Зеландия, Япония). Воды минеральных источников содержат разнообразные химические элементы и могут быть углекислыми, щелочными, соляными и т.д. Многие источники имеют лечебные свойства для живых организмов[14].
Подземные воды пополняют колодцы, озера, реки, болота; растворяют различные вещества в породах и переносят их; вызывают оползни, заболачивание. Они обеспечивают растения влагой и население питьевой водой. Источники дают наиболее чистую воду. Водяной пар и горячая вода гейзеров служат для отопления зданий, теплиц и энергетических установок. Запасы подземных вод очень велики — 1,7%, но возобновляются крайне медленно, и это необходимо учитывать при их расходовании[15].
1.2.3.1. Классификация подземных вод
В основу классификации подземных вод могут быть положены различные признаки: способ образования, условия залегания, гидравлические свойства, литологический состав водоносных пород, их возраст, физические свойства подземных вод, их химический состав.
По условиям образования подземные воды так же можно разделить на различные группы, из которых важнейшее значение имеют воды инфильтрационные и частично конденсационные.
По условиям залегания и характеру вмещающих горных пород подземные воды делятся на следующие типы: поровые, пластовые, трещинные, карстовые, трещинно-жильные.
По гидравлическим свойствам подразделяются на без напорные, или воды со свободной поверхностью. Есть так же напорные подземные воды, когда водоносный горизонт перекрыт сверху водоупорной породой и находящаяся в нем подземная вода испытывает гидростатическое давление, обусловливающее напор.
В зависимости от возраста водовмещающих пород подземным водам присваивают характерные им названия: воды каменноугольных отложений, юрских, меловых, третичных и т. п.
По степени минерализации, или по содержанию растворенных солей бывают пресные (содержание солей около 1 г/л), солоноватые (1 - 10 г/л), солёные (10 - 50 г/л), рассолы (более 50 г/л растворенных солей).
По температуре подземные воды подразделяются на: холодные с температурой ниже 20°С, теплые (20-37°С), горячие (37-42°С), очень горячие (термы) с температурой свыше 42°С.
В практике существенное значение при характеристике и оценке подземных вод имеет не только общее содержание растворенных солей, но и состав этих солей. В зависимости от преобладания растворенных в воде солей различают воды гидрокарбонатные, сульфатные и хлоридные, а по катионам — кальциевые, магниевые и натриевые.
В зависимости от практической значимости растворенного в воде газа различают углекислые, сероводородные, радоновые и т.д. В большинстве случаев эти воды имеют лечебное значение. Подземные воды, имеющие лечебные свойства, называются минеральными [16].
Минеральные воды выходят на поверхность в виде источников или выводятся на поверхность искусственно с помощью буровых скважин.
По химическому составу, газоносности и температуре минеральные воды делят на углекислые, сероводородные, радиоактивные и термальные. Углекислые воды в основном расположены на землях Кавказа, Памира, в Забайкалье, на Камчатке. Содержание углекислого газа в углекислых водах колеблется от 500 до 3500 мг/л и более. Газ присутствует в воде в растворенном виде.
Сероводородные воды также распространены довольно широко и связаны в основном с осадочными породами. Общее содержание сероводорода в воде обычно невелико, однако лечебное действие сероводородных вод настолько значительно, что содержание Н2 более 10 мг/л уже придает им лечебные свойства. В отдельных случаях содержание сероводорода достигает 140-150 мг/л (например, известные источники Мацесты на Кавказе).
Радиоактивные воды можно разделить на радоновые, содержащие радон, и радиевые, содержащие соли радия. Лечебное действие радиоактивных вод очень высоко при лечении различных систем организма и конкретных заболеваний.
Подземные воды, содержащие в растворенном виде какое-либо вещество в концентрациях, при которых возможно извлечение этого вещества, называются промышленными: иодные, бром-иодные, бромные.
1.3. Проблема загрязнения биосферы
Существование биосферы и человека всегда было основано на использовании воды. Воздействие человека на биосферу с каждым годом только возрастает, меняя естественные защитные свойства природы. Таким образом, природа становиться уязвимой к любым антропогенным воздействиям на нее. Возрастает количество катаклизмом на земле, растёт число природных катастроф, изменяются физико-географические территории
Потребность человека к водным ресурсам только увеличивается, таким образом, оказывая на гидросферу огромное многообразное давление. Очевидно, необходимы новые подходы, «осознание реальностей и тенденций, появившихся в мире в отношении природы в целом и ее составляющих» (Лосев, 1989). В полной мере это относится к осознанию того, каким является в наше время загрязнение и истощение поверхностных и подземных вод. Человечество должно задуматься, что его ждет в будущем.
1.3.1. Загрязнение гидросферы
Загрязнение гидросферы происходит путем поступления в водоемы различных вредных веществ, инородных тел, происходит снижение биосферных функций и экологического значения.
Загрязнение воды проявляется при изменении физических и органолептических свойств (нарушается прозрачность, окраска, запах, вкус и цвет), возрастает содержание сульфатов, хлоридов, нитратов, токсичных тяжелых металлов, снижается количество растворенного в воде кислорода воздуха, появляются радиоактивные элементы, болезнетворные бактерии и всевозможные иные загрязнители.
Для нашей страны высокий количественный показатель воды на каждого жителя (примерно 30 тысяч м3 воды на каждого жителя). Однако около 70% пресных водоемов загрязнены или засорены и как следствие утратили свои первоначальные качества и свойства. В результате половина россиян потребляют загрязненную недоброкачественную воду.
Нарушилось равновесие в водной среде самого глубокого озера России – на Байкале. Байкал обладал чистейшей водой, и мог бы обеспечить пресной водой все человечество на протяжении пятидесяти лет. Около 100 км3 вод Байкала загрязнено в течение последних 15 лет. Каждый год на акватории озера наблюдается поступление более 8500 тон нефтепродуктов, 750 тон нитратов, 13 тысяч тон хлоридов и других загрязнителей. Ученые полагают, что только размеры озера и огромный водный объем, а также благодаря уникальной способности биоты участвовать в процессах самоочищения спасают экосистему Байкала от полной деградации [17].
1.3.1.1. Основные виды загрязнения вод
Гидросфера, в частности поверхностные воды загрязняются огромными масштабами. Загрязнение водных систем представляет большую опасность, чем загрязнение атмосферы, т.к. процессы регенерации (самоочищения) протекают в водной среде медленнее, чем в воздухе. Периодичность полного обмена массы воды, которая близка к периоду естественной очистки, составляет: Мировой океан -2500 лет, подземные воды - 1400 лет, воды озер - 17 лет, воды рек - 16 дней, в живых организмах - несколько часов. В атмосфере периодичность естественной очистки воздуха составляет 8-10 дней.
Наиболее часто встречается химическое и бактериальное загрязнение. Значительно реже наблюдается радиоактивное, механическое и тепловое загрязнение.
Химическое загрязнение — наиболее распространенное, стойкое и далеко распространяющееся. Одним из загрязнителей может быть органические вещества (к примеру - это фенолы, нафтеновые кислоты, пестициды и др.) и неорганические (соли, кислоты, щелочи). К наиболее токсичным веществам относят мышьяк, соединения ртути, свинца, кадмия и др. Выделяют так же малотоксичные и нетоксичные загрязняющие воду вещества. При осаждении на дно водоемов или при фильтрации в пласте вредные химические вещества сорбируются частицами пород. Эти загрязняющие вещества путем окисления и восстановления, выпадают в осадок. Однако это не приводит к полному самоочищению водных источников от загрязнения.
Как правило, водоемы загрязняются путем попадания в них нитратов через удобрения, фосфатов через синтетические моющие средства. Синтетические моющие средства замедляют естественное самоочищение водоёмов, угнетают многие биохимические процессы в них. В результате чего погибают обитатели этого водоема, как правило, и те организмы, которые способствуют его самоочищению. Что касается пестицидов, фенолов и некоторых других веществ, они могут проникнуть в недра подземных вод и могут распространяться протяженностью до 10 км и более.
Физическое загрязнение (механическое) – связано с выбросами на поверхность источников воды различных материалов нерастворимых в воде. Например, глина побочный продукт при разработке карьеров и шахт, или различные механические примеси (песок, шлам, ил и др). Механические примеси могут в значительной степени ухудшить органолептические характеристики вод (вкус, цвет, прозрачность, запах).
Поверхностные воды также засоряют твердые отходы (мусор), остатки лесосплава, бытовые и промышленные отходы, которые ухудшают качество вод, отрицательно влияют на условия обитания рыб, воздействуют на экосистему в целом.
Также к физическому загрязнению относят и тепловое загрязнение. Подогретая вода от теплоэлектроцентрали и других предприятий поступает в поверхностные воды, повышая общую температуру воды в ней. Последствиями этого может быть изменение в газовом и химическом составе водоема. Это приводит к размножению анаэробных бактерий, росту количества гидробионтов и выделению ядовитых газов (сероводорода и метана). Одновременно происходит «цветение» воды, а также ускоренное развитие микрофлоры и микрофауны, что способствует развитию других видов загрязнения. С повышением температуры растворимость газа в воде уменьшается, это приводит к уменьшению кислорода в воде. Дыхание биоценозов ухудшается, нарушается равновесие в таких водоемах. Начинают бурно размножаться болезнетворные микроорганизмы и вирусы.
По существующим санитарным нормам температура водоема не должна повышаться более чем на 3 °С летом и 5 °С зимой, а тепловая нагрузка на водоем не должна превышать 12—17 кДж/м3.
Биологическое загрязнение – связано с выбросом в водоемы большого количества ряда органических веществ, способных к брожению, а так же появление в воде патогенных бактерий, вирусов (возможно около 700 видов), простейших организмов, грибов и т.д. Данное загрязнение носит временный характер. Возможно несколько вариантов его происхождения: сточные воды городских и промышленных отходов, которые могут содержать пищевые продукты и фекалии, сточные воды промышленных заводов (сахарный, целлюлозно-бумажных) и др. Большие массы биогенных веществ дают животноводческие комплексы. Чрезмерное обогащение биогенами водоёмов приводит к их эвтрофикации, т.е. резкому повышению биопродуктивности. Это может привести к таким последствиям как - массовое размножение фитопланктона, а именно к повышению числа неприхотливых сине-зеленых водорослей. Далее происходит «цветение» воды и постепенное отмирание массы водорослей. Таким образом, источники воды загрязняются повторно. Далее водоём медленно «умирает» из-за нехватки кислорода. Таким образом, антропогенная эвтрофикация вызывается не ядовитыми загрязнениями, а тем, что всегда считалось безвредным, - частицами почвы и удобрениями. Выгребные ямы, использование органических и неорганических пестицидов и ядохимикатов на приусадебных участках может вызвать значительное локальное загрязнение подземных вод. Это приводит к серьезному нарушению экосистемы и ее равновесия [18].
Биологическое загрязнение приводит к сильному бактериологическому заражению воды.
Весьма опасно содержание в воде, даже при очень малых концентрациях, радиоактивных веществ, вызывающих радиоактивное загрязнение. Наиболее вредны «долгоживущие» радиоактивные элементы, обладающие повышенной способностью к передвижению в воде (стронций-90, уран, радий-226, цезий и др.). Поверхностные воды загрязняются при сбрасывании в них отходов с радиоактивными элементами, или при попадании элементов после разрушения защитных сооружений с захороненными отходами на дне. Радиоактивные элементы, такие как уран и стронций могут выпасть на поверхность земли в виде радиоактивных продуктов и отходов и последующего вымывания вглубь земли вместе с атмосферными осадками, так и в результате взаимодействия подземных вод с радиоактивными горными породами [19].
1.3.1.2. Основные источники загрязнения поверхностных и подземных вод
Родниковая вода издавна пользуется популярностью населением для питьевых целей благодаря своим уникальным свойствам: прекрасной способности утолять жажду, лечебным и профилактическим свойствам. Кроме того эти воды обладают свежестью, высокой прозрачностью, приятному вкусу, отсутствию запаха. Все это обусловлено условиями их образования и природным химическим составом, определяемым наличием растворенных минеральных и органических веществ.
К сожалению, изначальные свойства родников на территории населенных мест и даже за их территориями испытывают высокие техногенные нагрузки. Это приводит к ухудшению качества воды и, как следствие, негативному влиянию на организм человека.
К процессам загрязнения поверхностных вод относят некоторые факторы такие как:
1) выбросы в водоемы неочищенных сточных вод;
2) вымывание пестицидов, ядохимикатов ливневыми осадками;
3) газодымовые выбросы;
4) загрязнение нефтью и нефтепродуктами.
Наибольший вред водоемам, водотокам и экосистемам в целом причиняет выпуск в них неочищенных сточных вод – промышленных, коммунально-бытовых, коллекторно-дренажных и др.
Промышленные сточные воды могут иметь различный компонентный состав (табл. 1.2) в зависимости от специфики отраслей промышленности. Следует заметить, что в настоящее время объем выброса промышленных сточных вод во многие водные экосистемы только возрастет. К примеру, в озеро Байкал ежегодно сбрасывается огромный объем сточных вод из ЦБК (целлюлозно-бумажного комбината). Безопасным решением, для которого было бы переход на замкнутый цикл водопотребления.
Таблица 1.2.
Отрасль и вид загрязняющих компонентов
|
Отрасль промышленности |
Преобладающий вид загрязняющих компонентов |
|
Нефтегазодобыча, нефтепереработка |
Нефтепродукты, СПАВ, фенолы, аммонийные соли, сульфиды |
|
Целлюлозно-бумажный комплекс, лесная промышленность |
Сульфаты, органические вещества, лигнины, смолистые и жирные вещества, азот |
|
Машиностроение, металлообработка, металлургия |
Тяжелые металлы, фенолы, взвешенные в-ва, фториды, цианиды, аммонийный азот, нефтепродукты, смолы |
|
Химическая промышленность |
Фенолы, нефтепродукты, СПАВ, ароматические углеводороды, неорганика |
|
Горнодобывающая , угольная |
Флотореагенты, неорганика, фенолы, взвешенные вещества |
|
Легкая, текстильная, пищевая |
СПАВ, нефтепродукты, органическиекрасители, др. органические в-ва |
Коммунально-бытовые сточные воды в больших количествах поступают из жилых и общественных зданий, прачечных, столовых, больниц, и т. д. В сточных водах этого типа преобладают различные органические вещества, а также микроорганизмы, что способствует бактериологическому загрязнению.
Большие объемы пресных вод загрязняют вымываемые осадками элементы пестицидов (аммонийный и нитратный азот, фосфор, калий и др.), органические отходы животноводства. Эти компоненты наиболее опасные так как попадают в водоемы без какой-либо очистки, а потому имеют высокую концентрацию органического вещества, биогенных элементов и других загрязнителей.
Значительную опасность представляют газодымовые соединения (аэрозоли, пыль и т. д.), оседающие из атмосферы на поверхность водосборных бассейнов и непосредственно на водные поверхности.
Важный природный фактор, определяющий защитные свойства гидросферы, является характер взаимодействий в системе: вода-порода-газ-живое вещество. Поэтому под устойчивостью подземных вод к загрязнению понимается физико-химическая и биогеохимическая активность пород зоны аэрации и водовмещающих комплексов, способствующих самоочищению вод, нейтрализации загрязнителей, проявлению эффекта геохимического барьера.
Изучение устойчивости любого компонента окружающей среды, в том числе подземных вод, в конечном счёте, направлено на принятие оптимальных решений по защите гидросферы и экологическому нормированию.
В настоящее время не существует унифицированной методики оценки устойчивости (защищенности), опасности и риска загрязнения подземных вод. Главным свойством остается способность водоемов самоочищаться.
Огромны масштабы нефтяного загрязнения природных вод. Миллионы тонн нефти ежегодно загрязняют морские и пресноводные экосистемы при авариях нефтеналивных судов, на нефтепромыслах в прибрежных зонах, при сбросе с судов балластных вод и т. д. [20].
Кроме поверхностных вод постоянно загрязняются и подземные воды, в первую очередь в районах крупных промышленных центров. Источники загрязнения подземных вод весьма разнообразны.
Загрязняющие вещества могут проникать к подземным водам различными путями: при просачивании промышленных и хозяйственно-бытовых стоков из хранилищ, прудов-накопителей, отстойников и др., по затрубному пространству неисправных скважин, через поглощающие скважины, карстовые воронки и т. д.
К естественным источникам загрязнения относят сильно минерализованные (соленые и рассолы) подземные воды или морские воды, которые могут внедряться в пресные незагрязненные воды при эксплуатации водозаборных сооружений и откачке воды из скважин.
Важно подчеркнуть, что загрязнения подземных вод не ограничиваются площадью промпредприятии, хранилищ отходов и т. д., а распространяются вниз по течению потока на расстояния до 20—30 км и более от источника загрязнения. Это создает реальную угрозу для питьевого водоснабжения в этих районах.
Следует также иметь в виду, что загрязнение подземных вод негативно сказывается и на экологическом состоянии поверхностных вод, атмосферы, почв, других компонентов природной среды. Например, загрязняющие вещества, находящиеся в подземных водах, могут выноситься фильтрационным потоком в поверхностные водоемы и загрязнять их. Как подчеркивают многие ученые, круговорот загрязняющих веществ в системе поверхностных и подземных вод предопределяет единство природоохранных и водоохранных мер и их нельзя разрывать, в противном случае меры по охране подземных вод вне связи с мерами по защите других компонентов природной среды будут неэффективными.
Контроль над качеством воды родников позволяет своевременно устанавливать факт его изменения, выявлять и своевременно устранять причины ухудшения свойств воды, исключать неблагоприятное воздействие на здоровье человека. В приоритетный список химических веществ для контроля их содержания в воде, используемой для питьевых целей, включены:
а) солевой состав – минерализация, общая жесткость, хлориды, сульфаты, щелочность (дополнительно кальций, магний, натрий, калий);
б) микроэлементы – фтор, бор, нитриты, нитраты, медь, селен, стронций (дополнительно алюминий, бериллий);
в) тяжелые металлы – ртуть, свинец, кадмий, мышьяк, железо, хром, ванадий, цинк, уран (дополнительно барий, никель, марганец);
г) органические вещества – ПАВ, нефтепродукты, бензапирен, фенол, сумма хлорорганических, нитро-, фосфорорганических соединений, ХПК, БПК, растворенный кислород, суммарные углеводороды.
1.4. Гигиенические требования и нормативы качества питьевой воды
Гигиенические требования к качеству питьевой воды централизованных систем водоснабжения определяются санитарными правилами и нормами СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников». В этом документе показатели качества воды подразделяются на:
• органолептические;
• химические;
• микробиологические.
Качество воды в источниках нецентрализованного водоснабжения по показателям радиационной безопасности оценивается в соответствии сСанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
1.4.1. Органолептические показатели
К числу органолептических показателей воды относятся:
- запах;
- привкус (вкус);
- цветность;
- мутность.
Запах и привкус обусловлен присутствием растворенных в воде газов, органических веществ, минеральных солей, жизнедеятельностью организмов.
Запах воды может иметь природное (сероводородный, гнилостный, болотный, землистый, и др.) и искусственное (ароматический, нефтяной, хлорный, фенольный, хлорфенольный, и др.) происхождение.
Привкус воды может быть кисловатым, горьковатым, сладковатым, солоноватым, и т.д.
Для количественной оценки запаха и привкуса используют 5-балльную шкалу:
1 балл - очень слабый;
2 балла - слабый;
3 балла — заметный;
4 балла — отчетливый;
5 баллов - очень сильный.
Цветность, т.е. окраска воды в тот или иной цвет, в основном свойственна водам поверхностных источников. Она может быть вызвана природными веществами (железо в коллоидной форме, сложные высокомолекулярные соединения почвенного происхождения, некоторые ионы) и веществами, поступающими в водные объекты со сточными водами. Цветность измеряется в градусах стандартной платинокобальтовой шкалы путем сравнения исследуемой пробы с водой эталонной цветности. Цветность питьевой воды не должна превышать 20°. В исключительных случаях (по согласованию с органами санитарного надзора) этот показатель может достигать 35°.
Мутность (прозрачность) воды зависит от наличия в ней взешанных частиц и определяется непосредственно - весовым методом или косвенно - по шрифту или кресту [21].
Весовым методом мутность определяют, взвешивая на лабораторных весах отфильтрованную часть механических примесей. Мутность питьевой воды не должна превышать 1,5 мг/л. Использование мутной воды для питьевого водоснабжения нежелательно, а чаще просто недопустимо.
При косвенном методе оценкой мутности является высота столба воды в цилиндре, через который можно отчётливо рассмотреть специальный шрифт или грани креста. Эта высота должна составлять не менее 30 см при определении мутности по шрифту и не менее 300 см - при определении по кресту.
Благоприятные органолептические свойства воды определяются её соответствием нормативам, представленным в приложении 1.
1.4.2. Химические показатели
К обобщённым химическим показателям воды относятся:
• водородный показатель рН;
• общая минерализация (сухой остаток);
• щёлочность;
• жёсткость;
• окисляемость.
Также химическим показателям относятся концентрация растворённых органических и неорганических веществ - нефтепродуктов, поверхностно-активных веществ и др. [22].
1.4.2.1. Водородный показатель воды
Водородный показатель рН - это показатель концентрации водородных ионов, численно равный отрицательному логарифму концентрации водородных ионов:
pH=-lg(Н+).
Активная реакция воды в зависимости от концентрации водородных ионов может быть кислой, нейтральной или щелочной.
Для питьевой воды величина рН должна составлять от 6 до 9. Измеряют активную реакцию воды специальными приборами - рН-метрами, иногда с помощью индикаторов. Цвета важнейших индикаторов при различных значениях рН приведены в таблице 1.3.
Таблица 1.3.
Важнейшие индикаторы
|
Наименование индикатора
|
Цвет индикатора в различных средах |
||
|
Кислая |
Нейтральная (рН=7) |
Щелочная |
|
|
Метиловый оранжевый |
Красный (рН<3,1) |
Оранжевый |
Желтый (рН>4,4) |
|
Метиловый красный |
Красный (рН<4,2) |
Оранжевый |
Желтый (рН>6,3) |
|
Фенолфталеин |
Бесцветный (рН<8,0) |
Бледно-малиновый |
Малиновый (рН>9,8) |
1.4.2.2. Общая минерализация
Общая минерализация - это суммарная концентрация анионов, катионов и недиссоциированных, растворенных в воде органических веществ, которая выражается в граммах на кубический дециметр или литр (г/дм3, г/л). Общая минерализация воды совпадает с сухим остатком, который получают путем выпаривания определённого объёма воды, предварительно профильтрованного через бумажный фильтр, и последующего высушивания остатка до постоянного веса при температуре 105-120 °С. Сухой остаток можно рассчитать и путём суммирования значений концентраций анионов и катионов, определённых методами химического анализа. Минерализация питьевой воды не должна превышать 1 г/л.
1.4.2.3. Жёсткость воды
Жёсткость воды обусловлена наличием в ней катионов кальция и магния. Эти катионы образуют малорастворимые соли с обычно присутствующими в воде карбонатными и гидроксильными ионами.
Имеющиеся в природных водах бикарбонатные ионы при нагревании разлагаются на углекислый газ и карбонатный ион:
2Н2СО3 → СО2 + СО32- + Н2О.
Жёсткость воды определяют путём титрования пробы воды реактивом «трилон-Б» в присутствии индикатора мурексида или хрома темного синего при значении рН пробы около 9. По количеству трилона-Б, необходимого для изменения окраски индикатора, судят о жёсткости воды. Концентрацию катионов жёсткости в воде определяют в миллиграмм-эквивалентах на литр (мг-экв/л) или в миллимолях на литр (ммоль/л). Жёсткость воды для питьевых целей ограничена концентрацией 7 ммоль/л.
1.4.2.4. Окисляемость воды
Окисляемость воды обусловлена наличием в ней органических веществ, а также рада легко окисляющихся неорганических примесей, таких как двухвалентное железо, сероводород, сульфиты и т.д.
Окисляемость воды, или химическое потребление кислорода (ХПК), определяют количеством кислорода, израсходованного путем химического окисления содержащихся в воде органических и неорганических веществ под действием различных окислителей. Существует несколько методов определения окисляемости воды: перманганатный, бихроматный, йодатный и т.д. Для анализа питьевой воды чаще используется метод перманганатного окисления. Перманганатная окисляемость питьевой воды не должна превышать 5 мг/л [23].
В приложении 2 представлены обобщенные химические показатели воды и их нормативы (ПДК).
1.4.2.5. Органические и неорганические вещества
Общее число химических веществ, которые в результате производственной деятельности загрязняют природные воды и могут оказывать неблагоприятное воздействие на здоровье человека, постоянно растёт и в настоящее время превышает 50000. В связи с этим проведение тестов на определение концентрации всех химических веществ, которые могут присутствовать в воде невозможно.
В то же время систематизированы наиболее часто встречающиеся в природных водах и образующиеся при обработке воды химические вещества, которые могут нанести вред здоровью человека. В СанПиН 2.1.4.1175-02 представлены предельно допустимые концентрации этих химических веществ. При их появлении в источнике водоснабжения необходимо определять их концентрацию в природной или обработанной воде и в случае превышения ПДК проводить доочистку воды.
При обнаружении в питьевой воде химических веществ, относящихся к первому и второму классам опасности и нормируемых по санитарно - токсикологическому признаку вредности, сумма отношений обнаруженных концентраций каждого из них в воде к величине его ПДК не должна превышать 1. Расчет ведётся по формуле:
![]()
Где С1, С2, Сn - концентрации индивидуальных химических веществ 1 и 2 класса опасности: факт, (фактическая) и доп. (допустимая).
1.4.3. Микробиологические показатели
Вода является идеальной средой для развития многочисленных форм бактерий, простейших и высших организмов. Некоторые из развивающихся в воде микробов являются распространителями инфекций, к которым относят возбудителей брюшного тифа, паратифов, холеры, дизентерии и т.д. вода может быть переносчиком различного рода зародышей глистов (аскарид, карликового цепня и др.) и простейших (амеб, лямблий и др.).
В связи с разнообразием форм патогенных организмов, сложностью и длительностью их определения проводят анализ воды на наличие в ней «показательных» микробов, что указывает на возможность загрязнения воды патогенной микрофлорой.
Основная часть патогенных микроорганизмов попадает в водные объекты с фекалиями человека и животных. Эти загрязнения, независимо от наличия в них патогенных микробов, всегда содержат непатогенный микроорганизм - кишечную палочку (EscherichiaColi), которая постоянно присутствует в кишечнике человека и теплокровных животных. Количество кишечных палочек в воде дает характеристику о степени ее загрязнения фекальными стоками. Эти данные используются для контроля за качеством очистки и обеззараживания воды на водоочистных станциях[24].
В приложении показаны нормы по микробиологическим показателям.
Исследования воды на наличие патогенных микроорганизмов могут проводиться только в специальных лабораториях, которые имеют санитарно - эпидемиологическое заключение о соответствии условий выполнения работ санитарным правилам и лицензию на деятельность, связанную с использованием возбудителей инфекционных заболеваний.
1.4.4. Радиологические показатели
Источниками поступления радиоактивных веществ в водные объекты являются минеральные и геотермальные воды, которые формируются в непосредственной близости от природных залежей радиоактивных руд, радиоактивные материалы, жидкие и твёрдые радиоактивные отходы, нарушение условий их переработки и хранения, а также выбросы и аварии на радиационных объектах.
В водных объектах могут присутствовать изотопы трития 3Н, натрия 24Na, фосфора 32Р, кобальта 60Со, цезия 137Cs, хрома 51Сr и др. Эти радиоактивные элементы могут находиться как в форме катионов и анионов, так и в виде комплексных соединений. Радиационная безопасность питьевой воды определяется её соответствием нормативам по показателям общей альфа- и бета- активности, представленным в таблице № 3.
Таблица №3
Нормативы по показателям альфа- и бета- активности
|
Показатели |
Единицы измерения |
Нормативы |
|
Общая альфа-радиоактивность |
Бк/л |
0.1 |
|
Общая бета-радиоактивность |
Бк/л |
1,0 |
Измеряются радиометрические показатели дозиметрическими приборами.
1.5. Влияние качества питьевой воды на здоровье человека
В России проблема обеспечения населения доброкачественной питьевой водой остается нерешенной, а в ряде регионов приобрела кризисный характер. Из объёма подаваемой населению воды 68% занимают поверхностные водные источники, только 1% которых соответствует качеству, обеспечивающему при существующих технологиях, получение питьевой воды в соответствии с лимитами СанПиН 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды».
Качество используемых для водоснабжения подземных вод в основном удовлетворяет нормативным требованиям, однако их загрязнение также увеличивается. В результате около 90% поверхностных и 30% подземных вод, забираемых для нужд водоснабжения, подвергается обработке. Из-за повышенного техногенного загрязнения водоисточников нефтепродуктами, солями тяжелых металлов, пестицидами, нитратами, и другими вредными веществами, технологии, применяемые для подготовки питьевой воды, в большинстве случаев неэффективны. Что приводит, как правило, к потреблению населением воды не питьевого качества.
Одним из основных источников антропогенного воздействия на водные источники является сброс недостаточно очищенных или просто неочищенных сточных вод от жилищно-коммунального комплекса. В дополнение к техногенным нагрузкам на поверхностные источники питьевого водоснабжения появляются антропогенные загрязнения от коммунальных служб. Загрязнения, поступающие в организм с питьевой водой, провоцируют возникновение многих заболеваний (см. приложение 5).
Во всех субъектах РФ отмечены случаи нарушения требований ГОСТа по физико-химическим и микробиологическим показателям.
Учитывая сложное положение с обеспечением населения РФ питьевой водой, Госстрой России совместно с заинтересованными министерствами и ведомствами разработал проект федерального закона «О питьевой воде», в котором предусматриваются требования к надежности источников водоснабжения, экономические рычаги управлением качества водоисточников, гарантии прав граждан на обеспечение питьевой водой хорошего качества и в нормальном количестве.
Для обеспечения качества воды в водных источниках и системах водопотребления используется ряд нормативных документов, из которых главными являются следующие:
- ГОСТ 2874-82 «Вода питьевая. Общие требования к организации и методам контроля качества».
- ГОСТ 2761-84 «Источники централизованного хозяйственно-питьевого водоснабжения. Гигиенические, технические требования и правила выбора».
- ГОСТ Р 22.6.01-95 «Безопасность в чрезвычайных ситуациях. Защита систем хозяйственно-питьевого водоснабжения. Общие требования».
- СанПиН 2.1.4.1074. «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
- СанПиН 2.1.4.1175-02. «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
- «Водный кодекс РФ» от 03.06.2006 № 74-Ф3.
1.6. Системы критериев качества пресной воды
Необходимо нормировать качество не только питьевой воды, но и сбрасывания сточной жидкости. С этой целью в проектной документации используется гигиеническая классификация водных объектов по степени загрязнения с использованием четырёх критериев вредности: органолептиче-ский, токсикологический, общесанитарный, и бактериологический (см. приложение 6). Четыре градации свидетельствуют о различных возможностях их эксплуатации в зависимости от индекса загрязнения:
- 0, без ограничений;
-1, умеренное загрязнение и частичное нарушение водоиспользования;
-2, характерен для водоёмов с чрезвычайно высокой степенью загрязнения, где даже кратковременный контакт с водой имеет неблагоприятные последствия для здоровья человека;
-4 по существу, эти воды соответствуют сточной жидкости. Водоем считается загрязненным в результате сброса сточных вод, если происходит изменение качества воды выше пункта водоиспользования на расстоянии 1 км которое не соответствует санитарным правилам и нормам СанПиН.
ГЛАВА II. Объекты и методики экспериментов
Объектом исследования является вода трёх родников села Бахтыбаево, села Новокульчубаево и деревни Гребени Бирскогого района, находящихся в 23, 26, 17 километрах от города Бирск РБ соответственно.
2.1. Общие требования к отбору проб
Отбор проб родниковых вод проводится в соответствии с общими требованиями отбора проб и соответственно ГOCTу P 51592-2000.
Место отбора проб, время и условия, при которых они были отобраны, указывают на этикетке и прикрепляют к ёмкости для отбора проб.
2.2. Определение органолептических показателей
Определение органолептических показателей проводилось в соответствии с ГOCT 3351-74 «Вода питьевая. Методы определения вкуса, запаха, цветности и мутности»
2.2.1. Определение температуры воды
Температурные показатели воды определяется сразу после отбора пробы путем погружения термометра в емкость с водой на 3 – 5 минут сразу после ее наливания или непосредственно под струей с ценой деления 0,1ºС. Для питьевой воды государственным стандартом определяется температура, предел которой 7-12 градусов.
2.2.2. Определение мутности воды
Мутность воды определяется фотометрическим путём сравнением проб исследуемой воды с дистиллированной водой.
Для проведения исследования применяется спектрофотометр СФ 108 с зелёным светофильтром (λ=530 нм), кюветы с толщиной поглощающего слоя 50 или 100 мм. Содержание мутности измеряется в мл/дм3 и находится по градуировочному графику или рассчитываем по формуле:
С = D/ 0.02 · 0,58
где С – мутность воды; D – оптическая плотность, найденная по спектрофотометру.
Мутность в родниках может обуславливаться присутствием в воде нерастворимых и коллоидных веществ неорганического (глина, гидрооксид железа) и органического (ил, микроорганизмы, нефтепродукты) происхождения. Выражают мутность в мг/л. По ГOCTу мутность питьевой воды должна быть не выше 1,5 мг/л.
2.2.3. Определение цветности
Цветность - обуславливается содержанием в воде окрашенных соединений органического происхождения, присутствием гуминовых веществ, содержанием трехвалентного железа, вымыванием из почвы и грунта разных веществ, поступлением загрязненных истоков вод. Гуминовые вещества образуются после разложения остатков растений. Эти вещества придают воде желтоватый или коричневатый цвет в зависимости от их концентрации.
Степень цветности выражается в градусах платинo - кобальтовой шкалы. Окрашенная вода говорит о плохих органолептических показателях воды. Повышенная цветность отрицательно влияет на развитие водной растительности и животных организмов, ухудшает условия окисления растворенного в воде железа.
Цветность воды определяется фотометрическим путём сравнением проб испытуемой жидкости с дистиллированной водой. Испытания были проведены на спектрофотометре CФ 108 с синим светофильтром (λ=413 нм) и кюветы с толщиной поглощающего свет слоя 5-10 см. Результат вычисляется по формуле:
С = D / 0,008;
где С – цветность пробы воды; D – оптическая плотность, найденная по спектрофотометру.
По CанПиH цветность питьевой воды не должна превышать 20º. Цветность выражается в градусах, используется таблица 2.1. “Определение цветности”.
Таблица 2.1
Определение цветности
|
Окраска сбоку |
Окраска сверху |
Цветность в градусах |
|
Нет |
Нет |
0 |
|
Нет |
еле заметное с бледно-желтым оттенком |
10 |
|
Нет |
очень слабый желтый оттенок |
20 |
|
едва уловимое бледно-желтоватый |
Желтоватый |
40 |
|
более заметное бледно-желтоватый |
слабо желтый |
50 |
|
очень бледно-желтый |
Желтый |
100 |
|
бледно-зеленоватый |
интенсивно-желтый |
150 |
2.2.4. Определение запаха воды
Запах природной воды вызывают летучие пахнущие вещества, попадающие в воду естественным путем или со сточными водами. В родниках, содержащих только неорганические вещества, может быть запах сероводорода. Интенсивность запаха оценивается в баллах по пятибалльной шкале, определяемой при температуре воды в 20оС. По ГОСТу питьевая вода может иметь запах до 2 баллов.
Распространенный источник запаха в исследуемых родниках - сероводород. Источник сероводорода в природных водах - восстановительные процессы, протекающие при бактериальном разложении и биохимическом окислении органических веществ. Сероводород находится в водах родников в двух видах: в виде молекулы Н2S и в виде иона гидросульфата НS. Наличие в воде сероводорода служит показателем ее сильного загрязнения и анаэробных условий. Вода с его присутствием непригодна для питья и всевозможных технических и хозяйственных целей.
Для определения запаха необходимо:
1. Колбу с притертой пробкой вместимостью 250 – 350 см3 заполнить на 1/3 объема испытуемой водой и закрыть пробкой.
2. Содержимое колбы несколько раз перемешать вращательными движениями.
3. Затем открыть колбу и осторожно, неглубоко вдыхая воздух, сразу же определить характер и интенсивность запаха.
4. Если запах сразу не ощущается или запах неотчётливый, то нагреть воду в колбе до температуры 60°С (подержав колбу в горячей воде). Интенсивность запаха воды оценивают по пятибалльной шкале согласно требованиям (Приложение 4).
Запах воды водоёмов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде или после ее хлорирования.
2.2.5. Определение вкуса и привкуса
Вкус и привкус определяется в сырой воде при комнатной температуре и 60ºС. На вкус можно проверять воду только прозрачную, бесцветную и без запаха. При исследовании набрать в рот малыми порциями испытуемой воды, не проглатывая задержать во рту 3 – 5 секунд и определить характер и интенсивность привкуса по пятибалльной системе согласно требованиям (Приложение 5). Для питьевой воды допускаются значения показателей вкуса и привкуса не более 2 баллов.
2.3. Определение физико-химических показателей проб воды
2.3.1. Измерение водородного показателя и общей жёсткости
Водородный показатель (pH) воды определяется с помощью pH-метра. Общая жёсткость воды была определена методом комплексонометрического титрования. В качестве индикатора используется реактив – эриохром черный Т, титрование проводится раствором трилона Б.
Величину общей жесткости в анализируемой пробе воды находят по формуле:
Х = (Стр × Vтр × 1000) / V,
где Х- общая жёсткость воды, моль/дм3 эквивалента; Стр – концентрация раствора трилона Б, моль/ дм3 эквивалента; Vтр – объём раствора трилона Б, затраченного на титрование пробы, см3; V – объём пробы воды, взятой для определения, см3.
Жёсткость воды не должна превышать 7,0 ммоль/л [25].
2.3.2. Измерение массовых концентраций тяжёлых металлов
Определение массовых концентраций тяжёлых металлов проводилось атомно-абсорбционным методом на спектрометре КВАНТ - Z.ЭТА [26].
2.3.3. Определение радиационного загрязнения
Определение радиационного загрязнения пробы воды было проведено на радиометре РРА01Но1.
ГЛАВА III. Результаты и их обсуждение
Мониторинг родников села Бахтыбаево, села Новокульчубаево и деревни Гребени Бирского района проводился по временам года с февраля по январь 2016-2017 гг.
24 февраля 2016 года был произведен первый пробоотбор воды источников, второй пробоотбор был произведен 25 марта 2016 года, третий и последующие пробоотборы проводились в середине каждого текущего месяца.
В соответствии с СанПин 2.1.4.1075 021. проанализированы органолептические, физико-химические показатели качества воды данных источников. [Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников. СанП]
Отбор проб проводился в соответствии с требованиями ГОСТ Р 51592 2000 «Вода. Общие требования к отбору проб» 2. [ГОСТ Р 51592 2000 «Вода. Общие требования к отбору проб».– М.: Госстандарт России, 2000.]
Используемые методики измерения допущены для целей государственного экологического контроля.
3.1. Органолептические показатели проб воды
Исследования, осуществлялись 12 раз: в феврале, в марте, в апреле, в мае, в июне, в июле, в августе, в сентябре, в октябре, в ноябре, в декабре 2016 года и в январе 2017 г.
Цветность воды была вычислена по формуле:
С = D / 0,008;
где С – цветность пробы воды; D - оптическая плотность, найденная по спектрофотометру.
Интенсивность мутности была рассчитана по формуле:
С =D / 0,02×0,58;
где С – мутность воды; D – оптическая плотность, найденная по спектрофотометру.
Температура воды - это наиболее устойчивый показатель воды родников, он в целом колеблется от + 3.0 до +10,0 С. Наиболее низкая температура воды отмечена (+ 3,0 ) в роднике села Новокульчубаево и роднике деревни Гребени (+4), наиболее высокая (+ 10) в роднике села Бахтыбаево.
Более низкие температуры воды отмечены в мощных родниках с большим дебитом, при этом она почти не меняется по сезонам года.
Температура воды в некоторой степени определяет вкусовые качества: чем она ниже, тем вода кажется «вкуснее», поэтому родники с низкой температурой воды пользуются большой популярностью у населения.
Таблица 3.1
Результаты органолептических исследований родника села Бахтыбаево
|
Показатели |
Результаты исследования |
Норматив СанПин 2.1.4.1175 – 02 |
|||
|
Декабрь 2016 г. |
Март 2016 г. |
июнь 2016 г. |
Сентябрь 2016 г. |
||
|
Температура |
+5 |
+7 |
+10 |
+6 |
- |
|
Запах |
0 |
1 |
1 |
0 |
2 балла |
|
Вкус и привкус |
0 |
0 |
0 |
0 |
2 балла |
|
Цветность |
Бесцветна |
Бесцветна |
Бесцветна |
Бесцветна |
20ºС |
|
Мутность |
Не заметна |
Слабо опалесцирующая |
Слабо опалесцирующая |
Не заметна |
2,5 мл/дм3 |
Таблица 3.2
Результаты органолептических исследований родника села Новокульчубаево
|
Показатели |
Результаты исследования |
Норматив СанПин 2.1.4.1175 – 02 |
|||
|
Декабрь 2016 г. |
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
||
|
Температура |
+3 |
+3 |
+4 |
+3 |
- |
|
Запах |
0 |
0 |
0 |
0 |
2 балла |
|
Вкус и привкус |
0 |
0 |
0 |
0 |
2 балла |
|
Цветность |
Бесцветна |
Бесцветна |
Бесцветна |
Бесцветна |
20ºС |
|
Мутность |
Не заметна |
Не заметна |
Не заметна |
Не заметна |
2,5 мл/дм3 |
Таблица 3.3
Результаты органолептических исследований родника деревни Гребени
|
Показатели |
Результаты исследования |
Норматив СанПин 2.1.4.1175 – 02 |
|||
|
Декабрь 2016 г. |
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
||
|
Температура |
+4 |
+5 |
+5 |
+4 |
- |
|
Запах |
0 |
0 |
0 |
0 |
2 балла |
|
Вкус и привкус |
0 |
0 |
1 |
0 |
2 балла |
|
Цветность |
Бесцветна |
Бесцветна |
Бесцветна |
Бесцветна |
20ºС |
|
Мутность |
Не заметна |
Не заметна |
Не заметна |
Не заметна |
2,5 мл/дм3 |
Анализ лабораторных исследований свидетельствует, что качество воды в родниках по органолептическим показателям стабильны и соответствует санитарным правилам и нормам для воды нецентрализованного водоснабжения. Из данных следует, что вода данных источников благополучна по температуре и органолептическим показателям. Хорошие органолептические характеристики воды свидетельствуют об отсутствии гнилостных процессов, «зацветании» и затухании воды.
3.2. Физико-химические показатели проб воды
3.2.1. Результаты анализов проб воды на водородный показатель
Результаты измерений водородного показателя приведены в таблицах 3.4 – 3.6 .
Таблица 3.4
Результаты измерений водородного показателя (pH)
родника села Бахтыбаево (№1)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
pH |
8,7 |
9,0 |
8,7 |
6,9 |
6-9 |
Таблица 3.5
Результаты измерений водородного показателя (pH) родника села Новокульчубаево (№2)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
pH |
8,17 |
8,26 |
8,2 |
7,6 |
6-9 |
Таблица 3.6
Результаты измерений водородного показателя (pH)
родника деревни Гребени (№3)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
pH |
8,2 |
8,25 |
7,75 |
8,5 |
6-9 |
Исходя, из полученных результатов анализа, можно сделать вывод, что вода родников №1, №2, №3 соответствует нормативам ПДК (по СанПиН 2.1.4.1175-02) и являются слабощелочными.
3.2.4. Результаты анализов проб воды на показатель общей жёсткости
Анализы на показатель общей жесткости проводились 12 раз титриметрическим методом. Результаты представлены в таблицах 3.7 – 3.9.
Таблица 3.7
Результаты исследований на показатель общей жёсткости (мг-экв/дм3) родника №1 (села Бахтыбаево)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
Общая жёсткость |
4,7 |
4,3 |
4,2 |
4,7 |
7 – 10 |
|
Средняя жёсткость |
4,475 |
7 – 10 |
|||
Таблица 3.8
Результаты исследований на показатель общей жёсткости (мг-экв/дм3) родника №2 (с. Новокульчубаево)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
Общая жёсткость |
4,9 |
4,7 |
4,25 |
5,2 |
7 – 10 |
|
Средняя жёсткость |
4,76 |
7 – 10 |
|||
Таблица 3.9
Результаты исследований на показатель общей жёсткости (мг-экв/дм3) родника №3 (д. Гребени)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
Общая жёсткость |
5,3 |
4,7 |
4,5 |
5,4 |
7 – 10 |
|
Средняя жёсткость |
4,975 |
7 – 10 |
|||
Исходя из полученных данных, можно сделать вывод, что общая жесткость воды исследуемых родников находится в пределах нормы. Показатели общей жесткости, согласно классификации 3, позволяют отнести воду исследуемых родников к водам средней жесткости. [Молчанова Я. П. и др. Гидрохимические показатели состояния окружающей среды: справочные материалы.– М.: Форум: ИНФРАМ, 2011.– 192 с.]
3.2.3. Общая минерализация
Показатель количества содержащихся в воде растворённых веществ (неорганические соли, органические вещества), который также называют показателем содержания твёрдых веществ или общим солесодержанием. Растворённые газы при вычислении общей минерализации не учитываются.
За рубежом минерализацию также называют «общим количеством растворённых частиц». Измерение минерализации проводились на pH-метре.
Таблица 3.10
Результаты данных общей минерализации (мкг/дм3) родника №1 (c.Бахтыбаево)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
Минерализация |
295 |
278 |
318 |
184 |
1000-1500 |
|
Средняя минерализация |
269 |
1000-1500 |
|||
Таблица 3.11 - Результаты данных общей минерализации (мкг/дм3)
родника №2 (с. Новокульчубаево)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
Минерализация |
250 |
289 |
345 |
176 |
1000-1500 |
|
Средняя минерализация |
265 |
1000-1500 |
|||
Таблица 3.12 - Результаты данных общей минерализации (мкг/дм3)
родника №3 (д. Гребени)
|
Показатели |
Результаты исследований |
Норматив по СанПин 2.1.4.1175-02 |
|||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||
|
Минерализация |
281 |
267 |
263 |
180 |
1000-1500 |
|
Средняя минерализация |
248 |
1000-1500 |
|||
Из полученных результатов можно сделать вывод, что вода данных источников является маломинерализованной.
3.2.4. Результаты измерений массовых концентраций металлов в воде
Массовые концентрации металлов в воде определяли атомно-абсорбционным методом на спектрометре КВАНТ - Z.ЭТА.
Результаты измерений массовых концентраций металлов представлены в таблицах 3.13 – 3.15.
Таблица 3.13
Результаты измерений массовых концентраций металлов в воде (мкг/дм3) родника №1 (с. Бахтыбаево)
|
Показатели |
Результаты исследования |
Нормативы ПДК |
|||||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||||
|
As |
0,0873 |
0,0134 |
0,1239 |
0,01191 |
50 |
||
|
Cd |
0,0212 |
0,0190 |
0,0208 |
0,0182 |
1 |
||
|
Cu |
5,685 |
17,672 |
10,785 |
10,649 |
1000 |
||
|
Fe |
25,391 |
14,642 |
10,785 |
48,039 |
300 |
||
|
Pb |
3,205 |
1,983 |
4,0022 |
1,039 |
30 |
||
Таблица 3.14
Результаты измерений массовых концентраций металлов в воде (мкг/дм3) родника №2 (с.Новокульчубаево)
|
Показатели |
Результаты исследования |
Нормативы ПДК |
|||||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||||
|
As |
0,0077 |
0,1053 |
0,0788 |
0,0038 |
50 |
||
|
Cd |
0,0367 |
0,0295 |
0,0182 |
0,0272 |
1 |
||
|
Cu |
13,476 |
15,943 |
10,715 |
8,744 |
1000 |
||
|
Fe |
26,679 |
44,687 |
41,516 |
32,845 |
300 |
||
|
Pb |
1,398 |
0,0436 |
4,2978 |
0,72908 |
30 |
||
Таблица 3.15
Результаты измерений массовых концентраций металлов в воде (мкг/дм3) родника №3 (д. Гребени)
|
Показатели |
Результаты исследования |
Нормативы ПДК |
|||||
|
Март 2016 г. |
Июнь 2016 г. |
Сентябрь 2016 г. |
Декабрь 2016 г. |
||||
|
As |
0,1412 |
0,0876 |
0,1476 |
0,0067 |
50 |
||
|
Cd |
0,0218 |
0,0467 |
0,0182 |
0,0205 |
1 |
||
|
Cu |
28,359 |
3,372 |
11,907 |
4,930 |
1000 |
||
|
Fe |
31,578 |
46,345 |
54,041 |
32,961 |
300 |
||
|
Pb |
2,9816 |
2,1034 |
3,1289 |
1,212 |
30 |
||
Исходя из полученных данных измерений массовых концентраций металлов в воде, можно сделать вывод, что вода родников № 1, №2, №3 находятся в пределах допустимой нормы.
Значения массовых концентраций металлов в пробах родников далеко не достигают предельно допустимых концентраций с преобладанием катионов железа.
3.2.5. Результаты радиологических исследований
Радиологические исследования, проводимые
на радиометре РРА01Но1 показали, что концентрация радона в исследуемых родниках
составляет
<20 Бк/л (ПДК для радона -222 в питьевой воде составляет <60Бк/л).
Среднее значение объемной активности радона в воде родника значительно ниже уровня вмешательства для радона в питьевой воде.
3.2.6. Расход (дебит) родников
Расходы родников, определяющие возможность питьевого водоснабжения и зачастую влияющие на бактериологическое состояние воды, в большинстве случаев составляют 0,1 -0,03 л/с.
Выводы
На основании лабораторного анализа воды родников №1, №2 и №3
д. Бахтыбаево, д. Новокульчубаево и с. Гребени Бирского района Республики Башкортостан мы установили качество воды родников. Для этого мы выделили две основные группы показателей, определяющих качество воды: показатели, характеризующие органолептические свойства воды; показатели, характеризующие физико-химический состав воды.
Исходя из результатов исследования, можно сделать следующие выводы:
1) изучена литература по теме курсовой работы;
2) органолептические характеристики пробы воды родника показали, что вода благополучна по температуре и органолептическим показателям. Качество исследуемой воды полностью соответствует нормативам СанПиН по питьевой воде.
3) физико-химические исследования показали:
- результаты измерений водородного показателя, полученные с помощью прибора pH-метра, свидетельствуют о том, что вода исследуемых родников является слабощелочной и соответствует нормативам ПДК;
- титриметрические исследования жёсткости показали, что вода трёх данных источников имеет среднюю жёсткость;
- исследования общего солесодержания, проводимые на TDSметре, свидетельствуют о том, что вода исследуемых родников является маломинерализованной;
- результаты измерений массовых концентраций металлов в воде родников находятся в пределах допустимой нормы;
- радиологические исследования показали, что концентрация радона в исследуемых родниках составляет <20Бк/л, что значительно ниже норматив.
Таким образом, результаты исследования показали, что вода данных источников соответствует санитарно-гигиеническим нормам для питьевой воды (СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды
нецентрализованного водоснабжения. Санитарная охрана источников»)
Поставленная нами цель полностью достигнута. Эколого-химическая паспортизация воды трёх источников д. Бахтыбаево, д. Новокульчубаево и с. Гребени Бирского района Республики Башкортостан проведена, и полученная информация может быть использована органами охраны природы Бирского района.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И ЛИТЕРАТУРЫ
1. Бокий Г.Б. Кристаллохимические соображения о поведении воды в мерзлых фунтах. – Вести. МГУ. Геология, 2009. -596 с.
2. Вода [Электронный ресурс] - Режим доступа – URL: http://www.habit.ru/18/85.htm (дата обращения 12.04.2016).
3. Исследование экологического состояния родников д. Кельмаксола [Электронный ресурс] - Режим доступа – URL: http://gigabaza.ru/doc/102610.html (дата обращения 11.04.2016).
4. Протасов В.Ф. Экология, здоровье и охрана окружающей среды в России. Учебное и справочное пособие. – 3-е издание – М.: Финансы и статистика, 2001. С.15-40.
5. Зарипов Р.Р. Влияние сеткит водородных связей в жидкой воде на ее структурные и динамические свойства. - Казанский (Приволжский) федеральный университет. – Казань: 2010. С. 23-27.
6. Машнин С.В., Машнин Т.С. К вопросу об аномальных свойствах воды Издательский Дом "Академия Естествознания". – Пенза: 2011 С: 165-166
7. Зверев В.П. Подземные воды земной коры и геологические процессы. М.: Научный мир, 2006. – 138 с.
8. Язвин Л.С. Оценка прогнозных ресурсов питьевых подземных вод и обеспеченность населения России подземными водами хозяйственно-питьевого назначения//Разведка и охрана недр.-2003. – 35 с.
9. Дривер Дж. Геохимия природных вод. М.:Мир,1985.-440с.
10. Плотников В.В. На перекрестках ЭКОЛОГИИ.-М.: Мысль, 1985. – 208с.
11. Воронцов Н.И. Вода питьевая. / Н.И. Воронцова.-М.: Стройиздат,1996. – 360с.
12. Новиков Ю.В., Сайфутдинов М.М. Вода и жизнь на Земле.-М.: Наука, 1981. – 184с.
13. Семенова И.В. Промышленная экология.: учеб. Пособие для вузов. Серия: Высшее профессиональное образование. Изд-во: Высшая школа, 2008. – 336с.
14. Осокин А.С. Основы общей химической технологии. Учебное пособие для пед.вузов. М.: Высшая школа. 1963. С. 38.
15. Подземные воды [Электронный ресурс] - Режим доступа – URL: https://geographyofrussia.com/podzemnye-vody-2/ (дата обращения 31.05.2016).
16. Лекции по Гидрогеологии. БашГУ, Россия, 2008. – 58 с.
17. Коробкин В.И. Экология. Высшее образование. – М.: Ростов- на- дону, 2005. - 458 с.
18. Крупнова Т.Г., Сухарев Ю.И. Химия окружающей среды: Учебное пособие. – Челябинск: Изд. ЮУрГУ, 2005. С. 23.
19. Проблема загрязнения биосферы [Электронный ресурс] - Режим доступа – URL: http://works.doklad.ru/view/KsUvtCC6S1E/all.html (дата обращения 12.04.2016).
20. Г.И. Петрова, М.Н. Мингазов, Е.А. Марков Оценка степени экологической устойчивости природных систем при загрязнении подземных вод Сборник трудов. ТатНИПИнефть. М.: 2009. -419-424 с.
21. ГОСТ 3351-74. «Вода питьевая. Методы определения вкуса, запаха, цветности и мутности».
22. Миклашевский Н.В., Королькова СВ. Чистая вода. Системы очистки бытовые фильтры. - СПб.:БХВ - СПб, «Издательская группа «Арлит». 2000. -240 c.
23. СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
24. СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
25. Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. – М.: Химия. 1984.
26. Методика выполнения измерений массовой доли элементов в пробах почв, грунтов и донных отложениях методами атомно–эмиссионной и атомно-абсорбционной спектроскопии. Санкт–Петербург, 2008.
ПРИЛОЖЕНИЯ
Приложение 1
Благоприятные органолептические свойства воды
|
Показатели |
Единицы измерения |
Нормативы, не более |
|
Запах |
Баллы |
2-3 |
|
Привкус |
Баллы |
2-3 |
|
Цветность |
Градусы |
30 |
|
Мутность |
ЕМФ (единицы мутности по формазину) или мг/л (по каолину) |
2,6 - 3,5 1,5 - 2 |
Примечание. Величина, указанная в скобках, может быть установлена по постановлению главного государственного санитарного врача по соответствующей территории для конкретной системы водоснабжения на основании оценки санитарно - эпидемиологической обстановки в населенном пункте и применяемой технологии водоподготовки.
Приложение 2
Обобщенные химические показатели воды
|
Показатель |
Единица измерения |
Норматив (ПДК), не более |
|
Водородный показатель |
рН |
6-9 |
|
Общая минерализация (сухой остаток) |
мг/л |
1000 - 1500 |
|
Жёсткость общая |
ммоль/л |
7,0 -10,0 |
|
Окисляемость перманганатная |
мг О2/л |
5,0-7,0 |
|
Нефтепродукты |
мг/л |
0,1 |
|
Поверхностно-активные и анионоактивные вещества |
мг/л |
0,5 |
|
Фенольный индекс |
мг/л |
0,25 |
Приложение 3
Требования к качеству воды нецентрализованного водоснабжения
|
Показатели |
Единицы измерения |
Норматив |
|
1 |
2 |
3 |
|
Органолептические |
||
|
Запах |
Баллы |
не более 2 – 3 |
|
Привкус |
Баллы |
не более 2 – 3 |
|
Цветность |
Градусы |
не более 30 |
|
Мутность |
ЕМФ (единицы мутности по формазину) |
в пределах 2,6 – 3,5 |
|
или мг/л (по коалину) |
в пределах 1,5 – 2,0 |
|
|
Химические |
||
|
Водородный показатель |
единицы pH |
в пределах 6 – 9 |
|
Жёсткость общая |
мг – экв/л |
в пределах 7 – 10 |
|
Нитраты |
мг/л |
не более 45 |
|
Общая минерализация (сухой остаток) |
мг/л |
в пределах 1000 – 1500 |
|
Окисляемость перманганатная |
мг/л |
в пределах 5 – 7 |
|
Сульфаты |
мг/л |
не более 500 |
|
Хлориды |
мг/л |
не более 350 |
|
Химические вещества неорганической и органической природы** |
мг/л |
ПДК |
|
Микробиологические |
||
|
Общие колиформные бактерии* |
число бактерий в 100 мл |
отсутствие |
|
Общее микробное число |
число образующих колонии микробов в 1 мл |
100 |
|
Термотолерантные колиформные бактерии** |
число бактерий в 100 мл |
отсутствие |
|
Колифаги** |
число бляшкообразующих единиц в 100 мл |
отсутствие |
|
* при отсутствии общих колиформных бактерий проводится определение глюкозоположительных колиформных бактерий (БГКП) с постановкой оксидазного теста; ** - дополнительные показатели |
||
Приложение 3
Содержание вредных химических веществ в питьевой воде
|
Показатели |
Единицы измерения |
ПДК, не более |
Показатель вредности |
Класс опасности |
|
|
Обобщенные показатели |
|||||
|
Водородный показатель |
pH |
6 – 9 |
|
|
|
|
Общая минерализация (сухой остаток) |
мг/л |
1000 (1500) |
|
|
|
|
Жесткость общая |
моль/л |
7,0 |
|
|
|
|
Окисляемость перманганатная |
мг/л |
5,0 |
|
|
|
|
Нефтепродукты, суммарно |
мг/л |
0,1 |
|
|
|
|
ПАВ |
мг/л |
0,5 |
|
|
|
|
Фенольный индекс |
мг/л |
0,25 |
|
|
|
|
Неорганические вещества |
|||||
|
Алюминий (Al3+) |
мг/л |
0,5 |
с-т |
2 |
|
|
Барий (Ва 2+) |
-"- |
0,1 |
-"- |
2 |
|
|
Бериллий (Be 2+) |
-"- |
0,0002 |
-"- |
1 |
|
|
Бор (В, суммарно) |
-"- |
0,5 |
-"- |
2 |
|
|
Железо (Fe. суммарно) |
-"- |
0,3(1,0) |
орг. |
|
|
|
Кадмий (Cd, суммарно) |
-"- |
0,001 |
с-т |
2 |
|
|
Марганец (Мп, суммарно) |
-"- |
0,1(0,5) |
орг. |
3 |
|
|
Медь (Си, суммарно) |
-"- |
1,0 |
-"- |
3 |
|
|
Молибден (Мо, суммарно) |
-"- |
0,25 |
с-т |
2 |
|
|
Мышьяк (As, суммарно) |
-"- |
0,05 |
с-т |
2 |
|
|
Никель (Ni, суммарно) |
мг/л |
0,1 |
с-т |
3 |
|
|
Нитраты |
-"- |
45 |
орг. |
3 |
|
|
Ртуть (Hg, суммарно) |
-"- |
0.0005 |
с-т |
1 |
|
|
Свинец (РЬ, суммарно) |
-"- |
0,03 |
-"- |
2 |
|
|
Селен (Se, суммарно) |
-"- |
0,01 |
-"- |
2 |
|
|
Стронций (Sr2+) |
-"- |
7,0 |
-"- |
2 |
|
|
Сульфаты (S042-) |
-"- |
500 |
орг. |
4 |
|
|
Фториды (F) |
|
1,2 – 1,5 |
с-т |
2 |
|
|
Хлориды (Сl) |
-"- |
350 |
орг. |
4 |
|
|
Xpoм (Cr6+) |
-"- |
0,05 |
с-т |
3 |
|
|
Цианиды (CN-) |
-"- |
0,035 |
-"- |
2 |
|
|
Цинк (Zn 2+) |
-"- |
5,0 |
орг. |
3 |
|
|
Органические вещества |
|||||
|
У-ГХЦГ (линдан) |
-"- |
0,002 |
-"- |
1 |
|
|
ДДТ (сумма изомеров) |
-"- |
0,0021 |
-"- |
2 |
|
|
2.4-Д |
-"- |
0,03 |
-"- |
2 |
|
Примечание: Лимитирующий признак вредности вещества, по которому установлен норматив: «с-т» - санитарно-токсикологический, «орг.» - органолептический.
Приложение 4
Содержание вредных химических веществ, поступающих и образующихся в воде в процессе ее обработки в системе водоснабжения
|
Показатели |
Единица измерения |
ПДК, не более |
Показатель вредности |
Класс опасности |
|
Хлор: |
||||
|
- остаточный свободный |
мг/л |
0,3 – 0,5 |
орг. |
3 |
|
- остаточный связанный |
мг/л |
0,8 -1,2 |
орг. |
3 |
|
Хлороформ (при хлорировании воды) |
мг/л |
0,2 |
с-т |
2 |
|
Озон остаточный |
мг/л |
0,3 |
орг. |
|
|
Формальдегид (при озонировании воды) |
мг/л |
0,05 |
с-т |
2 |
|
Полиакриламид |
мг/л |
2,0 |
с-т |
2 |
|
Полифосфаты |
мг/л |
3,5 |
орг. |
3 |
В данный список включены гигиенические нормативы 8 групп вредных химических веществ (около 1200), которые могут присутствовать в питьевой
Приложение 5
Оценка интенсивности запаха
|
Интенсивность запаха |
Характер проявления запаха |
Интенсивность запаха, баллы |
|
Нет |
Запах не ощущается |
0 |
|
Очень слабая |
Запах не ощущается потребителем, но обнаруживается при лабораторном исследовании |
1 |
|
Слабая |
Запах замечается потребителем, если обратить на это его внимание |
2 |
|
Заметная |
Запах легко замечается и вызывает неодобрительный отзыв о воде |
3 |
|
Отчетливая |
Запах обращает на себя внимание и заставляет воздержаться от питья |
4 |
|
Очень сильная |
Запах настолько сильный, что делает воду непригодной к употреблению |
5 |
Приложение 6
|
Интенсивность вкуса и привкуса |
Характер проявления вкуса и привкуса |
Оценка интенсивности вкуса и привкуса |
|
Нет |
Вкус и привкус не ощущаются |
0 |
|
Очень слабая |
Вкус и привкус сразу не ощущаются потребителем, но обнаруживается при тщательном тестировании |
1 |
|
Слабая |
Вкус и привкус замечаются, если обратить на это внимание |
2 |
|
Заметная |
Вкус и привкус легко замечаются и вызывают неодобрительный отзыв о качестве воды |
3 |
|
Отчетливая |
Вкус и привкус обращают на себя внимание и заставляют воздержаться от употребления |
4 |
|
Очень сильная |
Вкус и привкус настолько сильные, что делают воду непригодной употреблению |
5 |
Приложение 7
Вид родника «Святая вода» д. Гребени Бирского района РБ

Приложение 8
Вид родника «Святая вода» д. Гребени Бирского района РБ

Приложение 9
Вид родника села Бахтыбаево Бирского района РБ

Приложение 10
Вид родника села Бахтыбаево Бирского района РБ

Приложение 11
Вид родника села Новокульчубаево Бирского района РБ

Скачано с www.znanio.ru
[1] Бокий Г.Б. Кристаллохимические соображения о поведении воды в мерзлых фунтах. – Вести. МГУ. Геология, 2009. -596 с.
[2] Вода [Электронный ресурс] - Режим доступа – URL: http://www.habit.ru/18/85.htm (дата обращения 12.04.2016).
[3] Исследование экологического состояния родников д. Кельмаксола [Электронный ресурс] - Режим доступа – URL: http://gigabaza.ru/doc/102610.html (дата обращения 11.04.2016).
[4] Протасов В.Ф. Экология, здоровье и охрана окружающей среды в России. Учебное и справочное пособие. – 3-е издание – М.: Финансы и статистика, 2001. С.15-40.
[5] Зарипов Р.Р. Влияние сеткит водородных связей в жидкой воде на ее структурные и динамические свойства. - Казанский (Приволжский) федеральный университет. – Казань: 2010. С. 23-27.
[6] Машнин С.В., Машнин Т.С. К вопросу об аномальных свойствах воды Издательский Дом "Академия Естествознания". – Пенза: 2011 С: 165-166
[7] Зверев В.П. Подземные воды земной коры и геологические процессы. М.: Научный мир, 2006. – 138 с.
[8] Язвин Л.С. Оценка прогнозных ресурсов питьевых подземных вод и обеспеченность населения России подземными водами хозяйственно-питьевого назначения//Разведка и охрана недр.-2003.- 35 с.
[9] Дривер Дж. Геохимия природных вод. М.:Мир,1985.-440 с.
[10] Плотников В.В. На перекрестках ЭКОЛОГИИ.-М.: Мысль, 1985. – 208с.
[11] Воронцов Н.И. Вода питьевая. / Н.И. Воронцова.-М.: Стройиздат,1996. – 360с.
[12] Новиков Ю.В., Сайфутдинов М.М. Вода и жизнь на Земле.-М.: Наука, 1981. – 184с.
[13] Семенова И.В. Промышленная экология.: учеб. Пособие для вузов. Серия: Высшее профессиональное образование. Изд-во: Высшая школа, 2008. – 336с.
[14] Осокин А.С. Основы общей химической технологии. Учебное пособие для пед.вузов. М.: Высшая школа. 1963. С. 38.
[15] Подземные воды [Электронный ресурс] - Режим доступа – URL: https://geographyofrussia.com/podzemnye-vody-2/ (дата обращения 31.05.2016).
[16] Лекции по Гидрогеологии. БашГУ, Россия, 2008. – 58 с.
[17] Коробкин В.И. Экология. Высшее образование. – М.: Ростов- на- дону, 2005. - 458 с.
[18] Крупнова Т.Г., Сухарев Ю.И. Химия окружающей среды: Учебное пособие. – Челябинск: Изд. ЮУрГУ, 2005. С. 23.
[19] Проблема загрязнения биосферы [Электронный ресурс] - Режим доступа – URL: http://works.doklad.ru/view/KsUvtCC6S1E/all.html (дата обращения 12.04.2016).
[20] Г.И. Петрова, М.Н. Мингазов, Е.А. Марков Оценка степени экологической устойчивости природных систем при загрязнении подземных вод Сборник трудов. ТатНИПИнефть. М.: 2009. -419-424 с.
[21] ГОСТ 3351-74. «Вода питьевая. Методы определения вкуса, запаха,
цветности и мутности».
[22] Миклашевский Н.В., Королькова СВ. Чистая вода. Системы очистки бытовые фильтры. - СПб.:БХВ - СПб, «Издательская группа «Арлит». 2000. -240 c.
[23] СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
[24] СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
[25] Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. – М.: Химия. 1984.
[26] Методика выполнения измерений массовой доли элементов в пробах почв, грунтов и донных отложениях методами атомно–эмиссионной и атомно-абсорбционной спектроскопии. Санкт–Петербург, 2008.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.