
Введение
1. Органическая химия изучает
2. Многообразие органических соединений обусловлено
3. Ученый, сождавший теорию строения органических веществ, основу современной химии
4. Процесс распада молекул сложных (тяжелых) углеводородов до более простых, под действием высокой температуры и катализаторов:
1. Крекинг;
2. Термическийкрекинг;
3. Ректификационная перегонка;
4. Каталитическийкрекинг;
5. Простая перегонка.
5. Процесс, при котором происходит многократное испарение и конденсация
различных соединений:
1. Крекинг;
2. Простая перегонка;
3. Ректификационная перегонка;
4. Перегонка;
5. Возгонка.
6.Вещества, имеющие одну и ту же эмпирическую формулу (обладающие одинаковым количественным и качественным составом), но разный порядок расположения атомов в молекуле, т.е. разное строение, а потому, и различные свойства называются
1. Гомологами;
2. Радикалами;
3. Молекулами;
4. Изомерами;
7.Атом или группа атомов, содержащих одну или несколько незавершенных электронных пар и за счет этого обладающих высокой реакционной способностью и коротким сроком жизни называются
8. В предельных органических соединениях реализуется связь
9. Схема Н3С: СН3 → 2СН3* иллюстрирует _______ тип разрыва ковалентной связи
10.
Наблюдается мезомерный эффект(![]() )в молекуле
)в молекуле
1. СН2=СН-Сl
2. СН2 =СН- СН =СН2
4. СН3NО2
5. С6Н5СН3
11.Не подчиняется правилу Марковникова гидрогалогенирование
1. 3-метилбутен-1
2. пентен-1
3. бутен-2
4. 2-метилбутен-2
5. 2-метилбутен-1
12. При крекинге алканов образуется:
1.алкены
2.алкины
3. алкадиены
4.алкены и алкины
5. алканы и алкены
13. Наблюдается мезомерный эффект (![]() )в
молекуле
)в
молекуле
1. СН2=СН-J
2. С6Н5СН2Сl
3.СН3-С6Н4-СН2Сl
4.СН2=СН- СН2Сl
5. СН2= СН-СОН
14. Мономер природного каучука:
1. бутадиен
2. дивинил
3. изопрен
4.хлоропрен
5. изобутилен
15. К реакциям с изменением углеродного скелета относится:
1. замещения
2.присоединения
3.отщепления
4. изомеризации
5. циклизация
16. Индуктивный эффект – это:
1. электроны смещаются к более электроотрицательному атому
2. электроны отталкиваются от электроотрицательных атомов
3. ионы водорода (протоны) присоединяются к более электроотрицательному атому
4. кислородсодержащие вещества присоединяют молекулы воды
5. галогены уходят от молекул в виде ионов
17. ИК-спктроскопия не применяется для.
1. установление идентичности;
2. исследование строения;
3. установление функциональных групп;
4. изучение внутри и межмолекулярных взаимодействий;
5. качественный анализа.
18. Изомеры-
1) Вещества, одинаковые по химическому составу, но различные по химическому строению и свойствам;
2) Вещества, сходные по строению и свойствам, но различающиеся по составу на одну или несколько групп СН2;
3) Макромолекулы, состоящие из большого числа повторяющихся звеньев;
4) Макромолекулы, способные образовывать длинные цепочки атомов,
5) Среди ответов правильного ответа нет.
19.Гомологи -
1) Вещества, одинаковые по химическому составу, но различные по химическому строению и свойствам;
2) Вещества, сходные по строению и свойствам, но различающиеся по составу на одну или несколько групп СН2;
3) Макромолекулы, состоящие из большого числа повторяющихся звеньев;
4) Макромолекулы, способные образовывать длинные цепочки атомов;
5) Среди ответов правильного ответа нет
20. Не относятся к реакциям замещения:
1. Галогенирования;
2. Нитрования;
3. Термического разложения;
4.Сульфохлорирования;
5.Ацилирования.
21. Основным отличием фракционной перегонки нефти от крекинга является, что:
1. В процессе пергонки получают большее количество продуктов;
2. В процессе перегонки не происходит превращение составных частей нефти в
другие продукты;
3. Процесс крекинга проводят при постоянной температуре;
4. Правильного ответа нет;
5. В процессе перегонки происходит превращение составных частей нефти в другие продукты.
22.. Спектры ЯМР анализируются в следующих направлениях
А) Химический сдвиг;
В) Батохромный сдвиг;
С) Гипохромный сдвиг;
D) Определение хромофоров;
Е) Интенсивность поглощения.
«Углеводороды»Алканы, алкены. алкины
23. Среди веществ: СН3-СН2-СН2-СН3; СН3-СН=СН-СН3; СН3-СН2-СН3; СН2=СН-СН2-СН3 - число гомологов равно:
1) 4;
2) 3;
3) 2;
4) 1;
5) гомологов нет.
24.Бутан при нормальных условиях тяжелее воздуха в:
1) 1,2 раза
2) 1,5 раза
3) 2 раза
4) 2,4 раза
5) 3 раза
25.Среди приведенных предельных углеводородов изомером н-гексана является:
1. 2-метилгексан
2. 2,2-диметилбутан
3. 2,3-диметилпентан
4. 2,3,4-триметилпентан
5. 2-метилбутан
26.Вторичных атомов углерода в н-гексане:
6. один
7. два
8. три
9. четыре
10. пять
27.75 г этана при нормальных условиях занимают объем (л), равный:
1.11,2
2.22,4
3.33,6
4.44,8
5.56
28.Определите предельный углеводород, плотность паров которого по воздуху равна 3,448:
1.бутан
2.пентан
3.гексан
4.гептан
5.октан
29.Из алканациклоалкан можно получить реакцией:
1.гидрирования
2.дегидрирования
3.гидратации
4.дегидратации
5.замещения
30.Химическое соединение с простейшей эмпирической формулой СН2 имеет относительную молекулярную массу 28 а.е.м. Химическая формула:
1. С2Н4;
2. СН4;
3. СН2;
4. С2Н6;
5. С2Н2.
.
31. Предельные углеводороды не реагируют с…
1. гидроксидом натрия
2. хлором
3. бромом
4. кислородом
5. азотной кислотой
32. Формула алкана, которая имеет относительную молекулярную массу – 142
1. С10Н22
2. С9Н20
3. С8Н18
4. С7Н16
5. С6Н14
33..В ряду алканов начинается изомерия с
1 . метана
2 . бутана
3 . этана
4 .пентана
5 . гексана
34. Атом углерода в органических соединениях имеет валентность:
1. II, III, IV;
2. II, IV;
3. IV;
4. III, IV;
5.II.
35.Атомныеорбитали углерода в органических соединениях могут быть гибридизованы по типу:
1. sp3; sp2; sp;
2. sp3; sp2;
3. sp3;
4. sp;
5. sp2.
36. При гомолитическом разрыве С – С связи в молекуле этана образуются частицы:
1) СН3;
2) СН3 – СН2. и. Н;
3) СН3 – СН2- и Н+;
4) СН3 – СН2 . ;
5) СН3 – СН2-.
37. Гомологом метана является:
1) С6Н14;
2) С15Н30;
3) С8Н14;
4) С3Н6;
5) С2Н2.
38. Число изомеров соединения С5Н12:
1) 1;
2) 3;
3) 4;
4) 2;
5) 5
39.Атомные орбитали углерода в предельных углеводородах имеют тип гибридизации:
1) sp3;
2) sp2;
3) sp;
4) sp2,sp;
5) sp3, sp2.
40.2, 3, 4-триметилпентан имеет брутто – формулу:
1) С5Н12;
2) С6Н14;
3) С8Н18;
4) С7Н16;
5) С8Н16.
41.Относительная плотность по воздуху углеводорода С4Н10:
1) 2;
2) 4;
3) 29;
4) 3;
5) 28.
42.Объем при н.у. пропана массой 1 г:
1. 22,4 л;
2.1 л;
3. 0,51 л;
4. 11,2 л;
5. 5,6 л.
43.Основной тип химических реакций, характерный для предельных углеводородов:
1) Реакции присоединения;
2) Реакции замещения;
3) Реакции разложения;
4) Реакции этерификации;
5) Реакции обмена.
44..Взорвали смесь метана объемом 4 л и кислорода объемом 9 л. При этом образовался оксид углерода (IV) объемом:
1. 4 л;
2. 9 л;
3. 13 л;
4. 2 л;
5. 10 л.
45.В два стакана, содержащих хлороформ и хлорид калия, прилили раствор нитрата серебра. В результате:
1. В обоих стаканах наблюдается выпадение одинакового осадка;
2. В стаканах образуются осадки разного состава;
3. Осадок образуется только в одном стакане;
4. Осадок не образуется
5. Среди вариантов ответов правильного нет.
46.Вещество содержит 72,72 % углерода и 18,18 % водорода. Плотность пара вещества по водороду равна 22. Это:
1. Этан;
2. Пропан;
3. Бутан;
4. Метан;
5. Пентан.
47..Зашифрованы под буквами А и В в схеме превращений:
![]()
свет
1. С2Н5Cl; C2H4;
2. С2Н5СI; С4H10;
3. C2H5CI; C2H5Na;
4.C2H4; C4H10;
5. C4H10; C2H5Na.
48..Используется при получении метана в лаборатории:
1) СН3СООН;
2) СН3ОН;
3) СН3СООNa;
4) CH3CI;
5) CH3NH2.
49.Не вступает алканы в реакцию:
1. Хлором;
2. Азотной кислотой;
3.Кислородом;
4. Натрием;
5.Водой.
50..Общая формула углеводородов – гомологов этилена:
1.СnH2n +2;
2. CnH2n+1;
3.CnH2n;
4. CnH2n-2;
5. CnH2n-1.
51..Цис-трансизомерияхарактернадля:
1.СН3-СН=СН2;
2.СН2=СН2;
3.СН3-СН=СН-СН3;
4.СН![]() СН;
СН;
5.СН3-С (СН)3=СН2.
52.Число изомеров гомолога этилена общей формулы С5Н10:
1. 3;
2. 5;
3. 6;
4. 2;
5. 4
53.Реакции присоединения к этилену и его гомологам проходят по механизму:
1. Нуклеофильному
2. Ионному;
3. Механизм не выяснен;
4. Цепному радикальному;
5.Среди вариантов ответов правильного нет.
54.Этиленовым углеводородом может быть:
1.С2Н2
2.С3Н4
3.С4Н8
4.С4Н10
5.С5Н12
55. 15г пропилена при нормальных условиях занимают объем, равный (л)
1.два
2.четыре
3.пять
4.шесть
5.восемь
56.В молекуле пропена в состоянии sp3 – гибридизации находятся атомов углерода:
1.один
2.два
3.три
4. четыре
5.ни одного
57..Геометрическая изомерия в гомологическом ряду этиленовых углеводородов начинается с:
1.этена
2.пропена
3.бутена
4.пентена
5.гексена
58.Укажите алкен, для которого не распрастраняется правило Марковникова при их взаимодействии с галогеноводородом:
1.пропен
2.1-бутен
3.2-бутен
4.3-метил-1-бутен
5.1-пентен
59.При гидрировании этилена образовалось 6 г этана (н.у.). Объем этилена (л), подвергшийся гидрированию:
1) 4,48
2) 8,96
3) 11,2
4) 22,4
5) 33,6
60.Из перечисленных веществ: CI2; HCI; H2O; Br2; HBr – с этиленом и его гомологами реагируют:
1. Br2и CI2;
2. HBr и H2O;
3. Все перечисленные вещества;
4. Br2 и H2O;
5. CI2 и HCI.
61. Продукт взаимодействия брома с бутеном-1 :
1. 1,2-дибромбутан;
2. 2,2-дибромбутан;
3. 1-бромбутен-1;
4. н-бутан;
5. Изобутан .
62. Этан и этилен можно легко различить :
1. Пропуская газы через бромную воду;
2. Измерив объемы СО2, полученные при сжигании одинаковых объемов газов;
3. По запаху;
4. По агрегатному состоянию;
5. Среди вариантов ответов правильного нет.
63. При сжигании 0,5 моль углеводорода получили по 1,5 моль оксида углерода (IV) и воды. Молекулярная формула углеводорода:
1. С2Н4;
2. С3Н6;
3. С4Н8;
4. С3Н8;
5. С4Н10.
64. Объем оксида углерода (IV) (н.у.) при сгорании бутена-2 массой 2,8 г:
1. 4,48 л;
2. 5,6 л;
3. 11,2 л;
4. 22,4 л;
5. 2,24 л.
65. Сумма коэффициентов уравнения реакции сгорания пропена:
1. 11;
2. 16;
3. 23;
4. 20;
5. 15
66. Углеводород, содержащий в составе 3 атома С и 6 атомов Н:
I. Может принадлежать циклоалканам
II. Может быть алкеном
III. Может быть алкином
Какие из этих утверждений верны?
А) Только I
В) Только II
С) Только III
D) I – II
Е) II – III
67. Углеводород, в составе которого количество атомов Н в два раза больше количества атомов С, имеет лишь одинарные связи. Согласно этому:
I. Может принадлежать циклоалканам
II. Может быть алкеном
III. Может быть разветвленным алканом
Какие из этих утверждений верны?
А) Только I
В) Только II
С) Только III
D) I – III
Е) II – III
68. Для молекулы с формулой СnH2n c атомами углерода расположенные вдоль одной цепи:
I. Обесцвечивает бромную воду
II. При сгорании данного соединения образуется одинаковое количество СО2 и Н2О
III. Имеет одну двойную связь
Какие из этих утверждений точно верны?
А) Только I
В) Только II
С) Только III
D) I – III
Е) II – III
69. Соединения А и В в схеме превращений
этилен![]()
H2O
1. Хлорэтан, этанол;
2. Хлорэтилен, хлорэтанол;
3. Хлорэтан, этилен;
4. Хлорэтилен, этилен;
5. Этилен, этанол.
70. Образуется при взаимодействии этилена с водой:
1.Ацетальдегид;
2.Ацетон;
3.Диэтиловый эфир;
4.Уксусная кислота;
5.Этанол.
71. Образуется при окислении этилена в растворе перманганата калия:
1. Щавелевая кислота;
2. Этиловый спирт;
3. Этиленгликоль;
4. Уксусная кислота;
5. Глицерин.
72.Общая формула гомологов ацетилена:
1. CnH2n+2;
2. CnH2n;
3. CnH2n-2;
4. CnH2n+1;
5. CnH2n-6.
73.Гомологи ацетилена содержат:
1. Тройные связи;
2. Одинарные и тройные связи;
3. Двойные и тройные связи;
4. Одинарные и двойные связи;
5. Двойные связи.
74. В
молекуле пропина количество ![]() - связей:
- связей:
1. три
2. четыре
3. пять
4. шесть
5. семь
75. Молекула ацетилена имеет строение:
1. Угловое;
2. Плоское;
3. Линейное;
4. Тригональное;
5. Тетраэдрическое.
76. Типы изомерии ацетиленовых углеводородов:
1. Положение тройной связи;
2. Цис-транс изомерия;
3. Оптическая изомерия;
4. D, L-изомерия;
5. Изомерия вращения заместителей вокруг С=С связи.
77.. В
молекуле 1-бутина соотношение ![]() и
и ![]() связей:
связей:
1. 6:1
2. 6:2
3. 7:2
4. 8:2
5. 9:2
78. При сгорании ацетилена в недостатке кислорода образуется :
1.Оксид углерода (II);
2.Оксид углерода (II) и водород;
3.Углерод (сажа) и вода;
4.Углерод и водород;
5.Оксид углерода (IV).
79. В двух сосудах находится этилен и ацетилен. Для распознавания этих газов необходимо провести реакцию:
1. С аммиачным раствором нитрата серебра;
2. С бромной водой;
3. С газообразным углеводородом;
4. С хлорной водой;
5. С водой.
80. Соединения представленые в схеме под символами А и В:
карбид кальция![]() А
А![]() В
В
Hg2+
1. СО2; Н2СО3;
2. С2Н2; CH3CHO;
3. C2H2; реакция не идет;
4. Реакция не идет;
5. СО2; С2Н2.
81. Образуется при тримеризации ацетилена:
1. Гексан;
2. Циклогексан;
3. Гексен;
4. Гексин;
5. Бензол.
82. Образуется по реакции СаС2+Н2О:
1. Этилен;
2. Ацетилен;
3. Ацетальдегид;
4. Метан;
5. Уксусная кислота.
83. Получится по реакции Кучерова:
1. Ацетальдегид;
2. Этиленгликоль;
3. Уксусная кислота;
4. Ацетилен;
5. Бензол.
84. 2-бром-2-метилбутан вступают в реакцию Вюрцас:
1. Водный раствор щелочи;
2. Аммиак;
3. Металлический натрий;
4. Цианид калия;
5. Металлический магний.
85. Тетрабромпроизводное образуется в результате реакции бромирования.
1. Этилена;
2. Ацетилена;
4. Пропанона;
5. Уксусной кислоты.
86. Вещество А, образующееся в реакции по схеме:
СН ![]() СH
СH![]() A
A ![]() B
B
1. этилен;
2. метилацетилен;
3. пропен;
4. этилацетилен;
5. бутин-2
87. Вещество В, образующееся в реакции по схеме:
СН
![]() СH
СH![]() A
A ![]() B:
B:
1. этилен;
2. метилацетилен;
3. пропин;
4. этан;
5. бутин-2
88. Продукт рекации: СаС2+Н2О
1. НС ![]() СН и СаО;
СН и СаО;
2. НС ![]() СН и Са(ОН)2;
СН и Са(ОН)2;
3. Н2С = СН2 и СаО;
4. Н2С = СН2 и Са(ОН)2;
5. НС ![]() СН и СаО, Н2.
СН и СаО, Н2.
89. Взаимодействие этилена с водой относится типу реакции.
90. Обесцвечивание бромной воды органическим соединением в обычных условиях
используют как качественную реакцию на:
1. Гидроксогруппу;
2. Кратную углерод-углеродную связь;
3. Карбонильную группу;
4. Карбоксильную группу;
5. Сложно эфирную группу.
91.Реагент реакциийВюрца при взаимодействии с 2-бром-2-метилбутаном
1.водный раствор щелочи;
2.аммиак;
3.металлический натрий;
4.цианид калия;
5. металлический цинк.
92. Вещества, имеющие формулы СН3-СН3 (А) и С3Н8 (Б) называются________ и являются_______.
93. Гомологом пропана (С3Н8) является ______.
94. Можно ли из метана получить хлороформ (трихлорметан).
95. Масса углерода (г), полученного при разложении 10 моль метана
96.Углеводороды, молекулы которых содержат одну двойную связь :
97. Масса полиэтилена, который получится из 89,6 л этилена.
1. 28 г;
2. 28 кг;
3. 0,56 кг;
4. 0,12 кг;
5. 112 г.
98. Масса вещества, полученного при реакции 11,2 л этилена и 90 г брома.
1. 0,94 кг;
2. 0,094 г;
3. 94 г;
4. 0,198 кг;
5. 198 г.
99. Не является продуктом коксования каменного угля:
1. Каменноугольная смола;
2. Гудрон;
3. Коксовый газ;
4. Правильного ответа нет;
5. Окатыши
100. С ![]() реакция невозможна на
стадии
реакция невозможна на
стадии
1. 1
2. 2
3. 3
4. 4
5. во всех случаях
101. 2,5 гр. алкена поглощают 5,71 г. брома, его молекулярная формула
1. С4Н8
2. С5Н10
3. С6Н12
4. С3Н6
5. С2Н4
102. Нефть – :
103. Для получения бензина, лигроина, керосина, гайзоля и мазута нефть подвергают:
104. Процесс распада молекул сложных (тяжелых) углеводородов до более простых, под
действием высокой температуры и катализаторов:
1.Крекинг;
2.Термический крекинг;
3.Ректификационная перегонка;
4.Каталитический крекинг;
5.Простая перегонка.
105.Процесс, при котором происходит многократное испарение и конденсация
различных соединений:
1.Крекинг;
2.Ректификационная перегонка;
3.Простая перегонка;
4.Перегонка;
5.Возгонка.
106.Наблюдается мезомерный эффект(![]() )в
молекуле
)в
молекуле
1. СН2=СН-Сl
2. СН3-СН=СН-СОН
4. СН3NО2
5. С6Н5СН3
107.Не подчиняется правилу Марковникова гидрогалогенирование
1. 3-метилбутен-1
2. пентен-1
3. пентен-
4. 2-метилбутен-2
5. 2-метилбутен-1
108.При крекинге алканов образуется:
1.алкены
2.алкины
3. алкадиены
4.алкены и алкины
5. алканы и алкены
109.Наблюдается мезомерный эффект (![]() )в
молекуле
)в
молекуле
1. СН2=СН-Сl
2. С6Н5СН2Сl
3.СН3-С6Н4-СН2Сl
4.СН2=СН- СН2Сl
5. СН2= СН-СОН
110.Получается ацетон при гидратации:
1. ацетилена
2. пропина
3. бутина-1
4.бутина-2
5. пентина
111.Мономер природного каучука:
1. бутадиен
2. дивинил
3. изопрен
4.хлоропрен
5. изобутилен
112.Лимитирующая стадия в процессе электрофильного замещения:
1. присоединение электрофильной частицы к молекуле бензола
2. образование ![]() комплекса
комплекса
3. разрушение ![]() комплекса
комплекса
4.превращение ![]() комплекса в
комплекса в ![]() комплекс
комплекс
5. отщепление Н+-иона
113.При действии спиртового раствора щелочи можно получить бутин-2 из
1. СН3-СН Сl-СН Сl-СН3
2. СН3-С Сl2-С Сl2-СН2-С Н3
3. СН2Сl-СН Сl-СН Сl-СН2 Сl
4. СН3- СН2- СН2- СН3
5.СН Сl2-СН2- СН2-СН Сl2
114.К реакциям присоединения алкенов не относится
1. гидрирование
2. гидратация
3.полимеризации
4.гидрогалогенирование
5.галогенирование
115.Получают алкен при действии на вицинальныедигалогеналканы
1. водным раствором щелочи
2. хлоридом алюминия
3. металлическим натрием
4.бромной водой
5. цинковой пылью
116.Образуется при взаимодействии натриевой соли масляной кислоты и натронной извести:
1. метан
2. этан
3. пропан
4. бутан
5. пентан
117. В углеводородах реализуется..................................... связь
1. Неполярная ковалентная;
2. Полярная ковалентная;
3. Неполярная ковалентная и полярная ковалентная;
4. Ионная;
5. Полярная, неполярная ковалентная и ионная.
118. Формулы СН3-(СН2)2- СН3, С4Н10 и СН3-СН2-СН2-СН3 отражают
строение
119. Схема Н+ │:-СН3 → Н+ + СН3- иллюстрирует ______ тип разрыва ковалентной связи
120. Изомер н-бутана (СН3-(СН2)2-СН3).
121. Уравнение дегидрогенизации бутана:
122. Масса вещества, полученного при гидратации 44,8 л этилена (выход
продукта-100%)
123. Фракции нефти расположены в порядке возрастания температур их кипения в ряду:
1. Керосин, бензин, газойль;
2. Газойль, бензин, керосин;
3. Бензин, керосин, газойль;
4. Керосин, газойль, бензин;
5. Газойль, керосин, бензин.
124. Наиболее частые области применения УФ-спктроскопии..
1.Установление идентичности;
2. Исследование строения;
3.Установление функциональных групп;
4. Изучение внутри и межмолекулярных взаимодействий;
5.Наличие кратных связей
«Диеновые углеводороды»
125.Общая формула диеновых углеводородов:
1) СnH2n+1
2) СnH2n
3) СnH2n-2
4) СnH2n-6
5) СnH2n+2
126.Число атомов углерода в диеновом углеводороде, содержащем четырнадцать атомов водорода :
1. шести
2. семи
3. восьми
4. девяти
5. десяти
127.Массовая доля углерода в молекуле 1,2- пентадиена (%):
1. 86,8
2. 87,2
3. 88,2
4. 90,2
5. 90,8
128. Число изомеров диенового соединения с общей формулой С5Н8:
1) 5
2) 8
3) 10
4) 4
5) 6
129. Преимущественно образуется при присоединении одной молекулы
бромоводорода к бутадиену – 1,3:
1. 3-бромбутен-1;
2. 4-бромбутен-1;
3. 1-бромбутен-2;
4. 1,4-бромбутен-2;
5. Хлорпрен.
130. Общая формула вещества
СН2=СН-СН=СН2:
1. СnH2n-2;
2. CnH2n;
3. CnH2n+2;
4. CnH2n-6;
5. CnH2n-1.
131. Диеновые углеводороды способны присоединять в положения 1,4 производные
алкенов с активированной двойной связью и образованием шестичленных циклов с
одной двойной связью. Эта реакция:
132. Практический выход бутадиена (в процентах от теоретически возможного) полученного в количестве 40 л. из этилового спирта m=184 г., составляет
1. 22,32
2. 44,65
3. 89,3
4. 4,465
5. 8,93
133.Гексадиен входит в гомологический ряд, имеющий общую формулу:
1. CnH2n;
2. СnH2n-2;
3. CnH2n+3;
4. CnH2n-6
5. CnH2n+2
134.Реакция получения бутадиена из бутандиола-1,4
1.дегидратация
2.дегидратация и дегидрирование
3.флотация
4.дегидрирования
5.дегидратация и гидрирование
“ Галогенпроизводные углеводородов”
135.Число изомеров состава С5Н11Вr.
1.4;
2.0;
3.10;
4.8;
5.2.
136.Структурная формула 2-бром-2,3-диметилбутана:
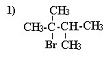
![]()
![]()
![]()
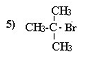
137.Наибольшаяэлектроотрицательность галогена при реакции нуклеофильного замещения:
1. CI;
2. F;
3. I;
4. Br-;
5. нет правильного ответа.
138.Бутен-2![]() А
А![]() Б
Б![]() В
В
Назовите вещество Б:
1.2-бромбутан;
2.2,2-дибромбутан;
3.n-бром-замещенный 2-фенилбутан;
4.м-бром-замещенный –2-фенилбутан;
5.2-фенилбутан.
139.Легче идет реакция гидролиза по механизму SN2 с:
1.пропилхлоридом;
2.изопропилхлоридом;
3.третбутилбромидом;
4.изобутилиодидом;
5.2-хлор-пентаном.
140.Образуются при действии хлороводорода на гексадиен 2, 4:
1.один продукт 1,4-присоединения и два продукта 1, 2- присоединения ;
2.два продукта 1, 4-присоединения и один продукт 1,2-присоединения;
3.продукты 2,3 и 2,5 - присоединения;
4.продукт 1, 4-присоединения;
5.продукт 1, 2 -присоединения.
141.Тетрахлорметан используется при тушении пожара, потому что он -:
1.Хороший растворитель;
2.Летучее вещество;
3.Хорошо поглощает тепло;
4.Имеет резкий запах;
5.Не горит.
142.Реакция нуклеофильного замещения СН3(СН2)2-СН2CI идет по механизму:
1. SN1;
2. SN2;
3. SN1, SN2;
4. SR;
5. AE.
143. Объём этана (н.у.), которые образуется при взаимодействии 151,5 г. хлорметана с металлическим натрием:
1.11,2л;
2.5,6л;
3.22,4л;
4. 33,6л;
5.44,8л.
144.Восстанавливается водородом:
1) СН3СОН;
2) СН3ОСН3;
3) СН3СООН;
4) С2Н5ОН;
5) СН3СI.
145. Функциональная группа карбоновых кислот:
1) -NO2;
2) SN (меркапто-);
3) -СНО;
4) -СООН;
5) -С=О
146.Правило Марковникова описывает закономерности реакции гидрогалогенирования.
1. Ацетилена;
2. Этилена;
3. Циклогексана;
5. Пропилена.
147.При взаимодействии с бромом может образовать 1,2- дибромэтан
1.этан;
2.этин;
3.этен;
4.бутадиен-1,3;
5.пропен.
148. К какому атому углерода присоединится бром при реакции между СН3-СН2-СН=СНСI и бромоводородом:
1.ко второму;
2.к первому;
3.к четвертому;
4.к третьему;
5.среди вариантов правильного ответа нет.
149. При взаимодействии пентена-1 с хлористым водородом образуется:
1. 1-хлорпентан;
150.Необходимо учитывать правило Марковникова при взаимодействии с водой
1.бутадиен-1,3;
2.метан;
3.этан;
4.этин;
5.пропен;
151. Взаимодействие пропена с бромоводородом относится к реакции
152. Тип гибридизации орбиталей углеродных атомов, связанных тройной
связью
153. На 2- бромпропан подействовали металлическим натрием, полученное
соединение
154. Объем углекислого газа, который получается при сжигании 6 м3ацетилена.
155. Группа галогенопроизводных в основе классификации, которой лежит строение углеводородного радикала.
“спирты
156.Функциональная группа спиртов
1. R-;
2. –OH;
3. –C6H5;
4. –CHO;
5. –NH2.
157. Предельный одноатомный спирт, формула СН3 – СН2 – СН(ОН) – СН3:
1. 2 – метил – 1 – пропанол
2. 2 – метил – 2 – пропанол
3. 2 – бутанол
4. 1 – бутанол
5. 2 – этил – 2 – этанол
158. При окислении этилового спирта образуется альдегид:
1. муравьиный
2. уксусный
3. пропионовый
4. масляный
5. валериановый
159. Простой эфир, образованный при нагревании смеси пропилового и бутилового спиртов в присутствии концентрированной серной кислоты:
1. диэтиловый
2. этилпропиловый
3. этилбутиловый
4. пропилбутиловый
5. дибутиловый
160. Масса (г) простого эфира, образованного 30 г метилового спирта и 34,5 г этилового спирта:
1. 39
2. 45
3. 48
4. 52
5. 58
161. Объем этилена, который потребуется для получения этилового спирта массой 184 кг.(н.у.):
1. 89,6 м3
2. 112 м3
3. 123,2 м3
4. 134,4 м3
5. 145,6 м3
162. Сумма коэффициентов перед формулами исходных веществ в уравнении реакции горения 1 – пропанола :
1. пяти
2. шести
3. девяти
4. одиннадцати
5. двенадцати
163. Объем (л) пропилена при дегидратации 3,5 моля изопропилового спирта (н.у.)
1. 22,4
2. 44,8
3. 67,2
4. 78,4
5. 89,6
164. Дана схема превращений веществ:
С2Н4![]() Х
Х![]() С2Н5ОН
С2Н5ОН![]() С2Н5 – О – С2Н5,
определите вещество Х:
С2Н5 – О – С2Н5,
определите вещество Х:
1) ацетилен
2) хлорэтан
3) бромоводород
4) этилат натрия
5) пропанол
165. Дана схема превращений веществ:
СаСО3![]() СаС2
СаС2![]() С2Н2
С2Н2![]() Х
Х![]() С2Н5Cl, определите вещество Х:
С2Н5Cl, определите вещество Х:
1) этилен
2) этан
3) этиловый спирт
4) диэтиловый эфир
5) бромэтан
166. Для получения 217 гэтандиола потребуется дихлорэтан массой (г):
1. 155,8
2. 162,4
3. 194,7
4. 223,2
5. 346,5
167. Какой из перечисленных веществ при восстановлении образуют спирт (СН3)2СНСН2СН2ОН
1.пентаналь
2.2- метилбутаналь
3.3-метилбутаналь
4.бутаналь
5. 2-метилпентаналь
168. Изомеры предельного одноатомного спирта общей формулы С4Н10О являются:
1.только первичными спиртами;
2.первичными и вторичными спиртами;
3.первичными, вторичными и третичными спиртами,
4.первичными и третичными;
5.только вторичными спиртами.
169.Соединение имеет название:
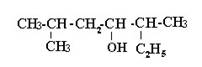
1.2, 5-диметилгептанол-4;
2. 3, 6-диметилгептанол-4;
3. 2-этил-5-метилгексанол-3;
4.3-метил-5-этилгептанол-3;
5.2, 3-диметилгептанол-4.
170. Масса этанола, которая расходуется для получения этилена, обесцвечивающего 150 г. 5% -ного раствора бромной воды:
1.6,16 г;
2.5,16 г;
3. 4,16 г;
4. 3,16 г;
5. 2,16 г.
171.Предельные одноатомные спирты не вступают в химическое взаимодействие с:
1.Na;
2.NaOH;
3.НCI;
4.СН3СООН;
5.SOCI2.
172.Присоединяя молекулу воды пропилен образует…:
1) Пропанол - 1;
2) пропан;
3) пропаналь;
4) пропанол - 2;
5) пропионовая кислота.
173.С каким из ниже приведенных спиртов взаимодействует Сu(OH)2:
1) СН3ОН;
2) С2Н5ОН;
3) СН3-СН(СН2)-СН2ОН;
4) СН2(ОН)-СН2(ОН);
5) СН3-СН2-СН2ОН.
174.Вещество 2-метилпентанол-3:
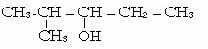
1.
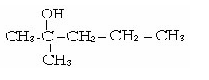
2.
3.
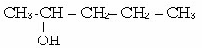
4.
![]()
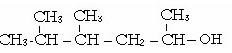
175. Возможные способы получения спиртов:
1)
СН3 – СН=СН2 + Н2О![]()
2)
СН ![]() СН + Н2О
СН + Н2О![]()
3)
СН3 – СОН + НСN![]()
4)
![]()
5)
СН3 – СОН + Н2О![]()
176. Способы получения спиртов
1) гидратация этиленовых углеводородов
2)гидрирование непредельных углеводородов
3) окисление моногалогенпроизводных
4) окисление альдегидов
5) гидролиз полисахаридов.
177. Из какого спирта можно получить 2-метилбутен – 2
1. диэтилкарбинола
2. 2-метил-пропанол –2
3. метил изопропил – карбинола
4. триметил-карбинола
5. изопропил – карбинола
178. При окислении первичных спиртов образуется:
1. кетон, карбоновая кислота
2. муравьиный альдегид
3. альдегид
4. альдегид, кетон
5. уксусный альдегид
179. При окислении третичных спиртов образуется:
1. кетон, карбоновая кислота
2. альдегид, кетон
3. муравьиный альдегид
4. уксусный альдегид
5. ацетон
180. К многоатомным спиртам относится:
1) этанол;
2) фенол;
3) глицерин;
4) бутанол
5) пентанол
181. Предельные одноатомные спирты имеют типы изомерии:
1) положения функциональной группы;
2) положение двойной связи;
3) цис-транс;
4) конформационную
5) оптическую.
182. Следующий ряд содержит соединения, расположенные в порядке возрастания их кислотности.
1) глицерин, фенол, вода;
2) этанол, вода, фенол;
3) фенол, этиленгликоль, метанол;
4) метанол, глицерин, этиленгликоль;
5) этиленгликоль, вода, этанол.
183. Качественный реагент на глицерин:
1) Br2;
2) Cu(OH)2;
3) FeCI3;
4) PBr3;
5) HNO3(H2SO4).
184. Можно получить простой эфир реакцией
1) ацетилен + Н2
2) этанол + этанол
3) метан + Cl2
4) этен + НОН
6) этанол + Na
185.Сумма коэффициентов уравнения полного сгорания алканола, который в составе имеет 60% углерода, 13,3 % водорода и 26,7 % кислорода
1. 4
2. 14
3. 25
4. 34
5. 44
186. Как называются вещества А,В,С в следующей цепи превращений:
этанол- -Н2SО4- -А- -t- -В- -Н2О- -С
1. этилен, этилсульфат, этиловый спирт
2. этилсульфат, этилен, этиловый спирт
3. этилсульфат, этилен, диэтиловый эфир, этанол
4.этилен,бутадиен,бутен
5. метан, метаналь, этанол
187. Соединение (СН3)3ССОСН3 подвергли восстановлению водородом, получили соединение:
1. 2,2,4,4 тетрометилпентанол-3
2. 1,1,4,4 тетрометилпентанол-3
3. 2,4 диметилпентанол-3
4. 2,4,4 триметилпентанол-3
5. 3,3 диметилбутанол-2
188. По следующему уравнению реакции: С4Н8Br2+КОН![]()
1. метанол
2. пентанол
3. бутанол
4. этанол
5. бутандиол
 Альдегиды и
кетоны
Альдегиды и
кетоны
189. Какой спирт должен быть окислен чтобы получился уксусный альдегид
1) метанол;
2) бутанол-1;
3) бутанол-2;
4) этанол;
5) пропанол-1.
190. Пропионовый альдегид - продукт окисления
1) Уксусной кислоты;
2) Пропионовой кислоты;
3) Пропанола-1;
4) Пропанола-2;
5) Пропионового альдегида.
191. Альдегид, формула которого приведена
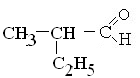 , называется
, называется
1) 2 – этилпропаналь
2) 2 – метилпропаналь
3) 2 – метилэтаналь
4)2 – метилбутаналь
5) пентаналь
192. Масса 1 литра муравьиного альдегида при нормальных условиях (г):
1) 1,34
2) 1,42
3) 1,56
4) 1,62
5) 1,84
193. При гидрировании альдегида продуктом реакции является:
1) спирт
2) карбоновая кислота
3) углеводород
4) простой эфир
5) сложный эфир
194. Определите спирт, который образуется при восстановлении масляного альдегида:
1) метанол
2) этанол
3) пропанол
4) бутанол
5) пентанол
195.
Во время реакции СН![]() СН
(2 моля) + Н2О
СН
(2 моля) + Н2О ![]()
![]() образуется альдегид массой (г):
образуется альдегид массой (г):
1) 47,7
2) 53,4
3) 58,0
4) 66,2
5) 88,0
196. Дана схема превращений
СН3
- СОН![]() С2Н5ОН
С2Н5ОН![]() Х
Х![]() СН
СН![]() СН
СН![]() СН3
– СОН, вещество Х:
СН3
– СОН, вещество Х:
1) этан
2) этилен
3) пропилен
4) метанол
5) формальдегид
197. При окислении 75 г формальдегида гидроксидом меди (II) образуется карбоновая кислота массой (г):
1) 92
2) 115
3) 119
4) 126
5) 133
198. Уксусный альдегид можно получить
1) дегидратацией спиртов
2) восстановлением кетонов
3) окислением вторичных спиртов
4) гидратацией ацетилена
5) гидратацией этилена
199. Качественная реакция отличающая альдегиды от кетонов
1) реакция Кучерова
2) изомеризация
3) серебряного зеркала
4) биуретовая
5) с перманганатом калия
200. Окисляется метанол в формальдегид:
1) хлором;
2) водородом ;
3) оксидом меди(II);
4) пероксидом водорода;
5) натрием.
201. СН4![]() С2Н2
С2Н2![]() ?
?![]() СН3СООН
К какому классу относится неизвестное вещество:
СН3СООН
К какому классу относится неизвестное вещество:
1) спирт;
2) эфир;
3) кислота;
4) альдегид;
5) кетон.
202. Соединение с общей формулой С5Н10О относится к классу альдегидов, число изомеров:
1) 4;
2) 5;
3) 7;
4) 3;
5) 2.
![]() 203. Из
перчисленных соединений –AgO;
Br2; H2; HCI
– выберите те, с которыми реагирует
203. Из
перчисленных соединений –AgO;
Br2; H2; HCI
– выберите те, с которыми реагирует
альдегид акролеин
1) Вr2;
2) HCI;
3) реагирует со всеми;
4) Ag2O;
5) H2.
204. Для получения 40% раствора формальдегида в 1 л воды необходимо растворить объем формальдегида (н.у.):
1) 400 мл;
2) 298, 7 л;
3) 497, 8 л;
4) 1000 мл;
5) 23 мл.
205. Формулы соответствуют соединениям А и В в схеме превращений
СН3СНО![]() А
А![]() В
В
1) С2Н6; С2Н5SO3H;
2) C2H5OH; C2H4;
3) C2H5OH; C2H5OC2H5;
4) C2H4; C2H5SO4;
5) C2H4OH; C2H6.
206. В трех пробирках находятся глицерин, формальдегид, этанол. Какое соединение из перечисленных необходимо добавить к содержимому пробирок для распознавания этих веществ:
1) Cu(OH)2;
2) Ag2O;
3) Na;
4) HCI;
5) H2SO4.
207.Идентифицируют альдегиды с помощью
1. КСN
2. NаNН2
3. NaHSO3
4.АgNO2
5. FeCl3
208.Фенолформальдегидные смолы образуются при конденсации фенола с:
1. СН3СООН
2. С2Н5ОН
3. СН2О
4.СН3СОСН3
5. С6Н5СНО
209.Реакция серебряного зеркала характерна для
1. СН3СООН
2. СН3СОН
3. СН3ОСН3
4. СН3СОСН3
5. СН3СН2СН3
210. Рассчитайте число моль альдегида, который получится из 112 л ацетилена реакцией
Кучерова при 100 % выходе от теоретически возможного:
1. 2;
2. 3;
3. 5;
4. 10;
5. 15.
211. При взаимодействии какого из указанных веществ с водой образуется пропанон
(кетон)?
1. Пропан;
2. Пропен;
3. Пропин;
4. Пропаналь;
5. Пропанол-2.
212. Уксусный альдегид образует оксинитрилс
1. NH3;
2. HCN;
3. HNO3;
4. HNO2;
5. C2H5OH.
213. Восстановлением альдегидов и кетонов получают:
1. Кислоты одно- и двухосновные;
2. Первичные и вторичные спирты;+
3. Одноатомные и двухатомные спирты;
4. Окси- и кетокислоты;
5. уксусную и пировиноградную кислоту
214. Реакция Кучерова
1. Метан + HNO3;
2. Пропадиен + H2O;
3. Этин + H2O;
4. Пропен + Cl2;
5. Этен + H2O;
215. Автор правила, соединение, содержащие ОН-группу при двойной связи, неустойчивы и
перегруппируются в более стабильные карбонильные производные.
1. М.Г. Кучеров;
2. Н.И. Зинин;
3. С.В. Лебедев;
4. В.В. Марковников;
5. А.М. Эльтеков.
216. Группа –СН=О характерна для ______”.
217. В схему реакции внесите формулу необходимого соединения
----- +Н2→ СН3СН2ОН:
218. При окислении уксусного альдегида гидроксидом меди (ІІ)
получается ______
219.Образуется кетон при окислении
1.Метанола;
2. Бутанола-1;
3. Бутанола-2;
4. Этанола;
5.Пропанола-1.
220. Вещество, полученные окислением пропанола – 2:
221.
Неизвестное вещество: СН4![]() С2Н2
С2Н2![]() ?
?![]() СН3СООН
СН3СООН
222.При прокаливании пропионата кальция образуется:
1. метилэтил кетон
2. ацетон
3. ацетохинон
4. диэтилкетон
5. гидрохинон
“Карбоновые кислоты”
223. Карбоновая кислота
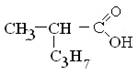 называется:
называется:
1) 2 – метилбутановая
2)2– пропилпропановая
3) 2 – этилпропановая
4) 2 – метилпентановая
5) гексановая
224. При взаимодействии бутанальовой кислоты с Ag2O образуется
1) бутандиаль
2) бутандиовая кислота
3) бутанон
4) бутен
5) бутаналь
225Кислота двухосновная:
1) уксусная;
2) пальмитиновая;
3) щавелевая;
4) валериановая;
5) оксивалериановая.
226. Дана схема превращений
СаС2![]() СН
СН![]() СН
СН![]() СН3 - СОН
СН3 - СОН![]() Х
Х![]()
![]() определите вещество Х:
определите вещество Х:
1) муравьиный альдегид
2) метиловый спирт
3) уксусная кислота
4) пропионовая кислота
5) этиловый эфир муравьиной кислоты
227.
Соединение образуется при хлорировании уксусной кислоты ![]()
![]()
![]()
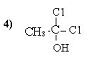
5) не одно из них.
228. Назвать вещество
![]()
1) 2-хлор-4-ол-бутановая кислота;
2) 2-хлор-4-ол-пентановая кислот
3) 2-хлор-4-ол-оксивалериановая кислота;
4) 4-хлор-2-оксивалериановая кислота;
5) 4-хлор-2-ол-пентановая кислота.
229. Обладает наиболее сильными кислотными свойствами:
1) Н-СООН;
2) С6Н5-ОН;
3) СН3СООН;
4) Н2СО3;
5) СН3СНО.
230. C помощью какого реактива можно различить олеиновую и стеариновую кислоты:
1) бромная вода;
2) метилоранж;
3) хлорид натрия;
4) Cu(OH)2;
5) Na.
231. Соответствуют соединениям А, В и С в схеме превращений:
уксусная
кислота![]() А
А![]() В
В![]() С
С
1) хлоруксуная кислота; метиловый эфир хлоруксусной кислоты; ацетат натрия;
2) хлорэтан; метил-этиловый эфир; этанол;
3) хлоруксусная кислота; пропановая кислота; пропионат натрия;
4) хлоруксусная кислота; 2-пропеновая кислота; пропанол;
5) хлорэтан; метиловый эфир хлоруксусной кислоты; этанол.
232. Соответствуют соединениям А, В и С в схеме превращений:
С2Н2![]() А
А![]() В
В![]() С
С
1) СН3СН2ОН; СН3СН2ОAg; CH3CH2ONa;
![]()
![]()
4) СН3СООН; СН3СН2ОН; СН3СН2ОAg;
5) СН3СН2ОAg; CH3CH2ONa; СН3СООNa
233. При взаимодействии 15 кг стеариновой кислоты с карбонатом натрия можно получить твердого мыла:
1) 15 кг;
2) 15, 5 кг;
3) 16, 2 кг;
4) 10, 2 кг;
5) 5, 4.
234. Карбоновые кислоты с общей формулой С5Н10О2 имеют изомеров:
1) 4;
2) 7;
3) 9;
4) 5;
5) 10
235. Первичных атомов углерода в молекуле 2,2-диметил – пропановой кислоты:
1. один
2. два
3. три
4. четыре
5. пять
236. Причина что хлоруксусная кислота более сильная, чем уксусная
1. –J (Сl)
2. +J (Сl)
3. –М (![]() )
)
4.+М (![]() )
)
5. +М
237.При прокаливании формиата кальция образуется:
1. щавелевая кислота
2. муравьиная кислота
3. муравьиный альдегид
4.уксусный алдьдегид
5. пропональ
238.В результате цепи превращения: пропаналь![]() А
А![]() В
В![]() С
С
последовательно образуется вещество:
1. ацетон, дихлорпропан, пропанон
2. пропионовая кислота, хлорангидридпропионовой кислоты, пропионат натрия
3. пропанон, 2,2 дихлорпропан, этан
4.пропанон, 2,2 дихлорпропан, ацетон
5. этанол, ацетон, пропионат натрия
239. Относится к высшим жирным кислотам:
1. уксусная;
2. масляная;
3. щавелевая;
4. валериановая;
5. линоленовая.
240. При взаимодействии 30 кг стеариновой кислоты с карбонатом натрия можно
получить твердого мыла:
241241 Вещество с наибольшим значением константы диссоциации:
242. Изомерами являются:
243. Органическое вещество, из глицерина и высших карбоновых кислот:
1. мочевина
2. углеводы
3. щавелевая кислота
4. уксусная кислота
5. жир
Кислородсодержащие органические вещества
Сложные эфиры
244. Относится к тиолам:
245. Сложные эфиры образуются в результате реакции:
246.Тристеарат (сложный эфир глицерина и стеариновой кислоты) относится к:
1. Твердым жирам;
2. Жидким жирам (маслам);
3. Синтетическим моющим средствам;
4. Фруктовым эфирам;
5. Маргаринам.
247.Металлического серебра выделится при взаимодействии 17,6 г ацетальдегида с оксидом серебра
248 . Масса сложного эфира, который образуется при взаимодействии 90 г уксусной кислоты с 32 г метанола
249. Уравнение реакции Кучерова:
250. При окислении уксусного альдегида гидроксидом меди (ІІ)
получается ______
251. Формула муравьиной кислоты.
5. НСНО.
252.Формула масляной (бутановой) кислоты:
1.НСООН
2. С2Н5СООН;
3. НООССН3;
4. С4Н9СООН;
5. НООССН2СН2СН3.
253. Муравьиная кислота проявляет свойства_________.
254. Схема R-СООН+НО- R1→ R-С-О- R1+Н2О отражает суть реакции_______
255. Необходимо для получения 3 моль этилуксусного эфира.
256. Выберите утверждение , неверно описывающее строение молекулы сложного эфира
R1- C ОO* – R2 (R1R2- углеводородные радикалы)
Данное вещество представляет собой продукт замещения
257. Содержится в пробирке, если в одной пробирке лакмус
приобрел красную окраску, а в остальных остался фиолетовым
5. Формальдегид.
258. Продукты взаимодействия глицерина и жирных кислот
называются ------------ .
1. Сложными эфирами;
2. Глицеридами;
3. Триглицеридами (относятся к жирам);
4. Эфирам;
5. Мыла.
259. Продукт взаимодействия этанола с уксусной кислотой относится к:
260. При гидролизе жиров в присутствии щелочей образуются --------
261.Получится при полном гидролизе 5 моль жира триолеина.
1. 5 моль глицерина и 15 моль олеиновой кислоты
2. 5 моль глицерина и 5 моль олеиновой кислоты+
3. 5 моль глицерина
4. 15 моль олеиновой кислоты
5. 3 моль глицерина
262. Восстанавливается водородом:
1. СН3СОН;
2. СН3ОСН3;
3. СН3СООН;
4. С2Н5ОН;
5. СН3СI.
263. Получают маргарин из
4. Предельных жиров при реакциях замещения
264. Спирт образующий жир
265. При взаимодействии 200 г 60 %-ного раствора уксусной кислоты с этиловым спиртом образовался сложный эфир массой
266. В схеме превращений вещество Х5
СН3 – СН2CI![]() Х1
Х1![]() Х2
Х2![]() Х3
Х3![]() Х4
Х4![]() Х5
Х5
1. этиловый эфир муравьиной кислоты
“Амины и нитросоединения”
267.Число первичных, вторичных, третичных аминов состава С4Н11N:
1) 4, 3, 1;
2) 3, 1, 4;
3) 4, 1, 3;
4) 3, 4, 1;
5) 4, 2, 2.
268. Получится при взаимодействии этиламина с НNО2
1) вода, этен
2) этан, азот
3) азотная кислота и этилен
4) спирт, азот, вода
5) этилен, азот, вода
269. При действии на амины хлороводорода образуется:
1) соль;
2) кислота;
3) эфир;
4) аминокислота;
5) амид.
270.Масса нитрометана необходимого для получения 6,2 г метиламина, с выходом 70%
1) 17,43 г;
2) 17,78 г;
3) 19,21 г
4) 18,12 г
5) 71,32 г.
271. Содержит функциональную группу –NH2:
1) нитроглицерин;
2) анилин;
3) формальдегид;
4) фенол;
5) метилэтилкетон.
272.Алифатические амины взаимодействуют с:
1) NaCI;
2) NaOH;
3) HCI;
4) Cu(OH)2;
5) CI2.
273. Сумма коэффициентов в левой части уравнения реакции горения этиламина:
1) 13;
2) 15;
3) 17;
4) 19;
5) 21.
274. Масса хлороводорода для получения 33,75 г солянокислого метиламина
1) 18,25 г;
2) 19,50 г;
3) 9, 48%;
4) 17,25 г;
5) 17,75 г.
275. Амин
получится в результате превращений СН3-СН2-ОН![]() А
А![]() Б
Б
1) метиламин;
2) этиламин;
3) пропиламин;
4) дибутиламин;
5) правильного ответа нет.
276.Индуктивный эффект – это:
1.электроны смещаются к более электроотрицательному атому
2.электроны отталкиваются от электроотрицательных атомов
3.ионы водорода (протоны) присоединяются к более электроотрицательному атому
4.кислородсодержащие вещества присоединяют молекулы воды
5.галогены уходят от молекул в виде ионов
277. Плотность паров вещества по водороду равна 22,5, а массовые доли: С=0,535, Н= 0,155, N = 0,312, это…
1) метиламин
2) этиламин
3) пропиламин
4) пентиламин
5) бутиламин.
278. Можно отличить амины (первичные, вторичные, третичные) с помощью
1) H2SO4
2) H2CO3
3) H2O
4) HCl
5) HNO2
279. В кислой среде нитросоединения восстанавливаются до:
1. нитрозосоединений
2. гидроксиламинов
3. оксимов
4. азосоединений
5. аминов
280. Аминами называются соединения, которые образуются при замещении:
1. гидроксила карбоксильной группы на аминогруппу
2. водорода аммиака на углеводородные радикалы
3. водорода радикала кислоты на аминогруппу
4. водорода в углеводороде на нитрогруппу
5. гидроксила на кетонную группу
281. Назовите следующее соединение СН3-NH-CH(CH3)-CH2-CH3:
1) диэтиламин;
2) метилизобутиламин;
3) N-метил-1-этиламин;
4) метилизопропиламин;
5) диметилэтиламин.
282. Для
реакции СН3NH2 + C2H5Br![]() CH3-NH-CH2-СН3 характерен механизм
реакции:
CH3-NH-CH2-СН3 характерен механизм
реакции:
1) SN1;
2) SN2;
3) AE;
4) SR;
5.E.
283. Для аминов алифатического ряда реагентом является
1.гидрозин
2.гидроксиламин
3.азотистая кислота
4.синильная кислота
5.семикарбазид
284.. Какое органическое соединение образуется при действии азотистой кислоты на этиламин:
а) этанол; б) метанол; в) этаналь; г) этановая кислота; д) пропанол
1. а, б, в, г, д
2. а
3. а,б
4. в
5. а,в,г
285. Какое соединение образуется в результате превращений:
С2Н2![]() X1
X1![]() X2
X2![]() X3
X3![]() A
A
1.этаналь
2. этанол
3. этановая кислота
4. 2-аминоэтановая кислота
5. пропаналь
286. Число изомерных аминов соответствует составу С4Н11N
1. 3
2. 2
3. 1
4. 5
5. 4
287. Большую основность имеет амин :
1) изобутиламин;
2) метилдиэтиламин;
3) диэтиламин;
4) гидроксид тетраметиламмония;
5) правильного ответа нет.
288. Способы получения нитросоединения:
1. Метод Вюрца
2. Метод Вильямсона
3. Метод Коновалова+
4. Реакция Кучерова
5. Реакция Шорыгина
289. Таутомерным превращениям склонны:
1. Первичные и третичные нитросоединения
2. Первичные нитросоединения
3. Вторичные нитросоединения
4. Вторичные и третичные нитросоединения
5. Первичные и вторичные нитросоединения
290. Первичные нитросоединения при действии азотистой кислоты переходят:
1. Нитрозонитросоединения
2. Нитроловые кислоты
3. Не взаимодействует
4. Диазосоединения
5. Гидроксиламин
291. Вторичные нитроалканы при действии азотистой кислоты переходят:
1. Нитроловые кислоты
2. Диазосоединения
3. Нитрозосоединения
4. Псевдонитролы
5. Гидроксиламины
292. Не относится к способу получения аминов:
293. В реакции ацилирования аминов вступают:
1. Только первичные амины
2. Только вторичные амины
3. Все амины
4. Первичные и третичные амины
5. Первичные и вторичные амины
«оксикислоты»
294. Вещество, имеющее формулу
![]()
295. Трехосновная оксикарбоновая кислота
1) молочная кислота
2) пировиноградная кислота
3) яблочная кислота
4) лимонная кислота
5) щавелевая кислота
СН3СО-СН2СООС2Н5
1) ![]() -оксипропионовая
кислота;
-оксипропионовая
кислота;
2) ![]() -оксимасляная
кислота;
-оксимасляная
кислота;
3) ![]() -оксимасляная
кислота
-оксимасляная
кислота
4) этиловый эфир ![]() -ацетоуксусной кислоты;
-ацетоуксусной кислоты;
5) ![]() -оксимасляная
кислота.
-оксимасляная
кислота.
297. При
нагревании ![]() -оксикислоты образуется:
-оксикислоты образуется:
1) лактиды;
2) непредельные углеводороды;
3) лактоны;
4) ![]() -оксикислота;
-оксикислота;![]()
5)![]() -оксикислота.
-оксикислота.
298. Вещество, полученное на 1 стадии:
![]()
1)![]() -оксимасляная
кислота;
-оксимасляная
кислота;
2) ![]() -оксимасляная
кислота;
-оксимасляная
кислота;
3) 4-оксибутановая кислота;
4) 2-оксибутановая кислота;
5) ![]() -оксимасляная
кислота.
-оксимасляная
кислота.
299.
Молочная кислота образуется при реакции: С6Н12О6![]() 2СН3 - СН(ОН) – СООН.
Масса
2СН3 - СН(ОН) – СООН.
Масса
молочной кислоты (г), если брожению подверглось 0,6 моль глюкозы:
1. 108
2. 112
3. 116
4. 135
5. 137
300. Назовите соединение
СН3СНО ![]()
1. молочная кислота
2. уксусная кислота
3. циангидрин ацетальдегида
4. ацетон
5. масляная кислота
301. Назовите соединение
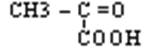
1. пировиноградная кислота
2. молочная кислота
3. пропановая кислота
4. пропанон
5. масляная кислота
302. Реагирует пировиноградная кислота
1. С6Н5 - NHNH2, NaHSO3, HCN
2. только С6Н5NHNH2
3. только NaHSO3
4. только HCN
5. NaHSO3, КCN
303. Кетокислота СН3 – СОCl![]()
1. пировиноградная кислота
2.
![]() -
кето – масляная кислота
-
кето – масляная кислота
3.
![]() -
кето – масляная кислота
-
кето – масляная кислота
4. молочная кислота
5. пентанон – 2 – овая кислота
«Элементорганические соединения»
304. При реакции изопропилмагнийиодида с ацетальдегидом образуется
1. бутанол –1
2. 3-метилбутанол –2
3. пентаналь
4. бутанон –2
5. масляная кислота
305. При реакции 2 – бром – 2 – метилбутана с магнием в абсолютном эфире и последующим действием воды образуется
1. 2- метилбутан
2. бутилбромид
3. бутан
4. пентан
5. 3- метилбутан
306. К металлоорганическим соединениям относится
1. н – С4Н9Li (C2H5)2Zn
6. CH3CООNа, (СН3)4 Pb
7. CH3COOK, (C2H5)2Zn
8. CH3CH2Na, CH3COOK
9. CH3COOK, н – С4Н9Li
307. Реактив Гриньяра
1. СН3 - СН2 – СН2 – Cl
2. СН3 - СН2 – СН2 – Br
3. СН3 - СН2 – СН2 – MgBr
4. (CH3)2Zn
5. (C2H5)4Pb
308. Для получения метилмагнийиодида применяют растворитель
1. гексан
2. вода
3. спирт
4. бензол
5. диэтиловый эфир+
309. Полученное соединение:
СН3
- С![]() СН
СН ![]()
1. 2- метил – 2 бром- пропан
2. 2-метил – 1 бром – пропан
3. 2 - бром - пропанол –2
4. 2 – бром – пропанол – 1
5. изопропилбромид
310. Тип реакции глицина и соляной кислоты
1. соединение
2. разложение
3. замещение
4. обмен
5. этерификация
311. Нитропропан и аланин – это…
1. структурные изомеры
2. геометрические изомеры
3. оптические изомеры
4. межклассовые изомеры
5. ближайшие гомологи
312. Двойственность аминокислот проявляется за счет групп…
1. карбоксил и карбонил
2. карбонил и гидроксил
3. карбонил и амино
4. амино и карбоксил
5. амино и гидроксил
313. Число и последовательность аминокислотных остатков в полипептидной цепи –
1. первичная структура белка
2. вторичная структура белка
3. третичная структура белка
4. четвертичная структура белка
5. все вышеуказанные структуры белка
314. Вещества В и Е в следующей схеме.
Этан
![]() .
.
1. уксусная кислота, дипептид
2. этаналь, этиловый эфир аланина
3. ацетальдегид, глицилаланин
4. этаналь, солянокислый аланин
5. метан, аланин
315. Масса едкого натра, необходимого для нейтрализации 0,01 моля аминоуксусной кислоты, равна
1. 0,8 г
2. 0,4 г
3. 1,4 г
4. 2,5 г
5. 3,2 г
316.Название вещества СН3 – С (СН3)2 – СН(NH2)-CН2-СН2-СООН
1. ![]()
2. ![]()
3. ![]()
4. ![]()
5. ![]()
317.
Скручивание полипептидной цепи за счет водородных связей между О=С- N-Н группами в ![]() -
спирали:
-
спирали:
1. первичная структура белка
2. вторичная структура белка
3. третичная структура белка
4. четвертичная структура белка
5. все вышеуказанные структуры белка
318. Биуретовая реакция белка -
1. желтой окраски при взаимодействии с азотной кислотой
2. белой окраски при взаимодействии с соляной кислотой
3. синей окраски при взаимодействии с фосфорной кислотой
4. черной окраски при взаимодействии с ацетатом свинца
5. фиолетовой окраски при взаимодействии с сульфатом меди (II) в присутствии щел+
319.
![]() -аминокислоты при нагревании
образуют
-аминокислоты при нагревании
образуют
1.аммонийную соль непредельной кислоты
2.дикетопиперазины
3.лактамы
4.лактоны
5.спирты
320. Аминокислоте соответствует следующая формула:
1. СН3- СН2-СН2-NH2
2. CH3-CH2-CH(NH2)-CH3
3. CH3-CH(NH2)-COOH
4. CH3-CH2-CONH2
5. CH2OH-CONH2
321.
Формула ![]() -аминокислоты
-аминокислоты
1. NH2-CH2-COOH
2. NH2-CH2-CH2-CH2-COOH
3. NH2-(CH2)6-COOH
4. CH3-CH2-CH(NH2)-COOH
5. CH3-CH(NH2)-CH2-COOH
322. Дать название по рациональной номенклатуре СН2=СН-Сl:
1) хлористый винил;
2) хлористый аллил;
3) хлористый этил;
4) этилен;
5) хлористый этилен
323. Изомерия непредельных альдегидов обусловлена:
1) наличием СОН группы и близко расположенной двойной связи в соединении;
2) наличием СОН группы;
3) наличием двойной связи;
4) наличием –ОН группы;
5) наличием –С=О группы.
324 Виниловый спирт изомеризуется:
1) в альдегид;
2) в кетон;
3) либо в альдегид, либо в кетон;
4) в аллиловый спирт;
5) в пропаргиловый спирт.
325. Указать
продукты реакции: СН2=СН-ОС2Н5![]() ?
?
А) СН2ОН-СН2ОН+С2Н5ОН;
В) СН3-СОС2Н5;
С) СН3-СОН+С2Н5ОН;
D) СН3-СОН;
Е) С2Н5ОН.
326. Изомерия непредельных карбоновых кислот зависит:
1) только от положения углеродного скелета;
2) только от положения двойной связи;
3) от изомерии углеродного скелета и положение двойной связи по отношению к карбоксильной группе;
4) от положения –ОН группы;
5) от положения –С=О группы.
327.
Указать Х: СН2=СН-СООН![]() СН3-СН2-СООН
СН3-СН2-СООН
1) Н2О;
2) Н2;
3) HCl;
4) O2;
5) {O}.
328.
Указать вещество А: НОСН2-СН2CN ![]() А
А
1) СН3-СН2-СН=СН-СООН;
2) СН2=СН-СН2-СН2-СООН;
3) НОСН2-СН2-СООН;
4) СН2=СН-СООН;
5) СН3-СН2-СООН.
329.
Указать Х : СН2Cl-CH=CH2![]() СН2Cl-СНОН-СН2Cl
СН2Cl-СНОН-СН2Cl
1) Н2,Cl;
2) HCl;
3) Cl2;
4) HClO;
5) Н2О.
330 Общая формула непредельных карбоновых кислот:
1) CnH2n-1COOH;
2) CnH2nCOOH;
3) CnH2n-2COOH;
4) CnH2n+1COOH;
5) CnH2n+2 COOH.
331. Вещество В по схеме реакции:
HOCH2
– CH2CN ![]() A
A ![]() B
B
1. CH3 – CH2 –COOH;
2. HOCH2 – CH2 – CH2 – COOH;
3. CH2 = CH – COOH;
4. CH2 = CH – CH2 – COOH;
5. (CH3)2 – CH2 – COOH
332.Вещество Х:
(СН3)2
– С = СН –СО –СН3![]() (СН3)2 – СН –
СН2–СО –СН3:
(СН3)2 – СН –
СН2–СО –СН3:
1. О2;
2. Н2, Pt;+
3. Н2О;
4. ![]() ;
;
5. Н2SO4
332. Для α, β – ненасыщенных альдегидов характерно прохождение реакции:
1. по карбонильной группе;
2. по карбоксильной группе;
3. по гидроксильной группе;
4. реакции с разрывом двойной связи;
5. реакции полимеризации.
333. Вещество А, образующееся по реакции
СН2 = СН – СН2 –Сl ![]() A
A ![]() B:
B:
1. CH3 - CH2 – CH2Cl;
2. CH3 - CH =CHCl;
3. CH3- CH = CH – CH2Cl;
4. CH2 = CH - CHCl2;
5. CH2 = CH – CCl3.
335. ВеществоВ, образующеесяпореакции
СН2 = СН – СН2 –Сl ![]() A
A ![]() B:
B:
1.CH2 = CH –CH2 – CCl3;
2.CH2 = CH –CH2 – CCl2;
3.CH2 = CH – CCl3;
4.CH2 = CH - CCl3;
5.CH2 = CH –CH2 – CH2Cl.
336. Для молекулы СnH2n с атомами углерода расположенные вдоль одной цепи:
I. Обесцвечивает бромную воду
II. Является изомером циклоалкана с n количеством атомов углерода
III. Имеет две двойные связи
Какие из этих утверждений точны?
А) Только I
В) Только II
С) Только III
D) I – II
Е) II – III
337. Некоторые алкен и алкин являются изомерами. Согласно этому:
I. Алкен может содержать две двойные связи
II. Алкен может содержать цикло строение
III. Алкин должен иметь цикл
Какие из этих утверждений верны?
А) Только I
В) Только II
С) I – II
D) I – III
Е) II – III
![]() 338. I. HC ≡ C –
CH3+ HBr X
338. I. HC ≡ C –
CH3+ HBr X
![]() II. X +HBr Y
II. X +HBr Y
ФормулыХиУ
X Y
А) H2C = CBr – CH3 BrH2C – CHBr – CH3
В) H2C = CBr – CH3 H3C – CHBr – CH3
С) H2C = CH – CH2Br Br2HC – CH2 – CH3
D) H2C = CBr – CH3 Br2HC – CH2 – CH3
Е) H2C = CBr – CH3 H3C – CBr2 – CH3
339. В результате реакции Вюрца 1 – бром пропана образуется
1) пропан
2) гексан
3) 2,3 – диметил бутан
4) 2,3 – диметилгексан
5) 2 – метил пентан
340.Вещество Х:
СН2ОН
– СН = СН2![]() СН2ОН –СНОН –СН2ОН
СН2ОН –СНОН –СН2ОН
1.Н2О2;
2.Н2;
3. Н2О;
4.О2;
5.Н2SO4.
341. Трехатомные спирты
1. триолы;
2.пентиды;
3.гликоли;
4.гексиды;
5.диолы.
342. По
международной номенклатуре предельные двухосновные спирты
1. триолы;
2. алкандиолы;
3.алкантриолы;
4.пентиты;
5.гекситы.
343. Этиленгликоль дает качественную реакцию
1.HCl;
2.Cu(OH)2;
3. H2O;
4. H2SO4;
5. AgNO3.
344. Этиленгликоль в технике используют как заменитель в виде водного раствора:
1. этилового спирта;
2. антифриза – жидкости, имеющей низкую температуру замерзания;+
3. пропаргиловый спирт;
4. уксусной кислоты;
5. аммиака.
345.Глицерин впервые был выделен
1. Марковниковым;
2. Вильямсом;
3. Шееле;
4. Фишером;
5. Менделеевым.
346.Глицерин используют для производства
1. взрывчатых веществ;
2. моющих средств;
3. жиров;
4. маргарина;
5. крахмала.
347. Называют двухатомные спирты
1. гликолями;
2. диолами;
3. гексадиолами;
4. триолами;
5. тетраолами.
348. Формула глицерина:
1. СН2ОН-СН2ОН;
2. СН2ОН-СНОН-СН2ОН;
3. СНОН=СНОН;
4. СН2ОН-СНОH-СН2-СН3;
5. СН2ОН-СНОН-СН2-NO2.
349 К многоатомным спиртам не относятся:
1. этиленгликоль;
2. фенол;
3. глицерин;
4. тертраты;
5. пертраты.
350. В двух пробирках находятся растворы фенола и глицерина, различают их с помощью:
1. металлический натрий;
2. раствор NaOH;
3. раствор Сu(OH)2;
4. HJ;
5. H2.
351. Формула этиленгликоля:
1. СH2(OH) – CH(OH) – CH2 –CH3;
2. СH2(OH) – CH(OH) – CH2OH;
3. СH2(OH) – CH2(OH) ;
4. СH2(OH) – CH(CH3) – CH2;
5. СH2(OH) – CH(OH) – CH2(OH).
352. Глицерин не реагирует с:
1. натрием;
2. оксидом углерода(I I);
3.азотной кислотой;
4.гидроксидом меди;
5.раствором NaOH.
353 Соединение по рациональной номенклатуре HCO-CH2-COH:
1. глиоксаль;
2. диацетил;
3. 2,4-пентандион;
4. 1 -кетон;
5. малоновый альдегид.
354. Укажите продукты реакции:
СН3-СО-СН2-СО-СН3![]()
1. СН3-СHОН-СН2-СН3;
2.СН3-СHОН-СН2-СОН-СН3;
3. СН3-СО-СН3 + Н2О;
4. СН3-СООNa + СН3-СО-СН3;
5. СН3-СООН
355 При осторожном окислении этиленгликоля в кислороде воздуха в присутствии медного катализатора образуется:
СН2ОН
– СН2ОН ![]() 2Н2О + Х2
2Н2О + Х2
1. глиоксим;
2. глиоксаль;
3. гликолевая кислота;
4. диметилглиоксим;
5.монооксим глиоксаля.
356 Назовите вещество А:
СН2=СН-СН=СН2![]() Х1
Х1 ![]() Х2
Х2![]() А
А
1. этилендиамин;
2. пропилендиамин;
3. триметилдиамин;
4. гексаметилендиамин;
5. найлон.
357. Вещество, имеющее формулу:
NH2-CH2-CH2-CH2-NH2
1.1,2-диаминоэтан;
2. 1,3-диаминопропан;
3. 1,2-диаминобутан;
4. 1,2-пропандиамин;
5. 1,2-диаминопропан
358. Вещество, имеющее формулу:
H2N-CH2-CH(CH3)-NH2
1. 1,2-диаминоэтан;
2. 1,3-диаминопропан;
3. 1,2-диаминобутан;
4. 1,2-пропандиамин;
5. 1,2-диаминопропан
359. В промышленности получают гексаметилендиаминиз
1. уксусной кислоты;
2. адипиновой кислоты;
3. спиртов;
4. каприловой кислоты;
5. лауриновой кислоты
360 Соединение по международной номенклатуре:
H2N-CH2-(CH2)4-CH2-NH2
1. пропилендиамин;
2. 1,6-пропандиамин;
3. этилендиамин;
4. 1,6-гександиамин;
5. 1,3-гександиамин
361. Укажите продукты реакции дегидратации бутандиола?
CH2(OH)-CH2-CH2-CH2(OH)
![]()
1. CH2=CH-CH=CH2;
2. CH3-CH2-CH2-CH3;
3. CH2OH-CHOH-CH2OH;
4. CH2OH-CH2-CH2-CH3;
5. CH2 = CH-CH2-CH2-CH2-CH3.
362 Путём поликонденсации адипиновой кислоты с гексаметилендиамином получают:
1. амины;
2. полиамиды;
3. диамины;
4. дикетоны;
5. диаминоспирты.
363. Применяют полиамиды для получения:
1. красок;
2. маргарина;
3. найлона;
4. клея;
5. взрывчатых веществ
364 Тривиальное название соединения:
CH2(NH2)-CH2-CH2-CH2(NH2)
1. путресцин;
2. кадаверин;
3. амин;
4. гексаметилдиамин;
5. бутан-втор-амин.
365.
Формула ![]() -оксикислоты
-оксикислоты
1.H2N-C(O)-CH2-CH2-COOH;
2. CH3-CH2-CH(OH)-COOH;
3. H2N-СН2COOH;
4. H2N-C(O)-OCH2CH3;
5.CH3-C(O)-NH-CO-NH.
366. Карбоновые кислоты теряют карбоксильную группу при
1.дегидратаций;
2.гидратаций;
3. декарбоксилирований;
4.омыления;
5. гидролиза.
367. Адипиновая кислота используется как заменитель
1. молочной;
2. бензойной;
3. лимонной и винной;
4. стеариновой;
5. винной.
368. Относятся фумаровая и малеиновая кислоты
1. геометрическим изомерам;
2. гомологам;
3. галогенопроизводным соединениям;
4. спиртам;
5. стериоизомерам.
369.Фумаровая кислота является транс-изомером
1. бутандиовой;
2. малеиновой;
3. глутаровой;
4. адипиновой;
5.пробковой
370. Малеиновая кислота является цис-изомером
1. пробковой;
2. адипиновой;
3. глутаровой;
4. фумаровой;
5. уксусной.
371 Малеиновая и фумаровая кислоты имеют:
1. одну двойную связь;
2. одну тройную связь;
3. две двойные связи;
4. одинарные связи и одну
тройную;
5. две тройные связи.
372
Качественная реакция на фумаровая и малеиновая кислоты:
1. выпадение осадка;
2. выделение газа;
3. обесцвечивание бромной воды и раствора перманганата калия;
4. раствор приобретает синюю
окраску;
5. раствор приобретает зеленую окраску.
373. Малеиновая кислота образуется при нагревании кислот:
1.щавелевой
2. Яблочной;
3. лимонной;
4.молочной;
5.виноградной.
374.
Малеиновую кислоту
получают окислением кислородом воздуха:
1. спирта;
2. кетона;
3. бензола;
4. фенола;
5. альдегида.
375. Вещество Х2 в превращений:
β-оксимаслянная
кислота ![]() Х1
Х1![]() Х2:
Х2:
1. СН3-СН(ONa)-CН2-СООNa;
2. СН3-СНОН-СН2-СООNa;
3. СН3-(СНОNa)2-COONa;
4. СН3-СН(ОН)2-СООNa;
5.СН2(ОNа)-СН2-СН2-СООNа.
376. Вещество Х1
СН3-СНОН-СООН![]() Х1:
Х1:
1. СН3-СНCl-СООН и Н2О;
2. СН3-СНCl-СО-ОСН3
3. СН3-СНОН-СО- Cl.
4. СН3-СН(ОСН3) –СООН и NaCl;
5. СН3-СН(ОСН3)-СОCl и NaOH
377. Продукт окисления оксикислоты:
СН3-СНОН-СН2-СООН![]()
1. пропанол-2, СО2,Cu;
2. ацетон, СО2, Н2О,Cu;
3. СН3-СО-СН2-СООН, Н2О, Cu;
4. НСООН, НООС- СН2-СООН, Н2О, Cu;
5. СН3-СООН, Cu.
378. Продукты дегидрирования оксикислоты:
СН3-СНОН-СН2-СООН![]()
1. пропанол-2, СО2,Cu;
2. ацетон, СО2, Н2О,Cu;
3.СН3-СО-СН2-СООН, Н2О, Cu;
4. НСООН, НООС- СН2-СООН, Н2О, Cu;
5. СН3-СООН, Cu.
379.:Назовите вещество
СН3-СО-СН2-СООН:
1. 2-кетопентановая кислота;
2. ацетоуксусная кислота
3. молочная кислота
4.пировиноградная кислота
5.яблочная кислота
380. Назовите соединение
О
//
СН2 – С
| \
| О
| /
CH2 – С
\\
О
1. янтарный ангидрид;
2. имид янтарной кислоты;
3. глутаровый альдегид;
4. альдегид уксусной кислоты;
5. кетон.
381. Назовите соединение, имеющее формулу:
НООС Н
\ /
C = С
/ \
H СООН
1. фумаровая кислота;
2. малеиновая кислота;
3. глутаровая кислота;
4. янтарная кислота;
5. щавелевая кислота.
382. Назовите соединение:
НООС СООН
\ /
C = С
/ \
H Н
1. фумаровая кислота;
2. малеиновая кислота;
3. глутаровая кислота;
4. янтарная кислота;
5. щавелевая кислота.
383.Акриловая кислота
1. CH3 – CO –COOH;
2. HO – CO – OH;
CH3
|
3. HO –CH2 – CH – COOH;
4. CH2 = CH – COOH;
5. CHCl2 – CO – COОН.
384Образуется пировиноградная кислота
1. CH2OH – CO – C2H5
+ O2![]() X1.
X1.
2. СН3 – СН(СН3)
– СН2 – СООН + CuO![]() X1
X1
3. Cl CH2 –
CH2 –CHO + KCN ![]() X1
X1![]() X2;
X2;
4. CH3
– CH(CH3) – CHO + HCN ![]() X1
X1![]() X2;
X2;
5.СН3 – СОСl + KCN![]() X1
X1![]() X2;
X2;
385. Образуется при нагревании данного вещества кислота
O
/ \
H2C C = O
| |
H2C C H2
\ /
C-ОН
|
CH3
1. 3 – гидрокси – 3 – метилпентановая;
2. 5 – гидрокси – 4- метилпентановая;
3. 2 – гидрокси – 3 – метилпентановая;
4. 5 – гидрокси – 3 – метилпентановая ;
5. 4 – гидрокси – 3 – метилпентановая
386 Название вещества:
СН3-СН(О-СОСН3)-СООСН3
1. ![]() -оксипропионовая
кислота;
-оксипропионовая
кислота;
2. γ-оксимасляная;
3. ![]() -оксимасляная;
-оксимасляная;
4. метиловый эфир α-ацетопропионовой кислоты;
5. метиловый эфир β-пропионовой кислоты
387. При нагревании γ-оксикислоты какое из веществ образуется:
1. лактиды;
2. непредельные углеводороды;
3. лактоны;
4. β-оксикислоты;
5. α-оксикислоты.
388. Назовите вещество, полученное на первой стадии:
СН3-СН(СI)-СН2-СООН ![]() СН3-СН(ОН)-СН2-СООН
СН3-СН(ОН)-СН2-СООН
![]() СН3-СН=СН-СООН
СН3-СН=СН-СООН ![]()
СН3-СН(Вr)-СН(Вr)-СООН
1. α-оксимасляная кислота;
2. β-оксимасляная кислота;
3. 4-оксибутановая кислота;
4. 3-оксибутановая кислота;
5. γ-оксимасляная кислота.
389. Выберите формулу аминокислоты:
1. H2N-C(O)-CH2-CH2-COOH;
2. СН3-СН2-СН(ОН)-СООН;
3. H2N-СН2COOH;
4. H2N-C(O)-OCH2CH3;
5. CH3-C(O)-NH-CO-NH2.
390. Укажите химическую формулу амида::
1.H2N-C(O)-CH2-CH2-COOH;
2. СН3-СН2-СН(ОН)-СООН;
3.СН3-СН2 CO NH2;
4. H2N-C(O)-OCH2CH3;
5. CH3-C(O)-NH-CO-NH2.
391. γ-аминокислоты при нагревании образуют
1.дикетопиперазины
2. отщепляют аммиак
3.лактамы
4.лактиды
5.лактоны
392. К комплексонам относится
1.диаминокапроновая кислота
2.аминоуксусная кислота
3.нитрилтриуксусная кислота
4.цистин
5.аминоянтарная кислота
393 К одноосновным аминокислотам не относятся:
1. триптофан;
2. фенилаланин;
3. изолейцин;
4. цистин;
5. аспарагиновая кислота.
394 Двухосновная аминокислота:
1. триптофан;
2. фенилаланин;
3. саркозин;
4. аланин;
5.аспарагиновая кислота+
395. Производные аланина:
1. саркозин;
2. фенилаланин;
3.серин;
4. триптофан;
5. лизин.
396. Данная аминокислота по номенклатуре ИЮПАК:
H2N-(CH2)4-CH(NH2)-COOH
1.2,6-диаминогексановая кислота;
2. 2,5-диаминокапроновая кислота;
3. 2,3-диаминокапроновая кислота;
4.1-карбокси-1,5-диаминопентан;
5. 2,5-диаминогексановая кислота
397. Затвердевание жиров зависит:
1. от количества предельных кислот;
2. от расположения двойной связи;
3. от количества непредельных кислот;
4. от разветвления цепи;
5. от количества углеродных атомов.
398. Жиры –:
1. cложные эфиры;
2. производные кислот;
3. сложные эфиры глицерина и высших жирных кислот;
4. простые эфиры;
5. высшие жирные кислоты.
399. Горение жира – это реакция:
1. разложения ;
2. окисления;
3. гидролиза;
4. конденсации;
5. димеризации.
400. Твердые жиры получают из жидких с помощью реакции
1. гидрирования;
2. гидратации;
3. конденсации;
4. охлаждения;
5. димеризации.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.