
Органикалық заттардың қышқылдық және негіздік қасиеттері
Жоспары:
1.Қышқылды негізді өзара әрекеттесулер, жаңа қышқылдар мен жаңа негіздердің түзілуі
2. Реагенттердің жіктелуі және органикалық реакция типтері
3.Органикалық қосылыстарды физикалық әдістермен зерттеу
Бүгінгі күнде заттардың қышқылдылығы және негізділігі деген мәселеде екі түрлі ғылыми тұжырым бар. Оның біріншісі Бернстед-Лоуридің қышқыл және негізге берген анықтамасы, ал екіншісі Льюйстің осы үғымдарға берген ережесі.
Бернстед-Лоури бойынша: қышқылдар дегеніміз езінің молекулалық қүрамынан протонды бөліп шығарып, оны басқа затқа бере алатын заттар, ал негіз-дер — керісіпше, протонды өзіне қосып алатын заттар.
Бернстед-Лоури бойынша органикалық заттардын, қышқылдылығы, оларды судың негіздік қасиеттерімен салыстырып барып анықталады. Басқаша айтқанда Бернстед-Лоури бойынша қышқылдың күші оның протонды беру қабілетіне, ал негіздің күші — оныц протонды ұстап тұруға ұмтылуына байланысты болады. Мына төмендегідей мысалдарды қарастырып өтейік.
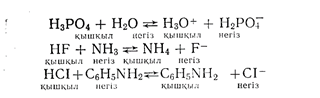
Бұл көрсетілген мысалдардан байқайтынымыз, ортофосфор қышқылын суда еріткенде Н3РО4 өзінің құрамынан бір протонын негізге (Н2О) беріп жібереді. Соның нәтижесіндс Н3О+ жаңа қышқылы және Н2РО4 жаңа негізі пайда болады. Сол сияқты фторсутек аммиакпен әрекеттескенде өз құрамындағы протонын негізге беріп жіберуінің салдарынан реакциялық ортада жаңа қышқыл және жаңа негіз түзіледі. Дәл осындай жағдай хлорсутек анилинмен рсакцияға түскенде де байқалады.
Жаңадан түзілген қышқылдар және негіздер, реакцияға түсетін өздері сияқтықышқылдар және негіздермен салыстырғанда әлде қайда әлсіз болады.
Сонымен ортофосфор қышқылы, фторсутек және хлорсутек күшті қышқылдар болып табылады. Себебі олар өз қүрамдарынан протондарын басқа затқа тез беріп жібереді; керісінше Н2РО4", Ғ~ және С1~ иондары міндетті түрде әлсіз негіздер болуы қажет. Себебі олар өз қүрамдарында протонды ұстап тұруға бейімділігі жоқ. Сондықтан да осы көрсетілген реакциялардың бар-лығында да тепе-теңдік неғұрлым әлсіз қышқыл мен неғұрлым әлсіз негіз түзілетін жаққа қарай ығысқан.
Егер ортофосфор қышқылының судағы ерітіндісін кез келген металдың гидроксидінің ерітіндісімен араластырып жіберетін болсақ, онда қышқыл Н3О+ (гидроксоний ионы) өзінің протонын металл гидроксидіндегі (ОН негізіне) беріп жібереді де, жана Н2О қышқылы және жаңа Н2О негізі пайда болады:
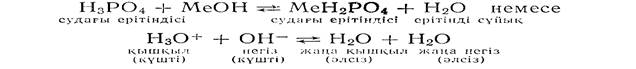
NН4Ғ-дың судағы ерітіндісін кез келген МеОН пен араластырып жіберетін болсақ, онда да жоғарыда көрсетілгендей реакция жүреді: қышқыл NН4+ (аммоний ионы) өзінен бір протонды ОН~ негізіне беріп жібереді де, реакция нәтижесінде жаңа қышқыл Н20 және жаңа негіз NН3 түзіледі:

Себебі, барлық жағдайларда да қышқыл мен негіз әрекеттесіп, нейтралдану реакциясы жүріп тұр Сонымен қатар, барлық жоғарыда көрсетілген реакцияларда, күшті негіз ОН-(гидроксил-ионы) протонды өзіне тартып қосып алады да, әлсіз қышқылдық қасиет к-рсететін су молекуласын түзіп отырады.
Егер біз мысалымыздағы қышқылдарды күштсріне сәйкес бір қатарға үдемелете өсіріп орналастыратын болсақ, онда реакциялар кезінде жаңадан пайда болатын негіздердің күші кері бағытта өзгереді. Қышқылдардың күштерінің өсуі:
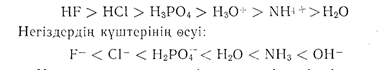
Молекуласындағы оттегі, азот, күкірт, фосфор және т. б. орбитасында электроны мол атомдары бар көптеген органикалық заттар, су сияқты негіздік қасиет көрсете алады, яғни өзіне протонды қосып алады. Мысалы: спирттер, жай эфирлер эпоксидтер, альдегидтер, кетондар, аминдер және т. б.
Реагенттердің жіктелуі және органикалық реакция типтері:
Барлық заттар өздерінің химиялық реакциялар кезінде әрекеттесетін басқа бір затқа тигізетін әсеріне қарай, басқаша айтқанда, реакция кезінде қышқыл немесе негіз ретінде әрекет жасауына сәйкес үлкен екі топқа:
а) электрофильдер және
ә) нуклеофильдер деп белінеді.
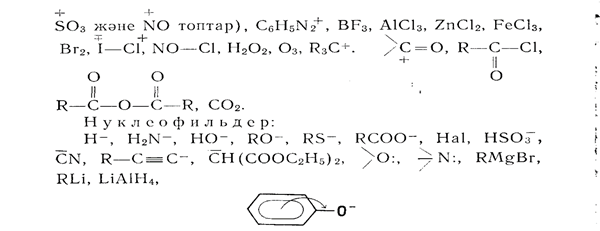
Электрофильдер — Льюис анықтамасы бойынша қышқылдық қасиетін көрсетстін электрон дефицитті заттар, ал нуклеофильдер — керісінше, орбитасында бос электрондары бар негіздік қасиет көрсететін заттар.
Егер химиялық рсакция электрофильдердің басқа бір молекуланы шабуылдауы нәтижесінде жүрсе, ондай реакцияларды электрофильді реакциялар деп, ал егер реакция нуклеофильді реагенттердің шабуылымен жүретін болса, ондай реакцияларды н у к л е о фильді реакциялар деп атайды.
![]()
Электрофильдік және нуклефильдік реакциялардан басқа бос радикалдардың қатысуымен жүретін реакциялардың да органикалық заттар арасында көп тарағанын айта кету қажет. Бұл реакциялардың бір-бірінен айырмашылығы мынада: электрофильді және нуклеофильді реакциялар электрон бұлттарының тығыздығының молекулалар құрамындағы аз ғана өзгерістерінің өзіне өте сезімтал, ал радикалдар арқылы жүретін реакциялардың жүру барысына электрон бүлттарының тығыздығының молекуладағы өзгерістері аса әсер ете қоймайды. Бұл реакциялардың жүруіне ,жылдамдығына және т. б. факторларына — радикалдардың реакцияға өте тез түскіштік қасиеттері әсср етеді.
іБүгінде органикалық заттардың түсетін реакцияларының төрт типі бар деп қарастырылады:
1. Орын басу реакциялары. Мұнда атом немесе атомдар топтарының орнын басқа атомдар басады.
Мысалы: С2Н5СІ + ОН- → С2Н5ОН + СІ-
хлорэтан гидроксид этанол хлорид
ионы ионы
2. Қосылу реакциялары. Екі молекула қосылып, бір молекула түзеді.
Мысалы: СН2= CН2 + Вг2 → ВгCН2CН2Вг
этилен бром 1,2-дибромэтан
3. Бөліну (элимирлену) реакциясы. Молекула екі немесе одан да көп басқа молекула түзеді.
Мысалы: С2Н5ОН → СН2= CН2 + Н2О
этанол этилен су
4. Қайта топтасу. Бір молекула екінші молекулаға айналады.
Мысалы: СН3 – СН – СН = СН2→СН3 – СН = СН - СН2СІ
СІ
3-хлорбутен-1 1-хлорбутен-2
Көптеген органикалық реакциалар екі молекуланың арасында, молекула мен ионның
арасында немесе молекула мен радикалдың арасында жүреді. Қандай бөлшектің арасында жүретіндігіне байланысты оларды иондық, радикалдық механизм деп бөледі, егер реакция радикал қатысында жүрсе, радикалдық механизм деп атайды, оны R – деп белгілейді. Ионның қатынасында жүрген реакцианы иондық механизм деп атайды.
Шабуыл жасайтын реагенттің табиғатына байлаысты иондық реакция электрофильді және нуклеофильді болып екіге бөлінеді.
Реакцияға қатысатын реагент өзінің электрон жұбын байланыс түзуге басқа молекулаға берсе, онда нуклеофильді (электродонорлы) реагент деп атайды. Нуклеофильдің қатысында жүретін реакциаларды нуклеофильдік реакциалар деп атайды Nuдеп белгілейді.
Мысалы: ![]() +
+![]() -+:Nu-
-+:Nu-![]() R-Nu+:X -
нуклеофильдік орын басу реакциасы.
R-Nu+:X -
нуклеофильдік орын басу реакциасы.
Егер молекула басқа молекуланың жұп электронын қосып алса, оны электрофильді (электронакцепторлы) реагент деп атайды. Электрофильдің қатысында жүретін реакциаларды электрофильдік реакциалар деп атайды, Е деп белгілейді.
Мысалы: ![]() электрофильдік орын басу
реакциасы.
электрофильдік орын басу
реакциасы.
Органикалық қосылыстарды физикалық әдістермен зерттеу
Органикалық заттың тазалығы туралы мағлұмат алу үшін, оның сапалық (элементті) және сандық құрамын тағайындап, физикалық константаларын (балқу температурасын, қайнау температурасын, тығыздығын, сыну көрсеткішін) анықтайды. Жаңа оргаикалық заттың құрылысын анықтау үшін химиялық, физико-химиялық немесе физикалық әдістерді қолданады.
Органикалық затардың физикалық константаларын анықтау.
Заттардың физикалық константалары оның химиялық құрамына және тазалығына тәуелді болады. Таза және қоспа заттардың балқу температуралары бірдей болмайды. Қоспа заттар әр уақытта таза заттардан бірнеше градус төмен температурада балқиды.Сұйықтардың қайнау температурасын айдау жолымен анықтайды.Сұйықтықтың меншікті салмағын анықтау.
Меншікті салмақты анықтау үшін пикнометр қолданылады. Пикнометр деп аузына дәл және тура келетін капилляры бар тығынмен жабдықталған немесе сұйықтың деңгейі келетін жері сызықшамен белгіленген мойны жіңішке колба.
Органикалық заттарды физикалық әдістермен зерттеу.
Соңғы уақытта органикалық қосылыстардың құрылысын зерттеу үшін әртүрлі физикалық әдістер қолданылады. Атап айтқанда: хроматография, спектроскопия, колориметрия және тағы басқалары.
Органикалық қосылыстарды тазалау және бөлу.
Органикалық реакциалар бір бағытта сирек жүреді, сөйтіп негізгі өніммен қоса қосымша өнімдер түзіледі. Сондықтан органикалық заттардың қасиетін зерттеместен бұрын, оларды әр түрлі қоспалардан тазарту қажет. Органикалық қосылыстарды тазалау олардың агрегаттық күйіне байланысты әр түрлі әдістермен жүргізіледі.
Қатты органикалық қосылыстарды қайта кристалдандыру және возгонкалау, ал сұйық заттарды айдау, экстракциялау арқылы тазалайды.
Органикалық қосылыстардың сапалық анализі
Органикалық заттардың сапалық құрамы оның молекуласындағы қандай заттар бар сонымен сипатталады. Органикалық қосылыстарда көміртегіден басқа сутегі, оттегі, азот, күкірт, галогендер, фосфор болады. Органикалық қосылыстардың құрамына енетін заттар бейорганикалық және аналитикалық химия әдістерімен анықталады.
Егер зерттелетін затта альдегид тобы болмаса, кетон тобын натрий гидросульфитімен анықтайды. Сонда кристалды тұнба - кетонның гидросульфитті туындысы түзіледі.
Спирттер
а) Бір атомды спирттер металл натриймен әрекеттескенде, сәйкес алкоголяттар түзіледі және сутегі газы бөлінеді.
ә) Көп атомды спирттерге мыс сульфатымен әсер еткенде, қою көк түсті мыстың глицераты (немесе гликоляты) түзіледі.
Аминдер
а) Суда еритін аминдерді сулы ерітінділерін индикатор мен зерттеу арқылы анықтайды. Олар сілтілік реакция береді.
е) Суда ерімейтін аминдерді тұз қышқылының 5%-тік ерітіндісінде еріту арқылы анықтауға болады.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.