
11 №Сабақ / Урок № 11
Сабақ жоспары / План урока
Сабақтың тақырыбы / Тема урока
Основные положения МКТ и их опытное обоснование Размеры и масса молекул.
Сабақ барысы / Ход урока
В классической механике изучалось механическое движение. Однако, в данной теории нет ответа на целый ряд вопросов, в частности:
• не исследуются «внутренние» свойства тел,
• не рассматривается природа сил и т. д.
Вывод: изменение температуры тел способно изменить его до неузнаваемости. Очевидно, данные изменения связаны с движением и взаимодействием частиц, составляющих тело. Необходимо установить законы, описывающие эти изменения.
Молекулярно-кинетическая теория (МКТ) занимается изучением свойств веществ, основываясь при этом на представлениях о частицах вещества.
Цель молекулярно – кинетической теории – объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, на основе представлений о том, что все тела состоят из отдельных беспорядочно движущихся частиц.

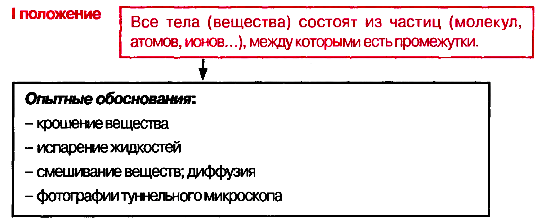
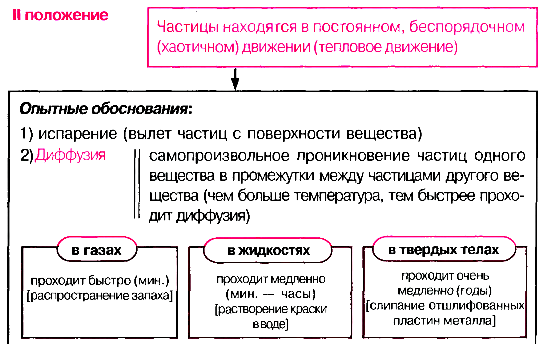
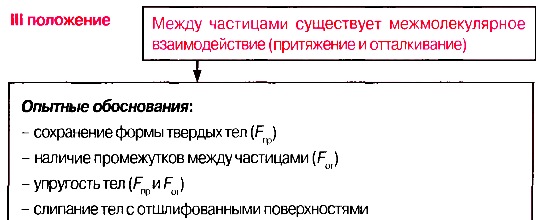
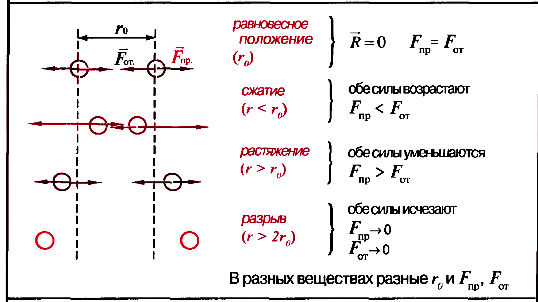
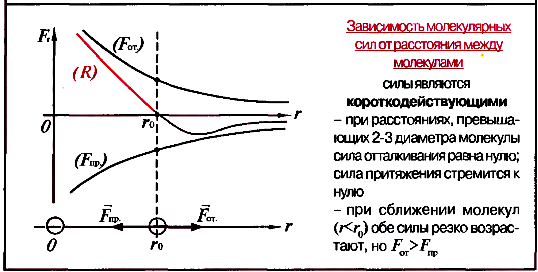
Основные положения МКТ и их опытное обоснование
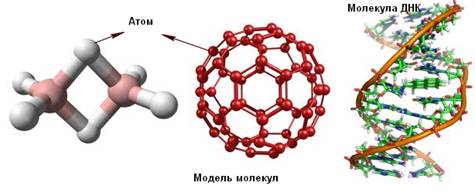 |
1 За единицу массы молекул различных веществ принимается 1/12 массы m0C атома изотопа углерода 12С. Она называется атомной единицей массы (а.е.м.) и равна:
1 а.е.м.=1,66 10-27кг.
2 Относительной молекулярной массой МR вещества называют отношение массы одной молекулы m0 данного вещества к 1/12 массы m0C атома углерода:
![]()
3 Число частиц в одном моле называется постоянной Авогадро и обозначается NА:
NА ≈ 6·1023 моль-1
Следовательно, в 1 моле любого вещества содержится одно и тоже число атомов или молекул.
4 Количество вещества – это величина ν, пропорциональную числу частиц - структурных элементов данной системы.
![]() (моль)
(моль)
![]()
Его принято выражать в молях. Один моль-это количество вещества, содержащее столько же молекул (атомов) сколько атомов в углероде 12С массой 0,012 кг.
5 Если количество вещества данного тела содержит ν молей, то число молекул N в теле равно:
N = ν·NA ;
![]()
6 Молярной массой М вещества называется масса вещества, взятого в количестве одного моля. Она равна произведению массы m0 одной молекулы на число Авогадро NA:
М = m0·NA (кг/моль)
Между молярной и молекулярной массами существует простая связь, а именно:
М = Мr*10-3 кг/моль.
7 Масса частицы (атома, молекулы)
![]()
![]()
8 Масса m любого количества вещества равна произведению массы одной молекулы на общее число молекул в теле:
m = m0*N (кг)
9 Концентрация молекул – число частиц в единице объёма:
![]() (м-3)
(м-3)
II. Примеры решения задач
|
Задачa №1 Сколько атомов водорода содержится в 100 г воды?
Решение.
Так как молярная масса воды M≈18·10-3 Теперь
рассчитаем число молекул Ответ: число молекул 3,3·1024. Задачa
№2
Вычислите массу молекулы кислорода , если его молярная масса равна
Решение.
Так как в одном моле вещества содержится NA молекул, то масса m0молекулы
определяется по формуле: Ответ: Масса молекулы кислорода 5,3·10-26 кг |
|
|
Заполнить таблицу (на оценку!)
|
Состояние вещества |
Расстояние между молекулами (по сравнению
с диаметром одной молекулы |
Характер движения молекул |
Расположение молекул |
Основные свойства (описать что происходит с формой и объёмом) |
|
Газообразное |
|
|
|
|
|
Жидкое |
|
|
|
|
|
Твердое |
|
|
|
|
– составить конспект урока;
- прочесть «Физика10. Часть 1» стр 153- 164;
- решить задачи стр 160 №2,3,4;
- сфотографировать таблицу и задачи, поместить в Ворд и прикрепить на портал
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.