
Основные представления молекулярно-кинетической теории газов. Макроскопические системы. Статистика и термодинамика.
Давление газа. Абсолютная температура.
Представление о прерывном, молекулярном строении вещества зародилось ещё в глубокой древности, но долгое время оно было лишь догадкой выдающихся умов. В наше время молекулярное строение вещества стало стройной теорией, хорошо проверенной тысячами экспериментов как косвенными, так и прямыми.
К прямым методам наблюдения молекул относятся методы современной микроскопии. Так как размеры молекул меньше длины волны видимого света, то при помощи оптических микроскопов невозможно рассматривать отдельные молекулы. Увидеть крупные молекулы позволяют современные электронные микроскопы. Также есть косвенные методы, с помощью которых можно наблюдать вязкое трение, диффузию газов и жидкостей, давление газа на стенки сосуда.
Итак, молекулярная физика изучает микроскопические свойства тел, находящихся в различных агрегатных состояниях, процессы, которые в них совершаются, обусловленные тепловым излучением и взаимодействием микроскопических частиц, составляющих эти тела.
Молекулярная физика – раздел физики, изучающий строение и свойства вещества, исходя из молекулярно-кинетических представлений.
Вещество состоит из мельчайших частиц-молекул, которые взаимодействуют друг с другом и находятся в тепловом движении. Между молекулами действуют силы взаимодействия притяжения и отталкивания.
Ниже приведён график зависимости потенциальной энергии взаимодействия двух молекул от расстояния между ними.
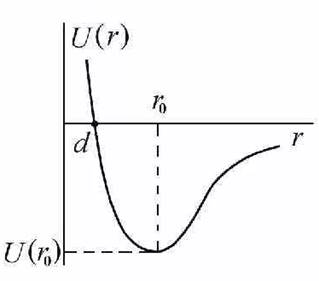
Величина U(r0) характеризует энергию взаимодействия при равенстве сил притяжения и отталкивания и имеет значение порядка 0,1-0,01эВ. Часто это взаимодействие называют ван-дер-ваальсовым в честь голландского физика.
Молекулы – это наименьшие частицы вещества, сохраняющие все его химические свойства. Они состоят из атомов (более простые частицы). В настоящее время известно 118 различных видов атомов: 94 атома встречаются в природе, а 24 атома получены искусственным путём.
Атомный вес (Ае) химического элемента – отношение массы атома этого элемента к 1/12 массы атома С12.
Молекулярный вес (Мr) – отношение массы молекулы этого вещества к 1/12 массы атома С12. Данная величина не имеет размерность.
Макроскопическая система – материальный объект, состоящий из огромного числа частиц.
Два направления исследования:
а) молекулярно-кинетическое (статическое). Использует статистический метод, который состоит в изучении свойств макроскопических систем в целом, не интересуясь движением отдельных молекул.
б) термодинамическое. Использует термодинамический метод, который состоит в изучении свойств тела без учёта молекулярных явлений в них, причём все процессы рассматриваются с энергетической точки зрения. Оба метода тесно связаны между собой.
Термодинамика и статистика изучают те свойства макросистем и те происходящие в них процессы, которые являются результатами атомных и молекулярных явлений.
Давление –
эта скалярная физическая величина, численно равная нормальной составляющей
силы, действующей на единичную площадку: 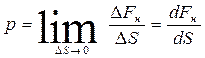 [Па]
или [Н/м2].
[Па]
или [Н/м2].
Температура – физическая величина, характеризующая состояние теплового равновесия. Различают термодинамическую (абсолютную) температуру и температуру Цельсия.
Шкала Кельвина называется абсолютной шкалой температур, а температура -273,150 называется нулём температуры. Связь шкалы Кельвина с температурой в Цельсиях: T=t0C + 273,15 K.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.