
Цель: Сформировать представление о свойствах азотной кислоты и ее солей, отметить особенности взаимодействий азотной кислоты с металлами.
Задачи:
Образовательные: Знать основные химические свойства HNO3(взаимодействие с металлами и неметаллами) ( Р ), — уметь приводить примеры азотных удобрений( П ).
Уметь писать ионные уравнения и ОРВ, научить составлять уравнения реакции, подтверждающих свойства HNO3.
Развивающие: выявить и развивать умения и навыки детей для определения строения атома азота и свойства HNO3.
Воспитательные: изучить роль азотной кислоты её солей в Н/Х и С/Х.
Мотивация урока: использование ИКТ.
Планируемые результаты:
Предметные: дать общую характеристику, знать строение молекулы, описать ее физические и химические свойства, написать уравнения реакций.
Метапредметные: уметь составлять схему ОВР, прогнозировать свойства HNO3, охарактеризовать области применения.
Личностные: понимать значение азотной кислоты её солей в Н/Х и С/Х.
Задачи урока:
· Рассмотреть физические свойства азотной кислоты;
· На примере азотной кислоты повторить классификацию и основные свойства кислот в свете ТЭД;
· Познакомить учащихся с окислительными свойствами азотной кислоты;
· Дать представление об областях применения азотной кислоты.
Оборудование и реактивы:
· азотная кислота (конц. и разб.),
· лакмус, оксид меди (II),
· хлорид меди (II),
· гидроксид натрия, карбонат натрия,
· медная проволока,
· химические стаканчики,
· колба.
Ход урока
1. Организационный момент.
Приветствие учащихся. Проверка готовности к уроку. Сообщение темы и цели урока. Ознакомление с планом урока
2. Контроль ЗУН.
Учащимся предлагается самостоятельная работа, с целью актуализации знаний по изученным ранее азотсодержащим веществам с последующим обсуждением результатов
Вариант № 1
1. Запишите формулу и название соединения азота по его свойствам.
Бесцветный газ, плохо растворим в воде, легко соединяется с кислородом воздуха, образуя бурый газ.
Ответ:
2. Расположите соединения азота в порядке возрастания степеней окисления (укажите степени окисления): N2, NH3, KNO3, NO, HNO2.
Ответ:
3. Составьте уравнения реакций по схеме. Назовите вещество Х: N2 -> X -> NH4Cl
Ответ:
Вариант № 2
1. Запишите формулу и название соединения азота по его свойствам.
Бесцветный газ с характерным резким запахом, хорошо растворим в воде, легче воздуха.
Ответ:
2. Расположите соединения азота в порядке возрастания степеней окисления (укажите степени окисления): NO2, N2O, HNO3, NH4Cl, N2O3.
Ответ:
3. Составьте уравнения реакций по схеме. Назовите вещество Х: NO2 -> X -> NH4NO3
Ответ:
3. Формирование новых знаний.
Учитель знакомит учащихся с планом изучения новой темы
I. Физические свойства азотной кислоты;
II. Характеристика азотной кислоты;
III. Химические свойства ;
IV. Применение.
I. Физические свойства азотной кислоты
Учитель демонстрирует учащимся азотную кислоту, рассказывает о ее физических свойствах и способе хранения. Учащиеся в тетрадях делают соответствующие записи
· Агрегатное состояние - жидкость;
· Цвет - отсутствует;
· Запах - едкий, кислотный;
· Растворимость в воде - хорошая;
· "Дымит" на воздухе;
· "Особые приметы":
при хранении на свету разлагается, приобретая желтоватый оттенок:
4HNO3=4NO2![]() +
O2
+
O2![]() + 2H2O
+ 2H2O
II. Характеристика азотной кислоты
Учитель дает учащимся задание на повторение, с учетом предшествующих внутрипредметных связей: дайте характеристику азотной кислоте, используя основные признаки классификации кислот. После самостоятельного выполнения задания, фронтально обсуждаются результаты
1. По основности:
· одноосновная
2. По содержанию кислорода:
1. кислородсодержащая
3. По растворимости в воде:
· растворимая
4. По стабильности:
· нестабильная
5. По летучести:
· летучая
6. По степени диссоциации:
· сильная
III. Химические свойства
1. Свойства HNO3 как электролита.
Учащиеся вспоминают основные общие свойства кислот. Далее учитель последовательно демонстрирует: изменение окраски лакмуса и взаимодействие азотной кислоты с оксидом меди(II), гидроксидом меди(II) (предварительно получив его) и с карбонатом натрия. По ходу демонстрации учащиеся комментируют признаки химической реакции, после чего записывают уравнения проведенных реакций в молекулярном и ионном виде с последующим обсуждением результатов (слайд № 12)
Азотная кислота изменяет окраску индикатора: HNO3 = H+ + NO3 - (сильный электролит) взаимодействует:
а) с оксидами металлов:
· CuO + 2HNO3 = Cu(NO3)2 + H2O
· CuO + 2H+ = Cu2+ + H2O
б) с основаниями:
· Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
· Cu(OH)2 + 2H+ = Cu2+ + 2H2O
в) с солями:
·
Na2CO3 +
2HNO3 = 2NaNO3 + CO2![]() +
H2O
+
H2O
· CO32- + 2H+ = CO2 + H2O
2. Окислительные свойства азотной кислоты
Учитель рассказывает об особенностях взаимодействия азотной кислоты с металлами и демонстрирует взаимодействие HNO3 с медью (используется кусочки медной проволоки). Учащиеся записывают уравнения реакции. Учитель акцентирует внимание на том, что азотная кислота никогда не восстанавливается до водорода. (слайд № 13):
Взаимодействует с металлами:
· K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Hg, Ag, Au
· Ме + HNO3 -> Me(NO3)n + H2O + NxOy
·
Cu + 4HNO3(конц)
= Cu(NO3)2 + 2H2O + 2NO2![]()
·
3Cu + 8HNO3(разб)
= 3Cu(NO3)2 + 4H2O + 2NO![]()
·
Me + HNO3 ![]() Me(NO3)2 +
H2
Me(NO3)2 +
H2![]()
IV. Применение азотной кислоты.
Области применения азотной кислоты:
· Производство азотных удобрений;
· Производство взрывчатых веществ;
· Производство красящих веществ;
· Лекарственные препараты;
· Синтез различных химических веществ;
· Полимерные материалы (пластмассы)
4. Закрепление изученного материала.
1. Выберите, какие из перечисленных свойств характеризуют физические свойства азотной кислоты:
· Твердое агрегатное состояние;
· Хорошая растворимость в воде;
· Отсутствие запаха;
· Желтый цвет;
· Разлагается на свету с выделением азота;
· "Дымит" на воздухе.
2. Назовите вещества, с которыми может реагировать азотная кислота, запишите соответствующие уравнения реакций:
· SO2
· H2
· ZnO
· Ca(OH)2
· HCl
· Na2SiO3
· Ag
3. Азотную кислоту применяют для определения примесей в золотых изделиях. Объясните, чем в ряде случаев обуславливается появление бурого газа и голубого раствора при обработке золота кислотой?
5. Подведение итогов.
А) Что я узнал о свойствах азотной кислоты?
Б) Где применяется азотная кислота?
6. Домашнее задание с комментариями.
· Выучить параграф 27 (со 2 абзаца);
· Проанализировать записи в тетради;
Цели: развить знания учащихся о свойствах, получении и применении кислорода; закрепить и расширить знания о химических реакциях и составлении химических уравнений; подвести учащихся к осознанию практической значимости знаний о кислороде; продолжить формирование умений проводить эксперименты, работать с лабораторным оборудованием, наблюдать, анализировать и делать выводы; способствовать развитию образного и логического мышления, активизируя такие приемы мышления, как сравнение и обобщение.Форма урока: комбинированный.
Методы: репродуктивный, частично-поисковый, исследовательский.
Учащиеся должны: знать:
- состав молекулы кислорода, понятие аллотропии; состав воздуха;
- способы получения кислорода в лаборатории и промышленности; физические свойства кислорода;
Уметь:
- давать характеристику элемента кислорода, записывать уравнения реакций получения кислорода, собирать прибор для получения кислорода. Основные понятия и термины: простые вещества, аллотропия, реакция разложения, реакция соединения, катализатор, окисление, горение.
Оборудование и реактивы: образцы неметаллов (S, Р, уголь), металл — железная игла и магниевая лента, кислород в закрытых колбах, спиртовка, лучина, спички, стаканы, пробирки с пробкой и газоотводной трубкой, КМп04, Мп02, раствор перекиси водорода, кристаллизатор с водой, цилиндр, ложки для сжигания веществ; периодическая таблица химических элементов Д. И. Менделеева.
Кислород — это вещество, вокруг которого вращается земная химия.
Я. Берцелиус
ХОД УРОКА
I. ОРГАНИЗАЦИОННЫЙ ЭТАП
II. ОПРОС ПО ДОМАШНЕМУ ЗАДАНИЮ
1. Словарная работа
2. Фронтальный опрос
3. Эксперимент — получение и сбор кислорода. Соблюдение правил техники безопасности
III. МОТИВАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ
Из атомов мир создавала Природа:
Два атома легких взяла водорода,
Прибавила атом один кислорода —
И получилась частица воды,
Море воды, океаны и льды...
Стал кислород чуть не всюду начинкой.
С кремнием он обернулся песчинкой.
В воздух попал кислород,
Как ни странно,
Из голубой глубины океана.
И на Земле появились растения,
Жизнь появилась: дыханье, горение...
Первые птицы и первые звери,
Первые люди, что жили в пещере...
Огонь добывали при помощи трения,
Роль кислорода на нашей Земле Понял великий Лавуазье.
Чему посвящены эти строки стихов?
Учитель.Сегодня мы поговорим о неметалле, о котором можно сказать — знакомый незнакомец. Рассмотрим самый распространенный на Земле элемент-неметалл — кислород, поговорим о его строении, физических и химических свойствах. Но почему для нас он — знакомый незнакомец? Что вы уже знаете о кислороде?
Метод ментальной (умственной) карты «Лучистое мышление»
1. Предмет изучения представлен картиной, расположенной в центре.
2. Основные идеи изображаются ответвлениями, исходящими из центральной картины.
3. Мысли над ответвлениями обозначаются ключевой картиной или ключевым словом.
4. Менее важные ассоциации занимают место над линиями, связанными с основными ответвлениями.
IV. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Постановка проблемы
Учитель.Давайте поиграем. Я буду называть вещество или тело, а вы, если оно может гореть, хлопаете в ладони.
Бумага, вода, лед, дрова, уголь, стекло, спирт, железо...
Почему не хлопали? (Почему-то кто-то хлопнул, кто-то — нет.) Давайте проверим, горит ли железо, ведь еще Адольф Вюрц, немецкий химик, сказал: «В химии нет ничего невозможного».
Демонстрационный опыт
«Горение железа в кислороде»
Учитель.Вижу, вы удивлены. Почему? Чего же мы еще не знаем о кислороде?
Давайте сформулируем тему урока: «Химические свойства кислорода».
Почему горит железо? Какие будут гипотезы? Предположения?
Учащийся.В колбе больше кислорода, чем в воздухе!
Учитель.Возможно, следует провести этот же опыт, но с другими веществами? На какие группы делятся вещества?
Учащийся.Простые и сложные.

Учитель.У меня на столе есть еще сера, фосфор и углерод. К какой группе простых веществ их можно отнести?
Учащийся.Неметаллы.
Учитель.Кто-нибудь знает, горят они или нет? Давайте проверим. Только сегодня эксперимент будет демонстрационным, поскольку опыта обращения с кислородом и горючими веществами у вас пока маловато. Но в скором времени у нас практическая работа, где я смогу увидеть и оценить вашу сегодняшнюю наблюдательность.
Демонстрационный опыт: горение фосфора в кислороде и на воздухе
Учитель.Запишите уравнение горения фосфора в кислороде.
(Пошаговое комментирование возле доски.Понятия — исходные вещества, продукт реакции, валентность, коэффициент, схема реакции, уравнение реакции.)
Демонстрационный опыт: горение серы в кислороде и на воздухе, горение угля в кислороде и воздухе (записываем уравнения)
Учитель.Настало время записать уравнение реакции окисления железа. Посмотрите на уравнение реакции. Вас удивляет дробная валентность железа. Мы с таким явлением сталкиваемся впервые, но, поверьте мне, не в последний раз. Дело в том, что железная окалина представляет собой смешанный оксид (смесь).
![]()
Демонстрационный опыт «Горение магниевойленты в кислороде и на воздухе»
Учитель.Запишите уравнение горения магния в кислороде. Чем подобны все записанные нами уравнения реакции.
Учащийся.Исходных веществ несколько, продукты реакции — одно сложное вещество, состоящее из двух элементов, один из которых кислород.
Учитель.Эти реакции называются реакциями соединения. Запишите определение реакции соединения. Кислород — активное вещество, оно легко вступает во взаимодействие с другими веществами. Эти реакции называются реакциями окисления. Если при окислении выделяются тепло и свет, то это реакция горения. В результате многих реакций при участии кислорода, особенно горения, получаются бинарные соединения кислорода — оксиды. Запишите определение оксидов.
Вывод.Простые вещества, как металлы, так и неметаллы, вступают в реакцию с кислородом, в результате получаются оксиды, а реакции называются реакциями окисления.

Учитель.Давайте рассмотрим, как реагирует кислород со сложными веществами. Кислород может взаимодействовать с некоторыми кислородсодержащими соединениями — реакции окисления:
![]()
Преобразуйте схемы реакций в химические уравнения.
Многие органические вещества (спирт, природный газ, бензин и др.) сгорают в кислороде с образованием углекислого газа и воды:
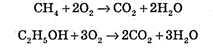
Обычно в результате взаимодействия сложных веществ с кислородом образуются оксиды техэлементов, которые входят в состав этого сложного вещества:
![]()
Давайте вспомним и об озоне. Как вы думаете, будут ли совпадать свойства озона и кислорода.
Ученик.Его свойства должны быть похожи на свойства кислорода, но только похожи.
Учитель.Действительно, химические свойства озона отличает чрезвычайно высокая реакционная способность. Озон — один из самых сильных окислителей за счет атомарного кислорода, образующегося при распаде озона.
О3 → О2 + О
Очень важно помнить, что озон проявляет окислительные свойства уже при комнатной температуре. Так, при работе с озоном нельзя использовать резиновые шланги — они моментально продырявятся. (То есть в кислородной подушке его хранить нельзя.)
V. ОБОБЩЕНИЕ И СИСТЕМАТИЗАЦИЯ ЗНАНИЙ
Учитель.Венгерский ученый Д. Хевеши говорил: «Мыслящий ум не чувствует себя счастливым, пока ему не удастся связать воедино разрозненные факты, которые он наблюдает». Сегодня мы попробовали создать «портрет кислорода» из тех фактов, которые были известны, и из новой информации об этом элементе и простом веществе. Как вы думаете, почему Берцелиус сказал: «Кислород — это вещество, вокруг которого вращается земная химия»? Какое значение имеет кислород? Какие свойства проявляет? Почему кислород был назван знакомым незнакомцем? Что нового вы узнали о кислороде?
Ученик.Кислород химически активный, поэтому многие природные явления, если не большинство, протекают при его участии. Самый известный из таких процессов — горение. Менее заметны другие реакции при участии кислорода, а именно: дыхание живых организмов, образование ржавчины на металлах, гниение и др.
Кислород применяется для дыхания, резания металлов, в процессах горения для окисления горючего, топлива, во всех химических производствах, где необходимо участие кислорода.
Задание по карточкам Вариант I
1. Составьте формулы оксидов кальция, фосфорами), азота(1У).
2. Закончите уравнения реакции горения лития, этана С2Н6.
Вариант II
1. Составьте формулы оксидов алюминия, азота (V), железа(Ш).
2. Закончите уравнения реакции горения калия, этена С2Н4.
VI. ПОДВЕДЕНИЕ ИТОГОВ УРОКА
1. Достигли ли мы цели урока?
2. Оцените свою работу на уроке: «высокий уровень», «достаточный уровень», «средний уровень».
3. Сдайте тетрадь на проверку учителю.
VII. ДОМАШНЕЕ ЗАДАНИЕ
Творческое задание: напишите небылицу или сказку, нарисуйте комиксы о свойствах кислорода и озона. Для тех, кто выбирают исследовательскую работу: проведите мини-исследование по вопросам:
1. Что будет, если увеличить содержание кислорода в воздухе до 30 % ? уменьшить до 8 % ?
2. Озон — друг или враг?
3. Все ли простые вещества вступают во взаимодействие с кислородом?
4. При каких условиях начинается реакция горения?
5. Почему сера, фосфор и углерод ведут себя на воздухе совсем не так, как в кислороде?
6. Всегда ли реакции окисления сопровождаются горением?
7. Почему мы дышим кислородом? Мы горим!? Учитель. Поищите информацию в книгах,
Интернете, а на следующем уроке поговорим. Думаю, будет интересно.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.