
Открытый урок по теме:
«Газовые законы», 10 класс.
Цели урока
1. Орг.момент.
Сегодня, ребята, мы попытаемся, используя уже накопленные нами знания, пройти сложный путь первооткрывателей и сформулировать пусть уже открытые законы. Но мы пока учимся, а дальше, как знать может быть, вам откроется то, о чем сегодня ученые даже не думают. Ну а теперь - вперед! Записываем тему урока, она на доске и повторим то, что изучали ранее.
Вариант № 1
1. Какие макроскопические параметры связывает уравнение Клапейрона – Менделеева?
2. Какой объем занимает газ в колличестве103моль при давлении1МПа и температуре 1000С
(Ответ V=3,1м3)
Вариант № 2
1. Какие параметры необходимо знать для определения состояния идеального газа?
2. При какой температуре 1 см3 содержит 1019 молекул, если давление газа равно 104Па?
(Ответ Т=720С)
2.Изучение нового материала
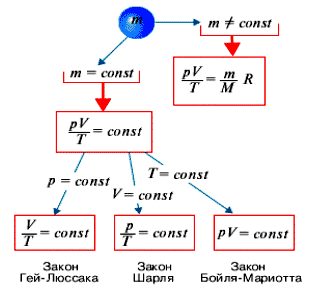
Уравнение состояния идеального газа, позволяет описать поведение идеального газа при любых изменениях параметров p, V, m, и Т.
До создания МКТ идеального газа свойства газов изучались экспериментально, были открыты законы поведения газов, которые легко можно вывести непосредственно из основного уравнения МКТ идеального газа. Когда в газе происходят какие-либо процессы, то обычно изменяются все три параметра: p, V, и Т.
Рассмотрим процессы, которые протекают при изменении только двух параметров, а третий остается постоянным. Эти процессы получили название изопроцессов (от греческого “изос” – равный, одинаковый).
Уравнения состояния газа для них легко получить из уравнения Клапейрона-Менделеева, положив один из параметров равным постоянной величине.
1.Если
в уравнении состояния ![]() или
уравнение Клапейрона-Менделеева
или
уравнение Клапейрона-Менделеева ![]() считать
Т=const, то вся его правая часть будет величиной постоянной:
считать
Т=const, то вся его правая часть будет величиной постоянной: ![]() .
.
Полученная
формула выражает закон, установленный опытным путем в 1662г. английским
ученым Р.Бойлеми в 1667г. независимо от него французским
физиком Э.Мариотта: ![]()
Для данной массы газа при постоянной температуре произведение объема газа на соответствующее ему давление есть величина постоянная.
Данный процесс, протекающих при постоянной температуре, называют изотермическим. Закон Бойля – Мариотта можно проверить экспериментально.
Опыт. Медленно изменяя объем воздуха в цилиндре при неизменной температуре, наблюдаем за показаниями манометра и убеждаемся, что с уменьшением или увеличением объема давление соответственно увеличивается или уменьшается во столько же раз.
Представим этот процесс графически
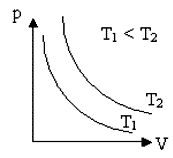
Графически зависимость между давлением и объемом газа при постоянной температуре представлен виде гиперболы
Каждому
значению температуры соответствует своя кривая (см. рис.). Эти
кривые называют изотермой. Чем выше температура, при которой происходит процесс,
тем выше расположена изотерма ![]() .
.
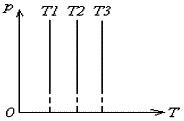
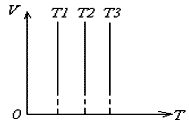
В системах координат р,Т и V,Т изотермический процесс изображается прямой, параллельной соответственно оси р или V. Эти прямые изотермы. Параметры V или Р меняются, а Т=const
2.Газ
находится в условиях, когда постоянным сохраняется его давление Р. Переход
газа из одного состояния в другое, совершающийся при постоянном давлении,
называют изобарным. В этом случае постоянным будет отношение
объема газа к его температуре, из уравнения Клапейрона-Менделеева следует,
что ![]() седовательно, для
данной массы газа и постоянном давлении объем газа прямо пропорционален
абсолютной температуре.
седовательно, для
данной массы газа и постоянном давлении объем газа прямо пропорционален
абсолютной температуре.
Этот
закон был установлен опытным путем в 1802г. французским физиком Ж.Гей-Люссаком. Формулу
закона Гей-Люссака, его можно представить в виде: ![]()
Этот закон проверим экспериментально с помощью опыта. Для этого цилиндр переменного объема поместим в сосуд с водой, температуру которой можно изменять. При повышении температуры давление воздуха увеличивается. Изменим объем цилиндра так, оставляя давление прежним.
Закон Гей-Люссака можно проиллюстрировать и с помощью колбы с изогнутой трубкой.
В горизонтальной части трубки имеется капелька жидкости, отделяющая газ в колбе от атмосферного воздуха. Если подогревать колбу (даже руками), то капелька жидкости сместится вправо, т.е. объем газа, находящегося в колбе, увеличится, а давление останется равным атмосферному.
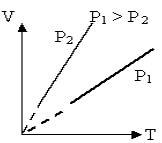
рис. а
![]() при m=const.
при m=const.
Графически такой процесс с помощью координатных осей V, Т можно изображается прямой, продолжение которой проходит через начало координат. Называется эта прямая изобара. Угол ее наклона к оси температур зависит от давления газа: чем больше давление, тем меньше угол наклона (см.рис. а).
|
|
|
|
V1 < V2 |
Т1 < Т2 |
|
рис. б |
рис. в |
На диаграммах с координатными осями р,Т или p,V изобары имеют вид прямых, параллельных оси Т или соответственно оси V (см.рис. б и в).
3.
Рассмотрим поведение газа в условиях, когда постоянным сохраняется его
объем V. Из уравнения Клапейрона – Менделеева следует, что в
этом случае постоянным будет отношение давления к его температуре: ![]() при
постоянном объеме давление газа прямо пропорционально его абсолютной
температуре.
при
постоянном объеме давление газа прямо пропорционально его абсолютной
температуре.
Этот закон был экспериментально установлен французским ученым Ж.Шарлем. Его можно проверить экспериментально.
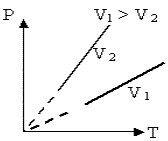
Переход газа из одного состояния в другое, совершающийся при постоянном объеме, называют изохорнымпроцессом. График этого процесса строится по уравнению и представляет собой прямую линию, продолжение которой проходит через начало координат; ее называют изохорой. Угол наклона изохоры к оси температур тем больше, чем меньше объем газа. В системах координат p,V и V,Т изохора имеет вид прямой, параллельной оси р или соответственно Т
|
|
|
|
Т1 < Т2 |
Р1 < Р2 |
Обратите внимание на то, что основные газовые законы (Бойля – Мариотта, Гей-Люссака и Шарля) представляют собой частные случаи уравнения Клапейрона-Менделеева.
Вывод:
Выполняются ли этим законам реальные газы?
Опыты показывают, что для всех реальных газов наблюдаются отступления от рассмотренных выше газовых законов, которые особенно заметны при больших давлениях и плотностях газа, а также при очень высоких или низких его температурах.
Слайд 9. Оказывается, реальные газы подчиняются рассмотренным законам идеального газа при малых плотностях и при не очень высоких и не слишком низких температурах.
3. Закрепление полученных знаний
Задача 1. На рисунке изображены две изобары: р1=const u p2=const. Какое давление больше?
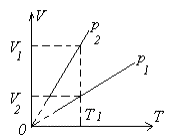
Решение. Проведем на
графике изотерму. Она пересечет изобару р2 =
сопst при большем значении объема V2, , изобару p1 =
const. При одной и той же температуре давление газа тем больше, чем
меньше его объем, что следует из закона Бойля – Мариотта: ![]() ;
значит, Р2 < Р1.
;
значит, Р2 < Р1.
Задачи решаются с обсуждением у доски
1. Дан график цикла.
|
|
1.
Какой изопроцессизображен на каждом участке графика? 1>2 T =
const, Vv, р^ Изотермическое сжатие |
Проверка задания
2.Определите недостающие величины по приведённым значениям параметров состояний газов
|
№ |
Р1, Па |
V1, м3 |
Т1, К |
Р2, Па |
V2, м3 |
Т2, К |
|
1 |
const |
2*10-3 |
? |
const |
4*10-3 |
300 |
|
2 |
105 |
const |
300 |
5*104 |
const |
? |
|
3 |
2*105 |
10-3 |
const |
? |
2*10-3 |
const |
4. Подведение итогов урока
1. Можно ли считать газовые законы следствием уравнения состояния идеального газа?
2. Назвать границы применимости газовых законов.
5. Домашнее задание: §71, упр. 13(1)
Отзыв коллег об открытом уроке физики
на тему:
«Газовые законы»
Цель посещения урока:
Раскрыть возможности детей при изучения новой темы несколькими средствами для формирования деятельностного подхода к обучении :компьютерная модель, лабораторный практикум, цифровая лаборатория.
При актуализации знаний использовался фронтальный опрос. Следующий этап урока: самостоятельное исследование из процесса. Каждой микрогруппе даются указания к работе. При этом учитываются: уровень подготовки, мотивация к изучению предмета, возрастные и психологические особенности учащихся.Использование исследования на уроке дает возможность интегрировать теоретические знания и практические навыки учащихся. При этом учащиеся приобретают опыт участия в исследовательской деятельности, навыки взаимодействия в группе. Структура урока соответствует его содержанию и целям. Использовались следующие виды деятельности: исследование, анализ, рефлексия, проблемное задание, практическая работа и т.д. Использовались разнообразные формы работы: индивидуальная, фронтальная, парная, групповая. Методы обучения: словесный, исследовательский, проблемный, практический, частично-поисковый.
В течение урока побуждалась учебная активность учащихся, учащиеся были включены в деятельность. Нагрузка на память и мышление распределена рациональна. На уроке соблюдались единые требования к культуре речи учащихся. Урок имел практическую направленность.
Урок проведен в соответствии с гигиеническими требования СаНПин: доска готова к работе, достаточное освещение, смена видов деятельности, оправданное использование ТСО, лабораторного оборудования, посадка учащихся при письме, физминутка для глаз и упражнения на релаксацию, благоприятный психологический климат на уроке.
Время на уроке распределено рационально. Подведен итог урока.
Тон ведения урока доброжелательный, уверенный. На уроке царила атмосфера сотрудничества.
Активность была 80%, т.е. на хорошем уровне. Такая активность, на мой взгляд, обусловлена тем, что структура урока, его содержание, методы и приемы обучения соответствовали данному типу урока и возрастной категории ребят. Все что планировалось, было усвоено ребятами, поэтому, я считаю, что урок поставленной цели достиг.
Урок имел практическую направленность.
Все задания ребята выполнили.
Не удалось огласить оценки за работу ребят, потому что необходимо проверить их полученные результаты практических работ.
Результаты урока:
1. Учащиеся самостоятельно получили уравнения газовых законов, дали их молекулярно-кинетическую трактовку.
2. Научились строить графики изопроцессов и читать их в различных координатных осях.
3. Применяя полученные знания о газовых законах при решении задачи самостоятельно вывели уравнение Менделеева-Клапейрона, что соответствует историческому пути развития физики.
4. Учащиеся смогли применить полученные знания для решения задач.
5. Наглядность и большая доля самостоятельности при выполнении работы способствовала лучшему усвоению изучаемого материала и формированию познавательного интереса учащихся.
Отзыв родителей об открытом уроке физики
на тему:
«Газовые законы»
Время
на уроке распределено рационально. Подведен итог урока. Тон ведения урока
доброжелательный, уверенный. На уроке царила атмосфера сотрудничества. Учащиеся
самостоятельно получили уравнения газовых законов, дали их молекулярно-кинетическую
трактовку.
Научились строить графики изо процессов и читать их в различных координатных
осях. Использовались следующие виды деятельности: исследование, анализ,
рефлексия, проблемное задание, практическая работа и т.д. Использовались
разнообразные формы работы: индивидуальная, фронтальная, парная, групповая.
Методы обучения: словесный, исследовательский, проблемный, практический,
частично-поисковый.
В течение урока побуждалась учебная активность учащихся, учащиеся были включены в деятельность. Нагрузка на память и мышление распределена рациональна. На уроке соблюдались единые требования к культуре речи учащихся. Урок имел практическую направленность.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.