
№______САБАҚТЫҢ ЖОСПАРЫ
ПЛАН ЗАНЯТИЯ №_______
Топ
Группа________________________________________
Күні
Дата____________________________________
Пәні
Дисциплина: Химия
Сабақтың тақырыбы:
Тема занятия:
Ход урока: 1.Организационный момент.
2.Работа у доски: разобрать электронное строение атомов, распределение электронов по уровням. 3.Объяснение нового материала.
Тип урока - в форме комбинирования лекции-беседы.
Периодичность - это повторяемость свойств химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элементов. Она связана, в первую очередь, с повторяемостью электронного строения атомов по мере увеличения порядкового номера (а, следовательно, заряда ядра и числа электронов в атоме).
Химическая периодичность проявляется в аналогии химического поведения, однотипности химических реакций. При этом число валентных электронов, характерные степени окисления, формулы соединений могут быть разными. Периодически повторяются не только сходные черты, но и существенные различия химических свойств элементов по мере роста их порядкового номера. Некоторые физико-химические свойства атомов (потенциал ионизации, атомный радиус), простых и сложных веществ могут быть не только качественно, но и количественно представлены в виде зависимостей от порядкового номера элемента, причем для них периодически проявляются четко выраженные максимумы и минимумы.
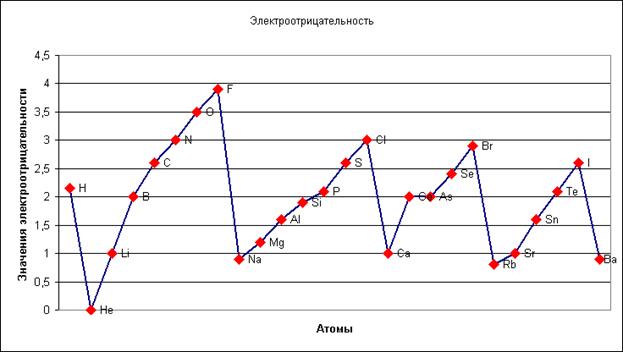
В таких физических свойствах, как энергия ионизации и сродство к электрону, также проявляется горизонтальная периодичность, связанная с периодическим изменением числа электронов на последних энергетических подуровнях:
|
Элемент |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
Ei |
520 |
900 |
801 |
1086 |
1402 |
1314 |
1680 |
2080 |
|
Ae |
−60 |
0 |
−27 |
−122 |
+7 |
−141 |
−328 |
0 |
|
Электронная формула (валентные электроны) |
2s1 |
2s2 |
2s22p1 |
2s22p2 |
2s22p3 |
2s22p4 |
2s22p5 |
2s22p6 |
|
Число неспаренных электронов |
1 |
0 |
1 |
2 |
3 |
2 |
1 |
0 |
Диагональную периодичность не следует понимать как абсолютное сходства атомных, молекулярных, термодинамических и других свойств. Та, в своих соединениях атом лития имеет степень окисления (+I), а атом магния - (+II). Однако свойства ионов Li+ и Mg2+ очень близки, проявляясь, в частности, в малой растворимости карбонатов и ортофосфатов.
В результате объединения вертикальной, горизонтальной и диагональной периодичности появляется так называемая звездная периодичность. Так, свойства германия напоминают свойства окружающих его галлия, кремния, мышьяка и олова. На основании таких "геохимических звезд" можно предсказать присутствие элемента в минералах и рудах.
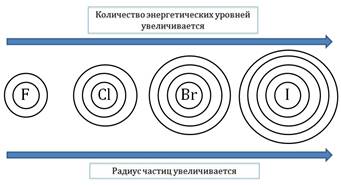
В периодах по мере увеличения заряда ядра радиусы атомов, в общем, уменьшаются, что связано с усилением притяжения внешних электронов к ядру. Наибольшее уменьшение атомных радиусов наблюдается у элементов малых периодов. В группах элементов радиусы атомов, в общем, увеличиваются, так как растет число электронных слоев. Таким образом, в изменении атомных радиусов элементов просматриваются разные виды периодичности: вертикальная, горизонтальная и диагональная.Небольшие размеры атомов элементов второго периода приводят к устойчивости кратных связей, образованных при дополнительном перекрывании р-орбиталей, ориентированных перпендикулярно межъядерной оси. Так, диоксид углерода − газообразные мономер, молекула которого содержит две двойные связи, а диоксид кремния − кристаллический полимер со связями Si−O. При комнатной температуре азот существует в виде устойчивых молекул N2, в которых атомы азота соединены прочной тройной связью. Белый фосфор состоит из молекул Р4, а черный фосфор представляет собой полимер.По-видимому, для элементов третьего периода образование нескольких одинарных связей выгоднее формирования одной кратной связи. Вследствие дополнительного перекрывания р-орбиталей для углерода и азота характерны анионы СО32− и NO3− (форма треугольника), а для кремния и фосфора более устойчивы тетраэдрические анионы SiO44− и PO43−.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.