
Тема урока: Молярный объем газов
Цель урока. Сформировать
умение вычислять объемы газов, участвующих в химических реакциях.
Основные понятия. Закон
Авогадро, молярный объем.
Планируемые результаты обучения. Уметь
вычислять объемы газов, участвующих в химических реакциях.
Краткое содержание урока. В
начале урока можно провести самостоятельную работу.
Вариант I
1. Рассчитайте:
а) плотность (н. у.) оксида углерода(IV) (г/л); б) относительную
плотность оксида азота(IV) по кислороду.
2. Рассчитайте, какой
объем (н. у.) займут: а) 0,6 моль азота; б) 10 г водорода;
в) 4,5 моль кислорода.
3. Сгорело 6 г
углерода. Вычислите: а) объем вступившего в реакцию кислорода;
б) объем образовавшегося оксида углерода(IV) (н. у.).
Вариант II
1. Рассчитайте:
а) плотность (н. у.) оксида серы(IV) (г/л); б) относительную
плотность сероводорода H2S по водороду.
2. Рассчитайте, какой
объем (н. у.) займут: а) 38 г фтора; б) 0,4 моль хлора;
в) 1,5 моль кислорода.
3. Сгорело 8 г
серы. Вычислите: а) объем вступившего в реакцию кислорода; б) объем
образовавшегося оксида серы(IV) (н. у.).
Переходя к вопросу об объемных отношениях газов при химических реакциях, учитель напоминает учащимся, что коэффициенты, стоящие перед химическими знаками и формулами, показывают не только число молекул или формульных единиц, но и число молей, участвующих в реакции. Поэтому уравнения реакций между газами можно записать и так:
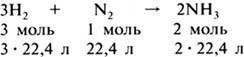
Если разделить указанные
численные значения объемов реагирующих и образующихся газов на 22,4, то
получатся простые целые числа, показывающие объемные отношения газов:
3 : 1 : 2. Следовательно, реакции между газообразными
веществами подчиняются определенным закономерностям: при неизменном
давлении объемы реагирующих и образующихся газов относятся между собой как
небольшие целые числа.
Коэффициенты в уравнениях реакций
показывают число объемов реагирующих и образующихся веществ:
![]()
Далее на конкретном
примере дается алгоритм решения типовой задачи.
Задача. Вычислите объем
углекислого газа (оксида углерода(IV)), который выделится при сгорании 2 л
метана (н. у.).

Чтобы закрепить умение решать такие задачи, учащимся можно дать несколько задач для самостоятельного выполнения. Учащиеся могут также придумать свои варианты задач и решить их.
Домашнее задание: §45 задача 1-4 с.156
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.