
Порядок заполнения атомных орбиталей электронами
Автор: магистр химии Фотов Руслан Борисович
Изучение тем «Электронные формулы», «Порядок заполнения электронных орбиталей» у учеников нередко вызывает затруднения. Если с обозначениями уровней и орбиталей, а также количеством электронов на них, проблем почти не возникает, то с порядком заполнения орбиталей проблемы почти у всех. Объяснение принципа наименьшей энергии, правила Клечковского без углубленного изучения квантовых чисел невозможно. Два часа в неделю, что отводится на курс химии, недостаточно для этого. Заучивание последовательности заполняемых орбиталей является неэффективным. На факультативных занятиях, к сожалению, тоже недостаточно времени уделяют этому вопросу.
С другой стороны, выпускнику средней школы, для которого химия не является профилирующим предметом, углубленные знания по квантовым числам не требуются. Выходом из данной ситуации может быть следующая таблица, которую я использую уже много лет в своей практике. Она помогает решению некоторых вопросов:
ü закрепляет знания по энергетическим уровням и орбиталям на каждом из них;
ü позволяет исключить заучивание последовательности заполняемых орбиталей без понимания сути; ü Наглядно виден порядок заполнения орбиталей; ü проще объяснить порядок заполнения орбиталей.
Данная таблица основывается на правиле Кличковского, но само правило не обязательно требовать в непрофильных классах или классах с гуманитарным профилем, главное, чтобы понимали смысл.
Таблица состоит из 7 строк – по количеству энергетических уровней в атомах, и 4 столбцов – по количеству типов орбиталей в основном состоянии. В каждой строке записываем орбитали, присутствующие на данном энергетическом уровне. На данном этапе происходит закрепление знаний об энергетических уровнях и орбиталях на них.
При заполнении орбиталей необходимо двигаться вдоль стрелок, заполняя орбитали, которые пересекают эти стрелки. Стрелки проходят до тех пор, пока имеются нераспределенные электроны. Если заканчивается текущая стрелка, то начинается стрелка под следующим номером.
На данном этапе материал дается в зависимости от профиля учащихся. Если это ученики непрофильных классов, а также классов с гуманитарным профилем, то просто достаточно 5 минут на объяснение правила Клечковского и уделить больше внимания практической стороне – заполнению орбиталей электронами.
Для классов, где химия является профильным предметом или для индивидуальных занятий с учащимися, данная таблица может быть использована как наглядное пособие при объяснении правила Клечковского.
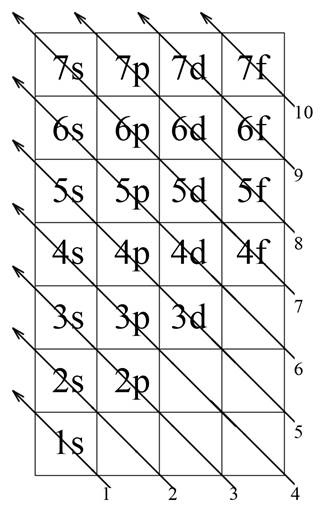
В дальнейшем, данная таблица в несколько раз сокращает время, необходимое ученикам, чтобы вспомнить порядок заполнения орбиталей.
В итоге мы получаем, что использование данной таблицы позволяет:
ü сократить время, необходимое ученику, для запоминания порядка заполнения орбиталей в атоме;
ü провести больше практических упражнений за отведенное время;
ü легче запоминается и воспроизводится учениками.
Все вышесказанное позволяет рекомендовать преподавателям использовать указанную таблицу на своих уроках и дополнительных занятиях с учениками.
Пример использования таблицы.
Напишем распределение электронов для химического элемента Индий.
Всего имеется 49 электронов в атоме.
Проходим по 1-й стрелке: 1s2. Стрелка закончилась. Осталось 47е–.
Проходим по 2-й стрелке: 2s2. Стрелка закончилась. Осталось 45е–.
Проходим по 3-й стрелке: 2p63s2. Стрелка закончилась. Осталось 37е–.
Проходим по 4-й стрелке: 3p64s2. Стрелка закончилась. Осталось 29е–.
Проходим по 5-й стрелке: 3d104p65s2. Стрелка закончилась. Осталось 11е–.
Проходим по 6-й стрелке: 4d105p1. Электроны полностью распределены.
В итоге получается:
1s22s22p63s23p64s23d104p65s24d105p1
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.