
18. Из предложенного перечня выберите все способы увеличить скорость реакции между этиленом и парами воды.
1. Уменьшение общего давления. 2. Добавление воды. 3. Понижение температуры.
4. Использование катализатора. 5. Увеличение концентрации этанола.
Запишите в поле ответа номера выбранных способов. ___________________
19. Установите соответствие между схемой реакции и свойством элемента серы, которое она проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
СХЕМА РЕАКЦИИ А) Б) В) Г) |
СВОЙСТВО СЕРЫ 1) окисляется; 2) восстанавливается; 3) и окисляется, и восстанавливается; 4) не изменяет степень окисления. |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
|
А |
Б |
В |
Г |
|
|
|
|
|
20. Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые образуются на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА А) Б) В) Г) |
ПРОДУКТЫ ЭЛЕКТРОЛИЗА 1) этан, углекислый газ, водород; 2) натрий, кислород; 3) метан, углекислый газ, водород; 4) хлор, водород; 5) водород, кислород. |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам: __________________
|
А |
Б |
В |
Г |
|
|
|
|
|
21. Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворенного вещества (n) к объему раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
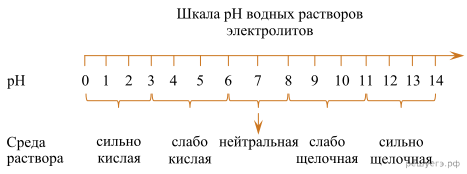
Для веществ, приведенных в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1. Иодид бария.
2. Нитрат железа (III).
3. Карбонат калия.
4. Уксусная кислота.
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Ответ:
→
→
→
.
22. Установите соответствие между способом воздействия на равновесную систему, в которой протекает реакция
![]() ,
,
и направлением смещения равновесия при этом воздействии.
|
СПОСОБ А) нагревание; Б) уменьшение давления; В) добавление кислорода; Г) добавление твердого оксида бария.
|
НАПРАВЛЕНИЕ 1) смещается в направлении прямой реакции; 2) смещается в направлении обратной реакции; 3) практически не смещается.
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
А |
Б |
В |
Г |
|
|
|
|
|
23. В реактор постоянного объема поместили некоторое количество оксида серы (IV) и кислорода. В результате протекания обратимой реакции
![]()
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы (IV) составила 0,6 моль/л, а равновесная концентрация кислорода и оксида серы (VI) — 0,3 моль/л и 0,4 моль/л соответственно.
Определите равновесную концентрацию ![]() и исходную
концентрацию
и исходную
концентрацию ![]()
Выберите из списка номера правильных ответов:
1) 0,1 моль/л; 2) 0,2 моль/л; 3) 0,3 моль/л;
4) 0,4 моль/л; 5) 0,5 моль/л; 6) 0,6 моль/л.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
|
X |
Y |
|
|
|
24. Установите соответствие между формулами металлов и реагентом, с помощью которого их можно различить.
|
ФОРМУЛЫ МЕТАЛЛОВ А) Б) В) Г)
|
РЕАГЕНТ 1) 2) 3) 4) 5)
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
А |
Б |
В |
Г |
|
|
|
|
|
25. Установите соответствие между смесью и способом ее разделения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
СМЕСЬ А) хлорид лития и уголь; Б) жидкий азот и кислород; В) хлорид серебра и хлорид натрия; Г) гексан и вода.
|
СПОСОБ РАЗДЕЛЕНИЯ 1) фракционной перегонкой; 2) обработка водой; 3) декантацией; 4) охлаждением; 5) с помощью магнита. |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
|
A |
Б |
В |
Г |
|
|
|
|
|
26. 200 г горячего 30%-го раствора соли охладили до комнатной температуры. Сколько граммов соли выпадет в осадок, если насыщенный при комнатной температуре раствор содержит 20% соли по массе? Осадок представляет собой безводную соль. Ответ запишите с точностью до целых.
27. При разложении нитрата меди (II) образовалось 12 л оксида азота (IV). Вычислите объем образовавшегося кислорода. Объемы газов измерены при одинаковых условиях. Ответ дайте в литрах с точностью до целых.
28. При растворении железа в горячей концентрированной серной кислоте выделилось 3,36 л газа (н. у.). Вычислите массу железа, которое вступило в реакцию. Ответ дайте в граммах с точностью до десятых.
29. Для выполнения задания используйте следующий перечень веществ: сульфат железа (II), нитрат калия, перманганат калия, хлорид натрия, дигидроортофосфат стронция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора и выпадением осадков. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращенное ионное уравнения этой реакции с участием выбранных веществ.
31. Две соли окрашивают пламя в фиолетовый цвет. Одна из них бесцветна, и при легком нагревании ее с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты желтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щелочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
![]()
![]()
В уравнениях приведите структурные формулы органических веществ.
33. При окислении предельного одноатомного спирта подкисленным раствором перманганата калия получено летучее органическое вещество, масса которого на 35,0% меньше массы спирта. Выход продукта составил 66,8% от теоретического. Определите молекулярную формулу спирта и установите его структуру, если известно, что продукт окисления дает реакцию «серебряного зеркала», а в состав молекулы спирта входят две метильные группы. Напишите уравнение взаимодействия спирта с подкисленным раствором перманганата калия.
34. Какую массу оксида хрома(VI) следует добавить к 275 г 10%-го раствора хромовой кислоты, чтобы увеличить ее массовую долю в полтора раза?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.