
Практическое занятие №7. Термодинамика.
Цель: научиться применять законы термодинамики при решении расчетных и графических задач.
Теоретические сведения:
Термодинамика – это наука о тепловых явлениях.
Закон Джоуля:
Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема.
Внутренняя энергия одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
![]()
Работа газа: А = pΔV
Первый закон термодинамики:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Применение первого закона термодинамики к изопроцессам в газах.
1. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
Q = ΔU = U (T2) – U (T1).
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
2. В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением:
A = p (V2 – V1) = p ΔV.
3. Первый закон термодинамики для изобарного процесса дает:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV.
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
4. В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением:
Q = A.
5. В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид:
A = –ΔU,
т. е. газ совершает работу за счет убыли его внутренней энергии.
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией поступательного движения молекул и абсолютной температурой:
![]()
Внутренняя энергия 1 моля идеального газа равна произведению на число Авогадро:
![]()
При изменении температуры внутренняя энергия изменяется:
![]()
Коэффициент пропорциональности между ΔU и ΔT равен теплоемкости CV при постоянном давлении:
![]()
Коэффициент полезного действия тепловой машины:
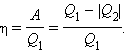
Коэффициент полезного действия цикла через температуры нагревателя T1 и холодильника T2:
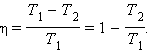
Количество теплоты, которое необходимо для плавления (выделяется при кристаллизации) вещества:
Q = ±λm
Количество теплоты, которое необходимо для парообразования (выделяется при конденсации) вещества:
Q = ±r m
Количество теплоты, которое необходимо для нагревания (выделяется при охлаждении) вещества:
Q = cm∆T
Контрольные вопросы
1. Что называют термодинамической системой?
2. Дайте определение внутренней энергии.
3. Охарактеризуйте формулу для вычисления внутренней энергии.
4. Сформулируйте первый закон термодинамики.
5. Запишите формулу первого закона термодинамики.
6. Сформулируйте первый закон термодинамики для изотермического процесса.
7. Сформулируйте первый закон термодинамики для изохорного процесса.
8. Сформулируйте первый закон термодинамики для изобарного процесса.
9. Дайте определение адиабатного процесса.
10. Сформулируйте первый закон термодинамики для адиабатного процесса.
11. Дайте определение теплового двигателя.
12. Опишите принцип работы теплового двигателя.
13. Дайте определение КПД теплового двигателя.
14. Запишите формулы для вычисления КПД теплового двигателя.
15. Запишите формулы для вычисления КПД теплового двигателя, работающего по циклу Карно.
Задание 1. Решите задачи.
1. При температуре 270С давление газа в закрытом сосуде было 75 кПа. Каким будет давление при температуре -130С?
2. При изохорном охлаждении идеального газа, взятого при температуре 480К, его давление уменьшилось в 1,5 раза. Какой стала конечная температура газа?
3. Какова внутренняя энергия 10 моль одноатомного газа при 270С?
4. Расширяясь при постоянном давлении, газ совершил работу 20 кДж. Чему было равно давление в газе, если объём газа при расширении увеличился на 0,2м3?
5.
Сосуд
ёмкостью ![]() наполнен азотом под давлением
наполнен азотом под давлением ![]() при температуре 27 0С.
Определите массу азота в сосуде, если его молярная масса 0,028 кг/моль. В
идеальной тепловой машине за счёт каждого килоджоуля энергии, получаемой от
нагревателя, совершается работа 300 Дж. Определить КПД машины.
при температуре 27 0С.
Определите массу азота в сосуде, если его молярная масса 0,028 кг/моль. В
идеальной тепловой машине за счёт каждого килоджоуля энергии, получаемой от
нагревателя, совершается работа 300 Дж. Определить КПД машины.
6. КПД идеального теплового двигателя 40%. Газ получил от нагревателя 5кДж теплоты. Какое количество теплоты отдано холодильнику?
7. Температура холодильника идеальной тепловой машины, работающей по циклу Карно и имеющей КПД 30%, 20 0С. Какова температура нагревателя машины?
Задание 2. Работа с графиками.
1.С одним кило молем идеального одноатомного газа осуществляется цикл изображенный на рисунке в координатах V,T. Газ последовательно проходит состояние 1-2-3-4-1. Температура газа в состоянии 1-200К и в состоянии 3- 800К. Найти работу совершенную газом за один цикл.
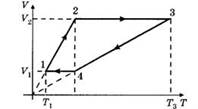
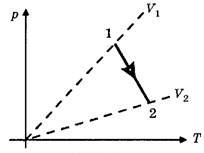
2.Как изменится температура при переходе из состояния 1 в состояние 2?
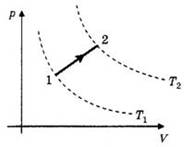
3.Как изменится объем газа при переходе из состояния 1 в состояние 2?
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.