
Условие задачи: В
процессе электролиза под действием тока плотностью 300 ![]() на электроде выделился слой меди
толщиной 0,03 мм. В течении какого времени протекал этот электролиз?
на электроде выделился слой меди
толщиной 0,03 мм. В течении какого времени протекал этот электролиз?
Эта задача прежде всего на первый закон Фарадея. Его и запишем:
![]()
Отсюда выразим время, необходимо для такого электролиза:
![]()
Данное выражение не содержит величин из условия задачи, поэтому мы, конечно же, не можем его пока что использовать. Распишем неизвестные величины через известные. Начнем с массы:
![]()
Плотность меди табличная величина, которая равна 9![]() . Объем же слоя меди можно
выразить через его толщину и площадь:
. Объем же слоя меди можно
выразить через его толщину и площадь:
![]()
Силу тока так же свяжем с его плотностью. Плотность тока определяется как:
![]()
Отсюда:
![]()
Подставив все выражения в первый закон Фарадея:
![]()
Как мы видим, данное выражение не зависит от площади пластины:
![]()
Электрохимический эквивалент также является табличной величиной и для меди
он равен 0,3![]()
![]() .
.
Подставим численные:
![]()
Условие задачи: Зная электрохимический эквивалент серебра, определите электрохимический эквивалент золота.
Так как в условии не дано ни одного значения, нам, конечно же, понадобятся табличные значения некоторых величин. А именно: электрохимический эквивалент серебра (раз по условию он дан), валентности золота и серебра а также молярные массы золота и серебра:
![]()
![]()
![]()
![]()
Запишем теперь второй закон Фарадея, как для серебра, так и для золота:
![]()
![]()
Теперь разделим эти два уравнения одно на другое:
![]()
Отсюда электрохимический эквивалент золота равен:
![]()
Электрохимический эквивалент очень важный параметр вещества, и его нужно уметь определять, к примеру, при отсутствии табличных данных или же при необходимости их проверки.
Для проведения эксперимента нам необходимо создать экспериментальную установку, которая состоит из кюветы с раствором, источника тока, амперметра, реостата, ключа, часов, весов и нагревателя для обсушки электрода.
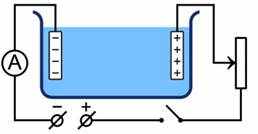
Рис. 1. Схема экспериментальной установки
В результате действия полярных молекул воды на растворенные в ней молекулы ![]() образуются пары ионов, которые при
замыкании ключа начинают движение к противоположным э��ектродам.
образуются пары ионов, которые при
замыкании ключа начинают движение к противоположным э��ектродам.
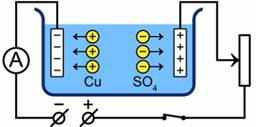
Рис. 2. Действие установки при замыкании ключа
Выставив на реостате необходимое нам сопротивление и отметив силу тока по амперметру (в течении всего опыта сила тока должна оставаться постоянной), мы должны начать отсчет времени с момента замыкания ключа. Через некоторое время размыкаем ключ и достаем из кюветы катод (именно на него оседали положительные ионы меди) после чего обсушиваем его, удаляя всю воду.
Далее необходимо замерить массу катода на весах (до начала эксперимента на них же уже должна быть замеряна начальная масса катода). После чего все данные заносятся в таблицу:
|
|
|
|
|
|
|
|
|
|
|
|
Имея в наличии все данные электрохимический эквивалент меди находиться исходя из первого закона Фарадея:
![]()
Условие задачи. Какое время понадобиться на электролиз воды, чтобы полученным водородом наполнить шар с подъемной силой 2 кН? Сила тока электролиза 200 А.
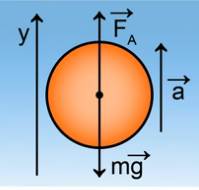 Начнем решение задачи с уравнения механики, а именно второго закона
Ньютона. На шар, накачанный таким образом, действует сила Архимеда, сила
тяжести, и он движется с каким-то ускорением вверх (раз у него есть подъемная
сила). См. рис. 3.
Начнем решение задачи с уравнения механики, а именно второго закона
Ньютона. На шар, накачанный таким образом, действует сила Архимеда, сила
тяжести, и он движется с каким-то ускорением вверх (раз у него есть подъемная
сила). См. рис. 3.
Второй закон Ньютона для данного случая выглядит как:
![]()
Спроецировав его на ось OY, получим:
![]()
Левая часть выражения и является подъемной силой шара:
![]()
Сила Архимеда по определению:
![]()
Если представить, что в шаре вместо водорода воздух, то:
![]()
Значит, выражение для подъемной силы можно преобразовать как:
![]()
Теперь чтобы связать массы водорода и воздуха, запишем для обоих случаев уравнение Менделеева-Клайперона:
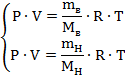
Так как и объем, и давление, и температура в обоих случаях совпадает разделим уравнения одно на другое:
![]()
Теперь выражение для подъемной силы можно записать:
![]()
Массу выделившегося водорода запишем из первого закона Фарадея:
![]()
Подставив в выражение выше:
![]()
Отсюда время выражается как:
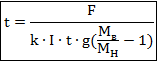
Подставив данные из условия и все встречающиеся константы, получим ответ:
![]()
· Определите массу серебра, которое выделилось на катоде при электролизе азотнокислого серебра за 2 часа, если к раствору приложено напряжение 2 В, а его сопротивление 5 Ом.
· Электролиз проходил в течении 5 минут при силе тока 1,5 А. При этом на катоде выделилось 137 мг некоторого вещества. Что это за вещество?
· Электролизом получено 120 мг меди. Сколько серебра можно получить, если через соответствующий электролит пройдет то же количество электричества?
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.