
Публикация является частью публикации:
Оксиды.
Общая формула ЭхОу-2 , валентность кислорода равна II, степень окисления -2.
Номенклатура оксидов: оксид + название элемента, связанного с кислородом (в родительном падеже), для элементов с переменной валентностью в скобках указать римской цифрой.
Например: Na2O- оксид натрия, СО2 – оксид углерода (IV)
Тривиальные названия оксидов: СaO - негашеная известь ; Al₂O₃ - корунд, кремнезем, боксит; Fe₂O₃ - красный железняк Fe₃O₄ - железная окалина MnO₂ - пиролюзит; N₂O - веселящий газ ; NO₂ - лисий хвост, бурый газ; CO - угарный газ ; CO₂ - углекислый газ CO₂ (тв) – сухой лед ; SiO₂ - кремнезем, песок, ангидрид кремниевой кислоты ; SО2 сернистый газ
Получение: 1. Окислением простых веществ: 2Са + О2 = 2СаО; S+ О2 = SО2 искл оксиды Наl
2. Окислением сложных веществ: 2Н2S +3 О2 = 2SО2 + 2Н2O
3. Разложением некоторых сложных веществ:
а) нерастворимых оснований Fe(OH)2 = FeO + Н2O
б) некоторых кислот (угольной, сернистой, кремниевой, азотной ) Н2СО3= СО2+ Н2O
в) некоторых солей (нерастворимых солей угольной кислоты) МgCO3= МgO + СО2
нитратов 2Pb(NO3)2=2PbO+ 4 NO2+ О2; 2 Ag NO3=2 Ag+2NO2+ О2
сульфатов тяжелых металлов 2 CuSO4=2CuО +2SО2+ О2 ; HgSO4=Hg+SО2+ О2
4.Восстановление кислот- окислителей металлами и неметаллами
С + H2SO4 (к)= 2SО2 + СО2 +2 Н2O
Cu + 4HNO3 (r)= Cu (NO3)2 + 2NO2 + 2Н2O
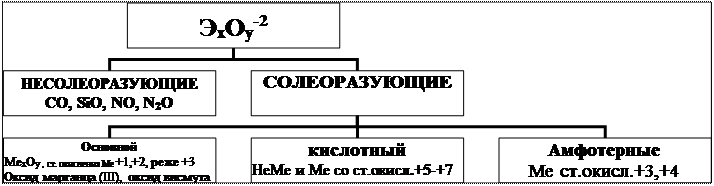
Классификация оксидов по химическим свойствам
Химические свойства
С точки зрения ТЭД оксиды- неэлектролиты.
I. Кислотные оксиды
1. Взаимодействуют со щелочами, образуя соль и воду СО2 + 2NaOH = Na 2 СО3 + Н2O
CrO3 +2KOH= K2 CrO4 + Н2O
2. Взаимодействуют с водой (искл. SiO2), образуя кислоту N2O5 + Н2O = 2HNO3
3. Взаимодействуют с основными оксидами, образуя соль СаО + СО2= СаСО3
4. Взаимодействуют с амфотерными оксидами, образуя соль SO2+ ZnO= ZnSO3
Обратите внимание на NO2 оксид азота (IV)
2NO2 + Н2O= HNO3 + HNO2 2NO2 + 2NaOH = NaNO3 + NaNO2 + Н2O
3NO2 + 2KOH t= 2KNO3 + NO + Н2O 4NO2 + 4KOH + О2 t= 4KNO3 + 2Н2O
II. Основные оксиды.
1. Взаимодействуют с кислотами, образуя соль и воду. FeO + 2HCl= FeCl2+ Н2O
2. Взаимодействуют с водой, образуя растворимые в воде основания только оксиды щелочных и щелочно-земельных металлов Nа2O + Н2O = 2NаOH
3. Взаимодействуют с кислотными оксидами, образуя соль Nа2O+ СО2= Nа2 СO3
4. Взаимодействую с амфотерными оксидами, образуя соль СаО+ ВеО = СаВеО2
III. Амфотерные оксиды
1. Взаимодействуют с кислотами, образуя соль и воду ZnO +2HCl= ZnCl2+ Н2O
2. Взаимодействуют со щелочами, образуя соль и воду ZnO + 2NaOH= Na2ZnO2 + Н2O
ZnO + 2NaOH + Н2O = Na2[Zn(OH)4 ]
3. Взаимодействуют с кислотными оксидами, образуя соль ZnO+ N2O5= Zn (NO3)2
4. Взаимодействуют с основными оксидами, образуя соль ZnO+ СаО=Са ZnO2
IV.Двойные (смешанные ) оксиды
Fe3O4 (FeO Fe2O3) железная окалина
Fe3O4+8 НСl= FeСl2 +2 FeСl3 +4Н2O Fe3O4+8 НI= 3FeСl2 +I2 +4Н2O
V.Окислительно-восстановительные свойства оксидов
Если элемент, входящий в состав оксида имеет переменную степень окисления, то его оксиды с низкими степенями окисления могут быть в ОВР восстановителями, если максимальную степень окисления - то оксид выполняет роль окислителя.
2 СО+ О2 =2 СО2; 2SO2 + О2↔2SO3 ; СО + FeO =Fe + Н2O ; СО + Н2O= Н2+ СО2;
СО2 + С= 2СО СО2 + 2 Mg= С + 2MgO ; 3 СuO +2 NH3=N2 + СО2 +2 Н2O
5CO +2 KMnO4 + 3H2SO4 = 5СО2 +2 MnSO4 + K2SO4 + 3Н2O
SO2 + Н2S =3 S + 2Н2O ; 4 CrO3 +3 S=2 Cr2O3+3SO2
3 C + 4 CrO3= 3 СО2 +2 Cr2O3
N2O + Н2=N2 + Н2O 4 NO + CH4=2 N2 + СО2+2 Н2O
Fe2O3 +KClO3 +4 KOH=2K2FeO4 + KCl +2 Н2O ;
Cr2O3+KClO3 +4 KOH=2K2CrO4 + KCl +2 Н2O
Fe2O3 +4 KOH+3 KNO3=2 K2FeO4 + 3KNO2 + 2Н2O
2Ca(ClO)2 + 2 СО2= 2CaCO3 + 2 Cl2 + О2 Cr2O3 + 3Ca(ClO)Cl + 4NaOH = 2Na2CrO4 + 3CaCl2 + 2H2O
2Cr2O3+ 3О2 +4 Nа2 СO3=4Na2CrO4 + 4 СО2
MnO2 + 4НСl =MnCl2 + Cl2 +2 Н2O MnO2 +2 H2SO4 (конц)=2MnSO4 + О2 + 2 Н2O
MnO2 + K2 CO3 + KNO3 = K2 MnO4 + KNO2 + СО2
MnO2 +2FeSO4 + 2 H2SO4= MnSO4 + Fe2(SO4)3+2 Н2O
MnO2 + 3PbO2 + 6 HNO3 =2HMnO4 + 3Pb(NO3)2 +2 Н2O
MnO2 + KClO3 +6 KOH =3K2MnO4 + KCl +3 Н2O
3 FeO+ 10 HNO3 (разб) =3 Fe2(SO4)3 + NO +5 Н2O
2 Mn (NO3)2 +5 PbO2 + 6 HNO3 =2HMnO4 + 5Pb(NO3)2 +2 Н2O
2 Mn (NO3)2 + PbO2 t=MnO2 + Pb(NO3)2
3 Fe3O4+ 28 HNO3(разб)=9Fe(NO3)3 + NO+14 Н2O
Cu2O + H2SO4 =Cu SO4 + Cu + Н2O Cu2O + 3H2SO4 () =2Cu SO4 + SO2 + 3Н2O
Cu2O + CO= 2 Cu + СО2 Ag2O + Н2O2= 2 Ag + Н2O+ О2
PbO2 +2 Mn(NO3)3 +6 HNO3 = 2HMnO4 + 5Pb(NO3)2 +2 Н2O
Оксиды с органическими веществами
4CrO3 + C2H5OH +6 H2SO4=2 Cr2( SO4)3 +3 СО2 +9 Н2O
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.