
Применение первого закона термодинамики к изопроцессам
1) Изотермическое сжатие
Для вывода 1 закона термодинамики воспользуемся графическим истолкованием работы для процесса ( рис.3)
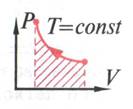
рис.3
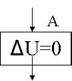
рис.4
Для
изотермического процесса T- const, ![]() T=0, а
значит
T=0, а
значит ![]() U=
3/2 v RT=0 ( внутренняя энергия не изменяется). Над газом совершается
работа А>0, а тепло выделяется Q<0.
U=
3/2 v RT=0 ( внутренняя энергия не изменяется). Над газом совершается
работа А>0, а тепло выделяется Q<0.
Первый закон
термодинамики ![]() U=A+Q
выглядит так:
U=A+Q
выглядит так:
0 = -Q + A
Над газом совершается работа, при этом газ выделяет тепло во внешнюю среду ( внутренняя энергия не изменяется)
А блок –схема 1 закона для изотермического сжатия приведена на рис. 4
2) Изотермическое расширение
Для вывода 1 закона термодинамики воспользуемся графическим истолкованием работы для процесса( рис.6)
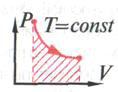
рис.6
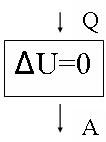
рис.7
Для
изотермического процесса T- const, ![]() T=0, а
значит
T=0, а
значит ![]() U=0 (
внутренняя энергия не изменяется). Газ совершает работу А<0, а тепло
поглощается (Q>0).
U=0 (
внутренняя энергия не изменяется). Газ совершает работу А<0, а тепло
поглощается (Q>0).
Первый закон термодинамики выглядит так:
Q = A
Газ совершает работу за счет поглощения тепла из внешней среды ( внутренняя энергия не изменяется)
Блок - схема первый закона термодинамики для изотермического сжатия представлена на рис. 7
3) Изобарное нагревание.
Воспользуемся интерактивной моделью и (пронаблюдаем изобарное нагревание) ( рис. 8) и графическим представлением работы ( рис. 9)

рис.8
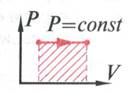
рис.9
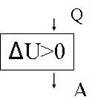
рис.10
При изобарном
нагревании температура увеличивается ( ![]() T>0
), внутренняя энергия увеличивается (
T>0
), внутренняя энергия увеличивается (![]() U>0),
газ совершает работу , тепло поглощается.
U>0),
газ совершает работу , тепло поглощается.
Первый закон термодинамики выглядит так:
Q = ![]() U – A
U – A
Газ получает тепло из внешней среды. Полученная таким образом энергия тратится на увеличение внешней энергии и на совершение работы.
В итоге блок - схема первого закон термодинамики выглядит как на рис.10
4) Изобарное охлаждение
Пронаблюдав процесс изобарного охлаждения на интерактивной модели ( рис.11) и воспользовавшись рис.12 можем сделать вывод:

рис.11
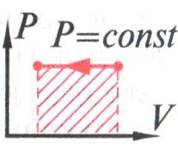
рис.12
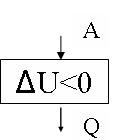
рис.13
при изобарном
охлаждении температура уменьшается ( ![]() T<0
), внутренняя энергия уменьшается (
T<0
), внутренняя энергия уменьшается (![]() U<0),
над газом совершается работа , тепло выделяется.
U<0),
над газом совершается работа , тепло выделяется.
Первый закон термодинамики выглядит так:
![]() U = -Q + A
U = -Q + A
Над газом совершается работа, при этом газ выделяет тепло во внешнюю среду, а его внутренняя уменьшается .
Блок – схема для 1 закона термодинамики для этого случая представлен на рис. 13
5) Изохорное нагревание
Изохорное нагревание пронаблюдаем на интерактивной модели ( рис14) и воспользуемся графиком на рис 15. Вывод:

рис. 14
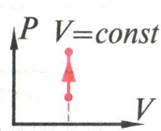
рис. 15
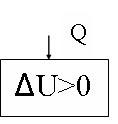
рис. 16
При изохорном
нагревании (![]() T>0
), внутренняя энергия увеличивается (
T>0
), внутренняя энергия увеличивается (![]() U>0)
, работа A=p
U>0)
, работа A=p![]() V равна
нулю, т.к.
V равна
нулю, т.к. ![]() V=0,
а тепло поглощается (Q>0).
V=0,
а тепло поглощается (Q>0).
Первый закон термодинамики выглядит так:
![]() U=Q
U=Q
Газ увеличивает свою внутреннюю энергию за счет теплоты, полученной из внешней среды.
Интерпретация 1 закона термодинамики для изохорного нагревания представлена на рис. 16
6) Изохорное охлаждение
Изохорное охлаждение пронаблюдаем на интерактивной модели ( рис17) и графиком на рис 18. Вывод:

рис. 17
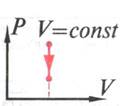
рис. 18
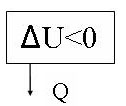
рис. 19
При изохорном
охлаждении (![]() T<0
), внутренняя энергия уменьшается(
T<0
), внутренняя энергия уменьшается(![]() U<0 ,
работа A=p
U<0 ,
работа A=p![]() V равна
нулю, т.к.
V равна
нулю, т.к. ![]() V=0,
а тепло выделяется (Q<0).
V=0,
а тепло выделяется (Q<0).
Первый закон термодинамики выглядит так:
- ![]() U=-Q
U=-Q
Газ выделяет тепло во внешнюю среду; при этом его внутренняя энергия уменьшается.
7) Адиабатное сжатие
Адиабатным называется процесс изменения объема и давления газа при отсутствии теплообмена с окружающими телами.
· Примеры адиабатных процессов:
· сжатие воздуха в воздушном огниве;
· сжатие воздуха в дизеле;
Пронаблюдаем процесс адиабатное сжатие и построение адиабаты на интерактивной модели процесса. ( рис. 20 и рис.21)

рис. 20
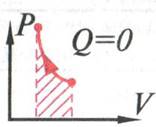
рис. 21
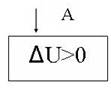
рис. 22
При
адиабатном сжатии температура увеличивается( ![]() T>0
), внутренняя энергия увеличивается (
T>0
), внутренняя энергия увеличивается (![]() U>0),
над газом совершается работа А>0, а количество теплоты равно нулю.
U>0),
над газом совершается работа А>0, а количество теплоты равно нулю.
Первый закон термодинамики выглядит так:
![]() U=A
U=A
Над газом совершается работа, при этом внутренняя энергия газа увеличивается.
8) Адиабатное расширение
Пронаблюдаем адиабатное расширение и построение адиабаты на интерактивной модели процесса. ( рис. 23 и рис. 24 )

рис. 23
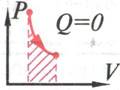
рис.24
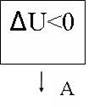
рис.25
При адиабатном
расширении температура уменьшается ( ![]() T<0
), внутренняя энергия уменьшается (
T<0
), внутренняя энергия уменьшается (![]() U<0),
газ совершает работу ( А<0), а количество теплоты равно нулю.
U<0),
газ совершает работу ( А<0), а количество теплоты равно нулю.
Первый закон термодинамики выглядит так:
0= - ![]() U+A
U+A
Газ совершает работу только за счет своей внутренней энергии. ( Внутренняя энергия при этом уменьшается)
Мы познакомились с новым процессом – адиабатным, а для всех процессов записали первый закон термодинамики.
В результате у нас получилась таблица 1
(W) Объяснение учителя: Второй закон термодинамики.
Первый закон термодинамики – закон сохранения энергии для тепловых процессов – устанавливает связь между количеством теплоты Q, полученной системой, изменением ΔU ее внутренней энергии и работой A, совершенной над внешними телами:
|
Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Процессы, нарушающие первый закон термодинамики, никогда не наблюдались. На рис. 3.12.1 изображены устройства, запрещенные первым законом термодинамики.
|
|
|
Рисунок 3.12.1. Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1 |
Первый закон термодинамики не устанавливает направления тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
Приложение- 1
Приложение- 2
|
a) ΔU = Q |
|
b) ΔU = A |
|
c) ΔU = 0 |
|
d) Q = –A |
|
|
|
|
Приложение 1
|
Изопроцесс
|
Постоянный параметр |
Переменные параметры |
Математическая запись закона |
Графики в осях координат
|
1 закон термодинамики |
||
|
p,v
|
T,v |
Т,р |
|||||
|
Изотермии- ческий |
Т |
p,v |
pV = const |
|
|
|
Q=A |
|
Изобарный |
P |
T,v |
v/T= const |
|
|
|
ΔU=Q |
|
изохорный |
V |
p,T |
p/T= const |
|
|
|
Q= ΔU+A
A= ΔU+Q |
|
Адиабатный
|
Q=0 |
V,p |
|
|
|
|
ΔU=A |
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.