
учитель химии МБОУ «Гимназия №44» г. Курска Минакова А.П.

Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем.
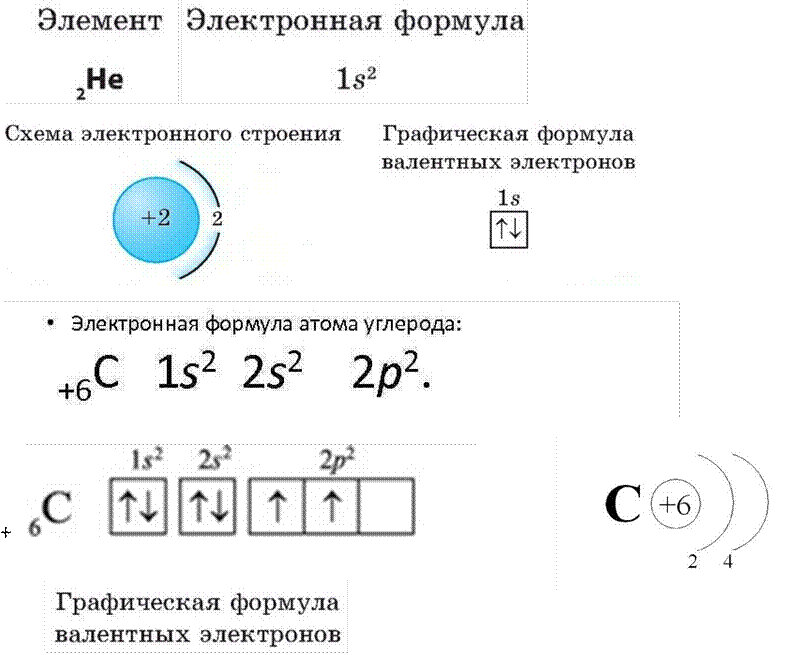
Электронный слой - это совокупность электронов, находящихся на одном энергетическом уровне
Каждый электронный слой (или электронный уровень) имеет свой подуровень, который обозначается строчными латинскими буквами – s, p, d, f и т.д. Число энергетических подуровней на каждом уровне узнать легко – номер уровня показывает число подуровней на нем, например:
1 энергетический уровень содержит только один подуровень – S
2 энергетический уровень содержит два подуровня – S и P
3 энергетический уровень содержит три подуровня - S, p, и d
4 энергетический уровень содержит три подуровня - S, p,d и f
s s, p s, p, d s, p, d, f
 |

 S-орбиталь
р-орбиталь
S-орбиталь
р-орбиталь
d-орбиталь
f-орбиталь
![]() S-подуровень может
занимать только одно положение в пространстве (в центре оси ординат), но
вмещает 2 электрона с разным направлением вращения: по часовой стрелке и
против. Одно положение в пространстве условно обозначают одним
квадратиком, а электроны – стрелочками с разным направлением
S-подуровень может
занимать только одно положение в пространстве (в центре оси ординат), но
вмещает 2 электрона с разным направлением вращения: по часовой стрелке и
против. Одно положение в пространстве условно обозначают одним
квадратиком, а электроны – стрелочками с разным направлением
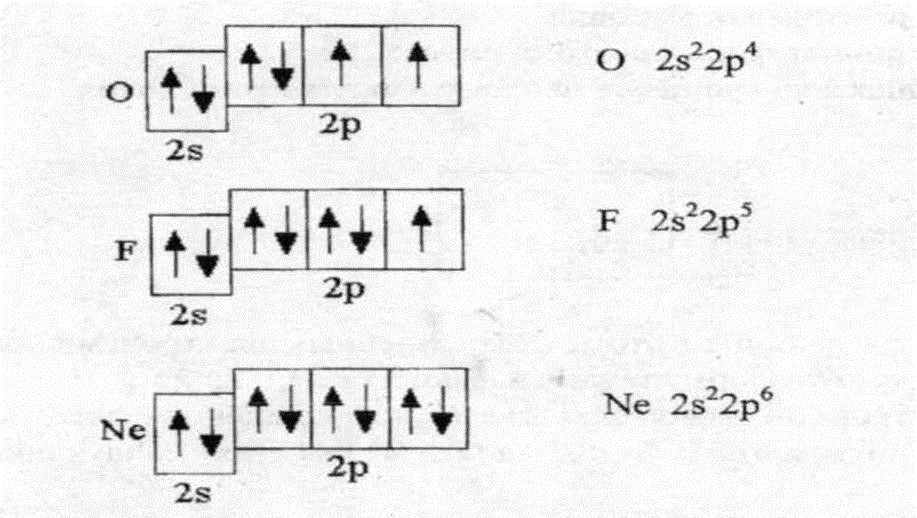
P-подуровень имеет форму гантели или восьмерки, лежащей на боку, и может занять в пространстве три положения: по оси х, у и z.
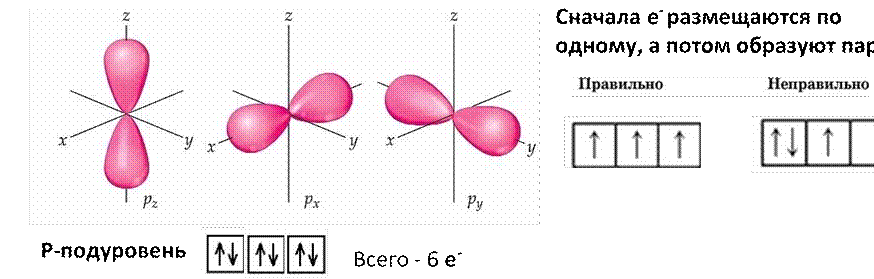
Три положения в пространстве обозначают тремя квадратиками, а т.к. каждая «восьмерка» может вращаться по часовой стрелке и против, то вместить p- подуровень может всего 6 электронов.
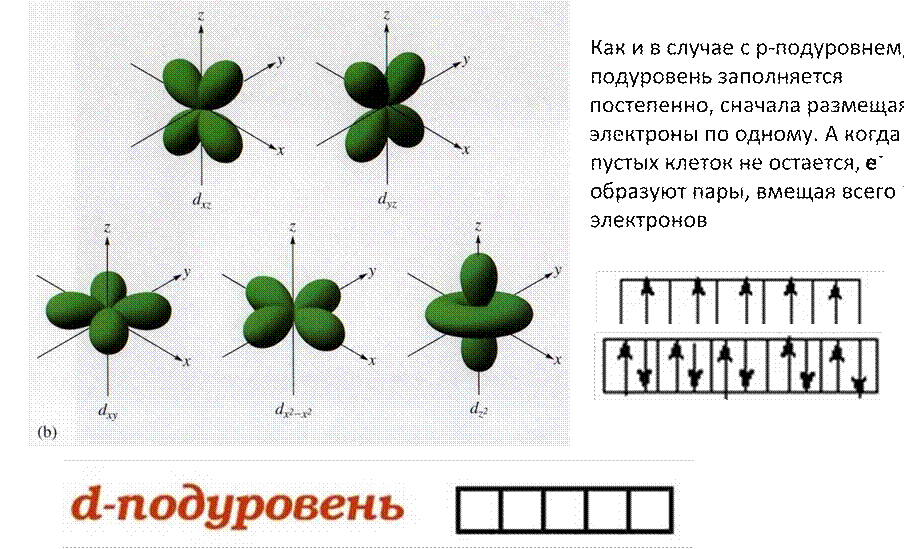
d-подуровень имеет форму двух скрещенных восьмерок и может занимать в пространстве 5 положений
f-подуровень имеет форму трех скрещенных восьмерок и занимает в пространстве семь положений, что мы будем показывать на схеме 7-ю квадратиками

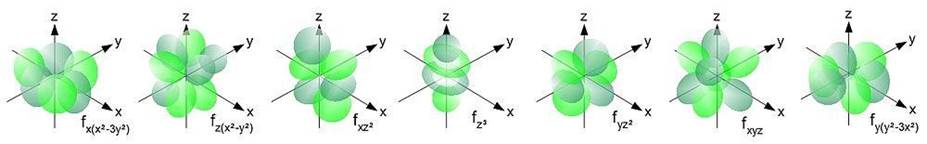
Как и в случае с р-подуровнем и d-подуровнем. F - подуровень заполняется постепенно, сначала размещая электроны по одному. А когда пустых клеток не
остается, e- образуют пары, вмещая всего 14 электронов
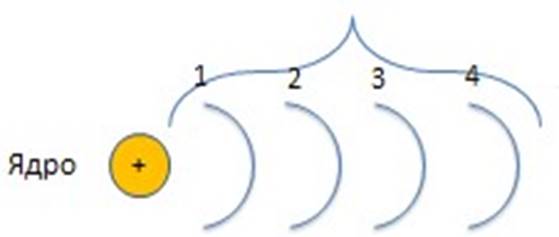
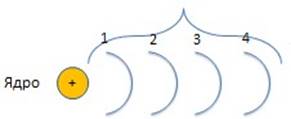
Вернёмся к схеме атома 1 2 3 4

Всего e- на каждом слое s s p s p d s p d f
2 2+6 2+6+10 2+6+10+14
8 18 32
Общее число e- определяют по формуле:

Уровень 1 - 2 e- Уровень 2 – 8 e- Уровень 3 – 18 e-
Уровень 4 – 32 e-
 |
Чтобы составить электронную формулу химического элемента:
1. Находим химический элемент в таблице Д.И. Менделеева
2. Определяем его порядковый номер и период, в котором находится химический элемент
3. Пишем химический знак элемента, слева внизу обозначаем заряд атома со знаком +, соответствующий порядковому номеру элемента
4. Справа большой цифрой пишем номер электронного слоя (равный номеру периода, в котором находится элемент)
5. Рядом с ним указываем подуровень (s,p,d,f)
6. В виде степени указываем число электронов на каждом слое
Например: составьте электронную формулу атома Li
1) Находим химический знак атома лития в периодической таблице

Li находится во 2 периоде, следовательно у него будет 2 электронных слоя, порядковый номер у него 3, следовательно у лития 3 электрона всего
2) Записываем химический знак лития и слева внизу указываем заряд его ядра
(напоминаю, что он равен порядковому номеру со знаком +)
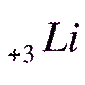
3) Смотрим на схему строения атома и видим, что 1-й электронный слой вмещает только 2 электрона на s- подуровне, пишем возле знака цифру 1 (первый уровень), рядом с цифрой 1 пишем s (подуровень первого слоя), в виде степени записываем цифру 2, это количество e-, которое может вместить s-подуровень

2 8 18 32
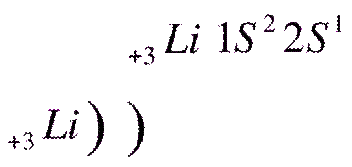
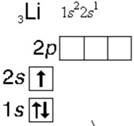 4) Но у
атома лития 3 электрона, а первый электронный слой вмещает только 2 электрона,
поэтому третий электрон идет на следующий 2 слой на s- подуровень и формула
будет иметь вид:
4) Но у
атома лития 3 электрона, а первый электронный слой вмещает только 2 электрона,
поэтому третий электрон идет на следующий 2 слой на s- подуровень и формула
будет иметь вид:
Схема атома лития имеет вид:
2 1 Электронно-графическая формула выглядит так:
![]()
 |
ДОМАШНЕЕ ЗАДАНИЕ
1. Записать конспект по теме
2. Составить схему атомов, графические и электронные формулы следующих атомов химических элементов:
Be, N, Na, Al, Si, P, S, Cl
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.