Разработка урока по химии на тему «Водород, его получение и свойства»( 9 класс, химия)

|
Муниципальное общеобразовательное учреждение «Раменская средняя общеобразовательная школа» РАЗРАБОТКА УРОКА ХИМИИ В 9 КЛАССЕ «Водород, его получение и свойства» (Учебник «Химия. 9 класс» О.С. Габриелян)
Учитель химии Казакова Татьяна Геннадьевна 2018 |
Пояснительная записка к уроку.
Тема «Водород» изучается в курсе химии 9 класса, в разделе «Неметаллы». На данную тему в программе выделяется 1 час. В ходе изучения темы «Водород» обучающиеся должны приобрести следующие: знания: строение, свойства и способы получения водорода;
умения: наблюдать, анализировать, сравнивать, обобщать, делать выводы; результаты:
- личностные: формирование: ответственного отношения к учению, готовности и способности к саморазвитию и самообразованию на основе мотивации к обучению и познанию; устойчивых познавательных интересов; уважительного отношения к труду; осознанного, уважительного и доброжелательного отношения к другому человеку, его мнению;
- метапредметные: умение соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, делать выводы; владение основами самоконтроля, самооценки, принятия решений и осуществления осознанного выбора в учебной и познавательной деятельности; умение преобразовывать знаки и символы для решения познавательных задач; смысловое чтение; умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками, работать индивидуально и в группе, находить общее решение;
- предметные: овладение основами химической грамотности, способностью анализировать и объективно оценивать; приобретение опыта использования различных методов изучения веществ: наблюдения за их превращениями при проведении несложных химических экспериментов с использованием лабораторного оборудования и приборов; формирование представлений о значении химической науки в решении современных экологических проблем, в том числе в предотвращении техногенных и экологических катастроф.
Разработка урока по химии
Тема урока: «Водород, его получение и свойства»
Класс: 9, Учебник «Химия. 9 класс» О.С. Габриелян
Тип урока: комбинированный с изучением нового материала
Вид урока : урок - исследование
Цель урока: систематизация и развитие знаний учащихся о водороде как химическом элементе и простом веществе, о свойствах водорода, способах его получения, роли в природной среде на основе сформированной предметной понятийно-теоретической базы.
Оборудование: магнитная доска, магниты, мультимедийный проектор, презентация, ноутбуки(папка «Водород»), прибор для получения газов, цинк (гранулы), раствор серной кислоты, спички, штатив и пробирки, раздаточный дидактический материал, ватман, фломастеры.
|
Ход урока |
Деятельность учителя |
Деятельность учащихся |
|
1.Организаци онный момент (1 мин.) |
Здравствуйте ребята! Для работы на уроке вам потребуется: учебник, тетрадь, ручка, карандаш,фломастеры, линейка, таблица Д.И. Менделеева, ноутбук, а так же ваше желание получить новые знания. |
Приветствуют учителя. Настраиваются на работу. Отмечаем отсутствующих. |
|
2. Этап подготовки учащихся к активной познавательн ой деятельност и ( 3 мин.) |
На предыдущем уроке мы с вами дали общую характеристику неметаллам и теперь знаем, что в периодической таблице Д.И.Менделеева их всего 22 элемента. Сегодня на уроке, мы продолжим знакомство с неметаллами. И начнем это знакомство с самым первым элементом Периодической системы. Что это за элемент? Правильно. Это «ВОДОРОД»(слайд) Сейчас мы с вами , чтобы познакомиться с удивительным веществом водородом, разделимся на |
Ученики: Водород. |
|
|
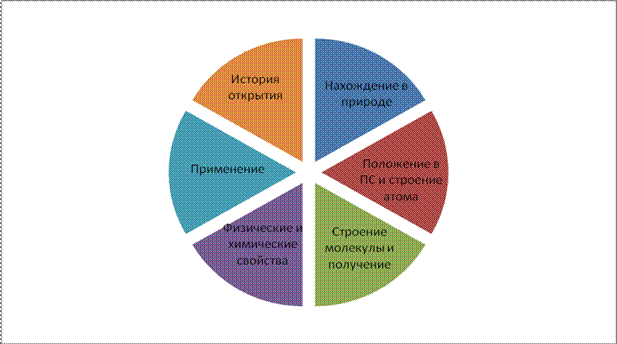
научные лаборатории. Каждая лаборатория получит своё задание и всё необходимое для его выполнения. В результате этой работы вы должны заполнить опорный конспект по теме «Водород, его получение и свойства». И так: Лаборатория №1. Визитка химического элемента (расположение в ПСХЭ Д.И.Менделеева, строение атома). Лаборатория № 2. Открытие водорода и его распространённость. Лаборатория № 3. Получение водорода и его физические свойства. Лаборатория № 4. Химические свойства водорода. Лаборатория № 5. Применение водорода. (слайд) |
Ученики делятся на пять групп. Каждая группа получает задание и всё необходимиое для его выполнения. |
|
3. Операционноисполнитель ский этап (10 мин.) |
На подготовку ответов выделяется 10 минут. Затем слушаем отчеты каждой лаборатории. Во время отчетов каждому следует заполнить опорный конспект, который будет оцениваться в конце урока. (Приложение 3) (Во время подготовки учитель оказывает помощь группам, отдельным учащимся.) |
Работают с предоставленными им материалами и оформляют свой отчёт фломастерами на ватмане(выводы, схемы, реакции и т. д.). После окончания работы ученики каждой лаборатории защищают свой проект у доски (магнитная доска). |
|
4. Этап изучения |
Учитель: (Предлагает представителям от каждой |
|
|
нового материала (20 мин.) |
лаборатории выступить с отчётом о проделанной работе.) И так первыми защищают свой проект учащиеся из лаборатории №1. «Визитка химического элемента (расположение в ПСХЭ Д.И.Менделеева, строение атома)» (слайд) Что общего между водородом и щелочными металлами? Что общего между водородом и элементами главной подгруппы VII группы? Сделайте вывод об |
Ученик: Порядковый номер водорода: 1 Период: 1 Группа: водород занимает две клетки в ПСХЭ Д.И.Менделеева - в главной подгруппе 1 группы – подгруппе щелочных металлов; - в главной подгруппе 7 группы - подгруппе галогенов. - относительная атомная масса-1, - число электронов в атоме - 1, число протонов в ядре - 1, число нейтронов в ядре –0. Схема строения атома: +1, 1е. Электронная формула атома: 1s1.
Ученик: Наличие на внешнем и единственном энергетическом уровне одного электрона в атоме водорода делает его похожим на щелочные металлы. Водород, подобно щелочным металлам, отдает единственный электрон и проявляет степень окисления +1. Ученик. Подобно атомам галогенов, водороду не хватает одного электрона до завершения внешнего энергетического уровня, поэтому он способен присоединить один электрон и проявлять степень окисления -1. Ученик. Водород может проявлять как окислительные так и |
|
|
окислительновосстановительных свойствах водорода. Молодцы! С этой задачей вы справились! И слово предоставляется научным работникам лаборатории №2. «Открытие водорода и его распространённость» (слайд) |
восстановительные свойства.
Ученик: Мы подробно изучили предоставленный нам исторический и научный материал и пришли к следующему выводу. Английский ученый Генри Кавендиш в 1766 г. получил водород действием серной и соляной кислот на цинк, железо или олово. Однако вывод о том, что водород представляет собой вещество, а не «горючий воздух», был сделан только в 1784 г., французским химиком А.Лавуазье, который и дал этому элементу название «рождающий воду» - водо-род. Водород стал первым известным простым газообразным веществом.(слайд) Ученик: Во Вселенной водород является самым распространённым элементом. На его долю приходится около 88,6 % всех атомов. Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака. Именно поэтому водород называют космическим газом. |
|
|
Учитель:Большое спасибо за содержательное выступление и замечательный плакат. И сейчас мы вместе с ребятами из лаборатории №3 узнаем о том, как же можно получить водород в нашем химическом кабинете и в промышленности, а также распознать его и исследуем его физические свойства. «Получение водорода и изучение его физических свойств»(слайд) |
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха). Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %.(слайд) Ученик: Водород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх. Водород обладает |
|
|
|
самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха. Молекула водорода двухатомна — Н2- ковалентная неполярная связь, молекулярная кристаллическая решётка. (Приводится схема образования ковалентной связи в молекуле Н2,а также структурная формула.) При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1. Поэтому перед работой с водородом его проверяют на «чистоту».Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение. Ученик: В лаборатории водород можно получить нескольками способами: 1)взаимодействие кальция с водой: C a + 2H2O → C a(OH )2 + H 2 ↑ 2)гидролиз гидридов: N aH + H2O → N aOH + H 2 ↑ 3)Действие щелочей на цинк или алюминий: 2 A l + 2N aOH + 6 H 2 O → |
|
|
Видеоролик «Демонстрация получения водорода с помощью аппарата Киппа» Учитель: Совершенно верно вы отметили, что при работе с водородом следует соблюдать особую осторожность. Смесь водорода с воздухом или кислородом может взрываться! Вот какая история произошла с французским химиком, директором Парижского музея науки |
2 N a [ A l ( O H ) 4 ] + 3 H 2 ↑ Z n + 2 K O H + 2 H 2 O → K 2 [ Z n ( O H ) 4 ] + H 2 ↑ 4)действием разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту: Z n + H 2SO4 → Z nSO4 + H 2 ↑ (демонстрируют реакцию получения водорода и собирает его в пробирку и проверяют на «чистоту»). Отмечают, что чистый водород сгорает с характерным звуком ПАХ! Ученик:В настоящее время водород в промышленности получают: 1) Из углеводородов: СН4 = С + 2Н2 2)Взаимодействием угля с водой: С + Н2О = СО + Н2 3) Метана с водой: СН4 + Н2О = СО + 3Н2 4) Электролизом воды: 2Н2О = 2Н2 + О2 (Все реакции разбираем как окислительно-восстановительные.) |
|
|
Пилатом де Розье (17561785). Как-то он решил проверить, что будет, если вдохнуть водород. До него никто такого эксперимента не проводил. Не заметив никакого эффекта, ученый решил убедиться, проник ли водород в легкие? Он ещё раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в легких экспериментатора смешался с воздухом и произошел сильный взрыв. “Я думал, что у меня вылетели все зубы вместе с корнями”, — так Розье характеризовал испытанные ощущения. Эксперимент чуть не стоил ему жизни. А сейчас давайте познакомимся с химическими свойствами водорода. И нашему вниманию предоставляют свой отчёт сотрудники лаборатории № 4. «Химические свойства водорода» (слайд) |
Ученик: В начале урока было уже сказано, что водород может быть и восстановителем и окислителем. 1. С простыми веществами (водород восстановитель) 2Н0 + О20 = 2Н2+1О-2 + Q N20 + 3H20 =2N-3H3+1 Cl20 + H20 = 2H+1Cl-1 Реакции водорода с неметаллами используют для получения важнейших химических продуктов – аммиака и |
|
|
Мы познакомились с методами получения водорода, с физическими и химическими свойствами. А зная свойства возможно определить важнейшие области применения водорода. И приглашаются учащиеся лаборатории № 5 «Применение водорода» (слайд) |
хлороводорода. 2. С простыми веществами (водород окислитель) 2Na0 + H20 = 2Na+1H-1 Ca0 + H20 = Ca+2H2-1 При взаимодействии водорода с металлами образуются солеподобные соединения – гидриды (исключение для водорода, когда его степень окисления равна -1). 3.Со сложными веществами (водород восстановитель) Сu+2O-2 + H20 = Cu0 + +H2+1O-2 W+6O3-2 + 3H20 = W0 + +3H2+1O-2 Водород способен восстанавливать металлы из их оксидов в процессе пирометаллургии (видеоролик) (Все реакции разбираем как окислительно-восстановительные.) Ученик: Водород сегодня применяется во многих областях. Структура мирового потребления водорода представлена в следующей таблице: 1.Производство аммиака -54% Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. 2.Нефтепереработка и химическая промышленность- 35% 3.Производство электроники -6% 4.Металлургия и стекольная |
|
|
|
промышленность -3% 5.Пищевая промышленность -2% При производстве саломаса (твердый жир, производимый из растительных масел). Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки E949.
Из-за того, что водород легче воздуха им долгое время наполняли аэростаты, воздушные шары и дирижабли. В настоящее время водород в авиации не используется. В 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость. Водород используют в качестве ракетного топлива. |
|
5. Закрепление нового материала (6 мин.) |
А теперь давайте закрепим наши знания и поработаем со схемой, которая находится у вас на парте (приложение 1)(слайд) и разгадаем кроссворд (приложение 2)(слайд) |
Ученики работают со схемой и отгадывают кроссворд. |
|
6.Рефлексия (3 мин.) |
Что мы узнали о водороде? (Слайд)
Справились с поставленными целями и задачами урока? |
Ученики: цели и задачи урока выполнены. Узнали много новых и интересных исторических фактов об открытии водорода. Смогли получить водород в нашем химическом кабинете |
|
|
Спасибо за урок! |
и изучили его свойства. И узнали о том, что водород применяется в различных областях народного хозяйства. |
|
7.Подведение ттогов (1 мин.) |
Выставление оценок выступающим. Сбор опорных конспектов для проверки. |
|
|
8.Домашнее задание (1мин.) |
п.19,упр.1,3,4,5(стр.142) Составить буклет или презентацию по теме «Водород », консультирует учащихся по выполнению домашнего задания. |
Записывают домашнее задание. |
Литература
1. Габриелян О.С. Химия. 9 класс: учеб. для общеобразоват. Учреждений / О.С.Габриелян. – 2-е изд., стереотип. – М.: Дрофа, 2014.
2. Габриелян О.С издательство «Дрофа» 2012, рабочая тетрадь химия 9 класс Габриелян О.С. издательство «Дрофа» 2012
3. диск «Химия» поурочные планы по учебникам Габриелян О.С. 8-9 классы издательство «Учитель» 2012.
4. Учебно-методическая газета для учителей “Химия” Издательский дом “ Первое сентября”: №10, 24 2008 год: № 2 2009 год.
5. http://www.kmspb.narod.ru./posobie/priem.htm Приемы технологии РКМ.
используя образовательные ресурсы:
http://school-collection.edu.ru/ http://wikischool-ru.livejournal.com/
Приложение 1.
Закрепление нового материала:
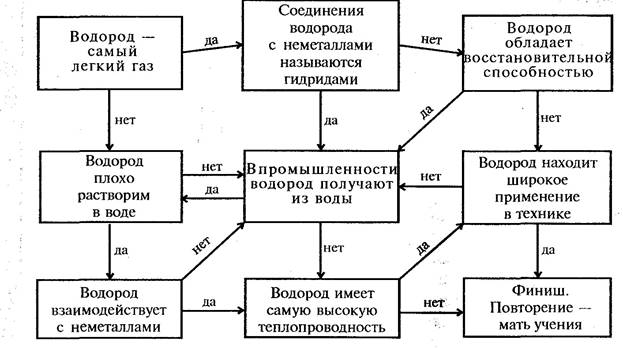
Найдите путь, который приведет вас к финишу. Начните прохождение лабиринта с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжаете путь по стрелке с обозначением «да». Если данное суждение ошибочно, то вам следует продолжить путь по стрелке с обозначением «нет». Для полного усвоения сведений, приведенных в лабиринте, выбирайте в качестве исходных разные клетки лабиринта.
Приложение 2.
Решите кроссворд по теме «Водород»
|
1. |
|
Л |
|
а |
|
в |
у |
а |
з |
ь |
е |
|
|
2. |
н |
е |
й |
т |
р |
о |
н |
|
|
|
|
|
|
3. |
|
г |
|
и |
|
д |
р |
и |
д |
|
|
|
|
4. |
|
к |
и |
с |
л |
о |
р |
о |
д |
|
|
|
|
5. |
|
а |
п |
п |
а |
р |
а |
т |
|
|
|
|
|
6. |
|
|
|
с |
|
о |
л |
н |
ц |
е |
|
|
|
7. |
|
в |
|
о |
|
д |
а |
|
|
|
|
|
По горизонтали:
1.Ученый, который дал элементу «Н» название «водород» - рождающий воду.
2.Какая элементарная частица отсутствует в атоме водорода?
3.Вещество, которое водород образует с металлом.
4.С каким из газов водород образует «гремучую смесь»?
5.Прибор для получения водорода называется ….. Киппа.
6.Какая звезда более чем на половину состоит из водорода?
7.Самое распространенное вещество на Земле, в состав которого входит водород.
По вертикали: ключевое слово - водород
Приложение 3.
Опорный конспект по теме «Водород, его получение и свойства»
Фамилия, имя ученика ………………………….………………….. …………………..
1. История открытия водорода:
………………………….…………………..…………………..………………
………………………….…………………..…………………..……………… ………………………….…………………..…………………..……….…… .
2. Распространённость водорода: составить схему
3. Положение водорода в периодической системе:
порядковый номер: ………………………….………………….………… ; группа ………………………….…………………..…………...............… ; подгруппа ………………………….…………………..…….........……… .
4. Строение атома:
а) Н {……… e, ……… p, ……… n};
б) электронная схема: ...............
в) графическая схема: ........................................
г) степени окисления (подпишите значения на числовой оси):
![]()
5. Строение молекулы водорода:
а) химическая формула: ........................................ ;
б) вид химической связи в молекуле: ........................................ ;
в) схема образования связи: ........................................ ;
г) прочность связи: ........................................ .
6.Физические свойства: составить схему
7. Химические свойства водрода (запишите уравнения реакций, указав условия их протекания, назовите продукты реакций):
а) ........................................ ;
б) ........................................ ;
в) ........................................ .
8. Получение водорода в промышленности и в лаборатории:
а)................................................................................
б) .............................................................................
в)...............................................................................
г)...............................................................................
9. Применение водорода: составить схему
© ООО «Знанио»
С вами с 2009 года.
![]()