
Kimyəvi tarazılıq
Dönən və dönməyən reaksiyalar
• Elə reaksiyalar mövcuddur ki,onlar yalnız bir istiqamətdə baş verir.
• Məs:3Cu+8HNO3→3Cu(NO3)2+2NO+4H2O
• 3Cu(NO3)2+2NO+4H2O →3Cu+8HNO3 reaksiyasının baş verməsi isə mümkün deyil.
• Yalnız bir istiqamətdə baş verən reaksiyalar dönməyən reaksiyalar adlanır.
• Dönməyən reaksiyalar reagentlərdən biri tam sərf olunanadək axıra kimi gedir.
• Dönməyən reaksiyanın qrafik ifadəsi:

• Bir birinin əksi olan olan hər iki istiqamətdə gedən reaksiyalara dönən reaksiyalar deyilir.
• Məs: H2+J2→2HJ
2HJ→H2+J2
Dönən
reaksiyalarda ilkin maddələr və reagentlər arasında ![]() işarəsi qoyulur:
işarəsi qoyulur:
H2+J2![]() 2HJ
2HJ
• Dönən reaksiyalar daha çoxdur.
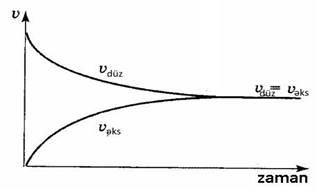
• Düzünə və əksinə reaksiyaların sürətlərinin bərabər olduğu hala tarazılıq halı deyilir.
• Tarazılıq halına kütlələrin təsiri qanununu tətbiq edək:
• H2+J2![]() 2HJ
2HJ
• ![]() =
=![]()
• ![]() =
=![]() 2
2
![]() =K qəbul etsək,
=K qəbul etsək, ![]() alariq.
alariq.
• K-reaksiyanın tarazılıq sabitidir.
• K-düzünə reaksiyanın sürətinin əksinə reaksiyanın sürətindən neçə dəfə çox olmasını göstərir.
• K=1halına dinamik tarazılıq halı deyilir
• K![]() olarsa reaksiya məhsulunun
çıxımı çoxdur K
olarsa reaksiya məhsulunun
çıxımı çoxdur K![]() olarsa reaksiya məhsulunun
çıxımı azdır
olarsa reaksiya məhsulunun
çıxımı azdır

![]() .
.
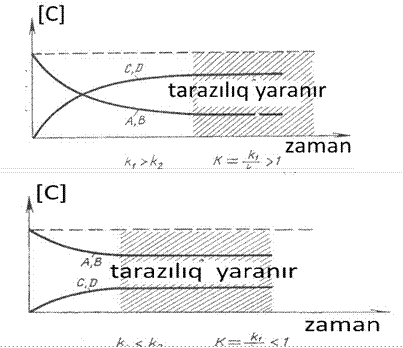
Hər
hansı homogen aA+bB![]() cC+dD reaksiyası üçün
cC+dD reaksiyası üçün
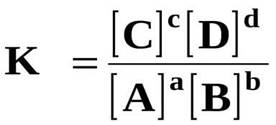
kimidir.
• [A],[B],[C],[D]-tarazılıq qatılıqları,a,b,c,d əmsallardır.
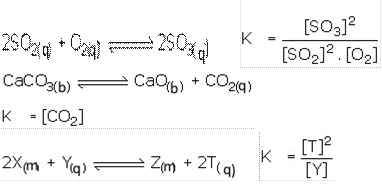
• Bərk və maye fazasında olan maddələr tarazılıq sabiti düstütunda nəzərə alınmır,qaz fazasında olan və suda həll olan maddələr yazılır. Məs:
Tarazılıq sabitinə təsir edən əsas amillər :
• reaksiyaya daxil olan maddələrin təbiəti,maddələrdəki kimyəvi rabitələrin davamlılığı və temperaturdur.
• Tarazılıq sabiti reaksiyaya girən maddələrin parsial təzyiqindən və qatılığından asılı deyil.Bunların dəyişilməsi sabit temperaturda yalnız kimyəvi tarazılığı pozur,tarazılığı sola ya da sağa yönəldir.
• Katalizator tarazılıq sabitinə və kimyəvi tarazılığa təsir etmir. Reaksiyaların dönən olmasının səbəbi
Reaksiyalar baş verərkən a)maksimun nizamsızlığa b)minimum enirjiyə meyilli olurlar.Başqa sözlə kimyəvi reaksiyalar a və b proseləri istiqamətində baş verir.
Hər hansı bir reaksiyada minimum enerjiyə meyillilik reaksiyanın bir tərəfinə(sola,ya da sağa),maksimum nizamsızlıq reaksiyanın digər tərəfinə (sağa ya sola)yönələrsə reaksiya dönən olur. Maksimum nizamsızlıq:
• Mayelər bərk maddələrə nəzərən,qazlar mayelərə nəzərən daha nizamsızdır.
• Mol sayı çox olan qaz,mol sayı az olan qazdan daha nizamsızdır.
• Bərk maddə suda həll olduqda nizamsızlığı artır.
• Qaz suda həll olduqda nizamsızlığı azalır.
Minimum enerji:
• Endotermik reaksiyada sol tərəf,ekzotermik reaksiyada sağ tərəf minimum enerjiyə meyilli tətəfdir.
![]()
reaksiyasında maksimum nizamsızlıq sola doğru,minimum enerji sağa doğru meyllidir.
![]()
reaksiyasında da maksimum nizamsızlıq sola doğru,minimum enerji sağa doğru meyllidir.
•
![]() Tarazılq sabiti tarazılıq
qatılıqlarına görə tapılırsa ,Kc,parsial təzyiqə görə tapılırsa Kp
ilə işarə olunur Kp ilə Kd arasında Kp = Kd.(RT)n asılılığı var.
Tarazılq sabiti tarazılıq
qatılıqlarına görə tapılırsa ,Kc,parsial təzyiqə görə tapılırsa Kp
ilə işarə olunur Kp ilə Kd arasında Kp = Kd.(RT)n asılılığı var.
Kimyəvi tarazılığın yerdıyişməsı.Le-Şatelye prinsipi
• Tarazılıqda olan sistemə xarici təsir göstərmədikdə system tarazılıq halını qeyri-müəyyən vaxt ərzində saxlayır.
• Tarazılıqda olan bir sistemə hər hansı bir xarici təsir göstərildikdə,yaranmiış olan tarazılıq pozulur,yəni sağa,ya da sola yönəlir,təkrar tarazılıq halına gəlmək istəyir.
• Yəni xaricdən edilən təsirə qarşı sistemdə əks təsir yaranır.Bu Le-Şatelye prinsipidir.
• Tarazılıqda olan sistemə xarici təsir göstərdikdə sistemin tarazılığı həmin təsiri zəiflədən istiqamətə yönəlir. 1. Qatılıq
Qatılığın artırılması tarazılığı onun azalması istiqamətinə yönəldər
X2(q)+2Y2(q)![]() Z2(b)+2T2(q)
Z2(b)+2T2(q)
a) Reaksiya tarazılıqda olanda qaba X qazı əlavə etdikdə aşağıdakı dıyişiliklərə səbəb olar:
ü Tarazılıq sağa yönələr
ü T-nin miqdarı və qatılığı artar
ü Z-in miqdarı artar,qatılığı dəyişməz
ü Y-in miqdarı azalar
ü X-in miqdarı əvvəlkindən çox olar
ü K sabiti dəyişməz (yalnız temperatur dəyişiləndə dəyişər)
b) Reaksiya tarazılıqda olanda qabdan bir miqdar Y qazı çıxarılsa,aşağıdakı dəyişiliklər baş verər:
ü Tarazılıq sola yönələr
ü Z və T-nin miqdarı azalar
ü X-in miqdarı artar
ü Y-in miqdarı əvvəlkindən az olar
ü K sabiti dəyişməz
c) Qaba Z bərk maddəsinin əlavə edilməsi isə tarazılıga təsir etməz 2. Təzyiq-Həcm
Təzyiqin artması həcmin azalması deməkdir.Təzyiq artanda tarazılıq mol sayı çox olan tərəfdən mol sayı az olan tərəfə yönələr. Mol sayları eyni olan reaksiyalarda təzyiq- həcm dəyişilməsi tarazılığa təsir etməz.
3. Temperatur
Temperatur K sabitini dəyişirTarazılıq sabiti yalnlz temperature dəyişdikdə dəyişir.Dönən reaksiyalarda istilik elə bil ki sistemə əlavə olunan və ya sistemdən çıxarılan maddədir.Ekzotermik teaksiyalarda istilik sağ tərəfə əlavə olunduğuna görə,temperature artanda tarazılıq sola yönəlir. K sabiti kiçilir.Endotermik reaksiyalarda istilik sol tərəfə əlavə edildiyindən ,temperatur artanda tarazılıq sağa yönəlir,K sabiti böyüyür.
Qeyd 1 : Tarazılıqda olan hər hansı bir reaksiyada katalizatordan istifadə edisə,tarazılıq pozulmaz.Katalizator tarazılığın daha tez yaranmasını və bırpa olunmasını təmin edir.
Qeyd 2 :Tarazılqda olan bir reaksiyaya reaksiyaya daxil olmayan maddə əlavə etdikdə tarazılıq pozulmaz
Şabala Əliyev,Əməkdar müəllim,ali kateqoriyalı kimya müəllimi
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.