
Тема: «НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ – АЛКЕНЫ»
 АЛКЕНЫ
(этиленовые, олефиновые) – непредельные углеводороды, в молекулах которых между
атомами углерода имеется одна двойная углерод-углеродная связь. Общая формула
алкенов СnH2n, где n≥2.
АЛКЕНЫ
(этиленовые, олефиновые) – непредельные углеводороды, в молекулах которых между
атомами углерода имеется одна двойная углерод-углеродная связь. Общая формула
алкенов СnH2n, где n≥2.
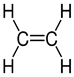
Простейшим представителем алкенов является этен, или этилен С2Н4.
Структурная формула этилена: (сокращенная: СН2=СН2).
Каждый атом углерода в молекуле этилена имеет треугольное строение.
ГОМОЛОГИЧЕСКИЙ РЯД, НОМЕНКЛАТУРА И ИЗОМЕРИЯ АЛКЕНОВ
Как и в случае алканов, два ближайших гомолога алкенов отличаются друг от друга на гомологическую разницу – CH2-.
Название этиленовых углеводородов образуют от названия соответствующих алканов с изменением окончания -ан на -ен. Наряду с систематической номенклатурой для этиленовых углеводородов используют и тривиальное название, в этом случае названия указанных углеводородов принимают окончание -илен. Амилен С5Н10 составляет исключение из этого правила.
|
Алканы |
Алкен |
||
|
структурная формула |
молекулярная формула |
Название |
|
|
СН4 метан |
- |
- |
- |
|
С2Н6 этан |
CH2 |
С2Н4 |
этен (этилен) |
|
С3Н8 пропан |
CH2 |
С3Н6 |
пропен (пропилен) |
|
C4H10 бутан |
CH2 |
С4Н8 |
бутен-1 (бутилен-1) |
|
CH3 –
CH |
бутен-2 (бутилен-2) |
||
|
С5Н12 пентан |
CH2 |
С5Н10 |
пентен-1 (амилен-1) |
|
CH3 –
CH |
С5Н10 |
пентен-2 (амилен-2) |
|
Номенклатура алкенов:
1. Выбрать самую длинную цепь, содержащую двойную связь.
2. Нумерация углеродной цепи начинается с того конца, где ближе расположена двойная связь. При расположении двойной связи в центре цепи нумерацию ведут от атома углерода, к которому ближе разветвление.
3. Основой названия является название алкана с тем же числом углеродных атомов, при этом суффикс «-ан-» меняется на «-ен» (или «-илен»).
4. Положение (цифра) и названия заместителей (радикалов) указываются перед основой названия.
5. Если это необходимо, в конце через дефис указывается атом углерода, при котором находится двойная связь.
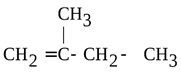 Рассмотрим
пример:
Рассмотрим
пример:
1. Нумерация главной цепи начинается слева направо, так как двойная связь ближе к левой части молекулы.
2. Называем радикал, расположенный у второго атома углерода: 2-метил
3. В главной цепи находится четыре атома углерода, следовательно, она соответствует предельному углеводороду – бутану. Так как присутствует двойная связь, то суффикс – ан меняется на суффикс -ен и указывается положение двойной связи: бутен-1.
4. Соединяем суффикc с корнем и получаем название 2-метилбутен-1.
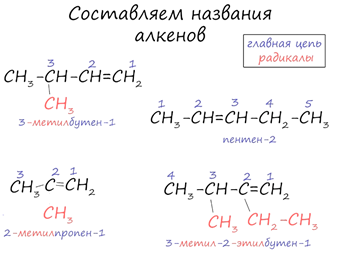 Изомерия алкенов начинается с углеводорода С4Н8
– бутена.
Изомерия алкенов начинается с углеводорода С4Н8
– бутена.
Для алкенов характерны следующие виды изомерии:
1. Изомерия углеродного скелета
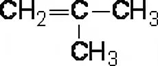 Для бутена
возможно построить единственный разветвлённый изомер – изомер углеродного
скелета – 2-метилпропен.
Для бутена
возможно построить единственный разветвлённый изомер – изомер углеродного
скелета – 2-метилпропен.
2. Изомерия положения кратной связи
При построении структурной формулы бутена возможно расположение двойной связи как между первым и вторым атомами углерода, так и между вторым и третьим, тогда возможно получить две структурные формулы
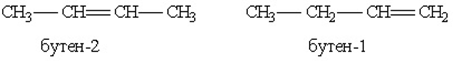
3. Пространственная геометрическая изомерия
Также для бутена-2 возможно существование геометрических изомеров, это связано с тем, что метильная группа СН3- может располагаться относительно плоскости двойной связи в двух разных положениях, что приводит к образованию цис- (если эти группы расположены по одну линию связи) и транс-изомеров (если метильные группы расположены по разные линии связи):
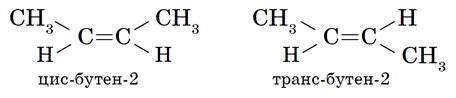
Физические свойства алкенов
При обычных условиях алкены с C2 по С4 – газообразные вещества без цвета и запаха; с С5 по С15 – бесцветные жидкости; с С16 и более – твердые вещества. Алкены не растворимы в воде, однако могут растворяться в органических растворителях. Газообразные алкены образуют с воздухом взрывоопасные смеси. Алкены горят красноватым пламенем, оно более светящееся, по сравнению с алканами.
I. Промышленные способы
1. Крекинг нефти
![]() В результате
крекинга алканов нефти образуется один алкан и один алкен.
В результате
крекинга алканов нефти образуется один алкан и один алкен.
C8H18 → C4H8 + C4H10
2. Дегидрирование алканов
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. В реакциях наиболее легко водород отдает третичный атом, чуть труднее - вторичный и заметно труднее - первичный.

|
! Различают 4 типа атомов углерода: - первичный углеродный атом связан только с одним другим атомом углерода; - вторичный - с двумя атомами углерода; - третичный - с тремя атомами углерода; - четвертичный - с четырьмя атомами углерода. |
|
II. Лабораторные способы
1. Дегидрогалогенирование галогеналканов
Реакция дегидрогалогенирования – это реакция, в результате которой от молекулы органического вещества отщепляется молекула галогенводорода.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен (для бром- и хлорпроизводных алканов).
Правилу Зайцева: водород отщепляется от соседнего наименее гидрированного атома углерода (с меньшим числом атомов водорода).
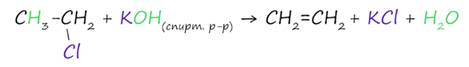
![]()
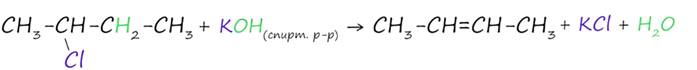
2. Внутримолекулярная дегидратация спиртов
Реакция дегидратации – это реакция, в результате которой от молекулы органического вещества отщепляется молекула воды.
При нагревании спиртов c концентрированной серной кислотой (H2SO4), обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
![]()
![]()
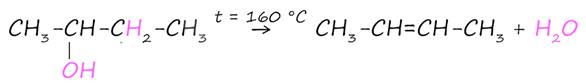
3. Дегалогенирование дигалогеналканов
В подобных реакциях применяется цинк (цинковая пыль) - двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.
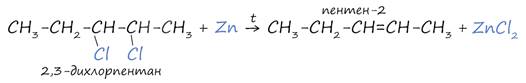
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Алкены вступают в реакции присоединения. Реакции замещения не характерны.
1. Гидрирование алкенов
Водород присоединяется к атомам углерода, образующим двойную связь. Происходит при повышенных значениях температуры и давления, а также в присутствии металлических катализаторов (никель Ni).
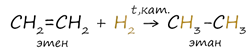
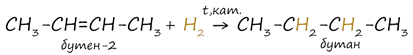
2. Галогенирование алкенов
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
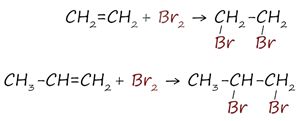

3. Гидрогалогенирование алкенов
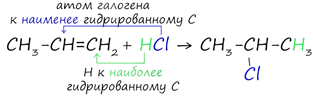
При взаимодействии алкенов с хлорводородом HCl и бромводородом HBr образуются галогеналканы.
Реакция протекает по правилу Марковникова: при присоединении молекул типа HX (X = OH, галогены и т.п.) к алкенам атом водорода присоединяется к наиболее гидрированному атому углерода двойной связи, а атом галогена - к наименее гидрированному атому углерода двойной связи.
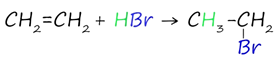
4. Гидратация алкенов
![]() При взаимодействии алкенов с
водой в присутствии катализаторов (серной или фосфорной кислот) образуются
спирты. Присоединение воды происходит также по правилу Марковникова.
При взаимодействии алкенов с
водой в присутствии катализаторов (серной или фосфорной кислот) образуются
спирты. Присоединение воды происходит также по правилу Марковникова.
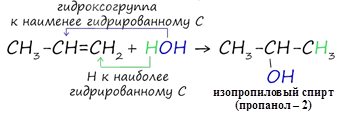 |
|||
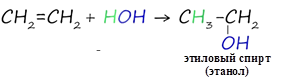 |
|||
5. Окисление (горение)
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды - полное окисление. При неполном окислении образуются окиси.
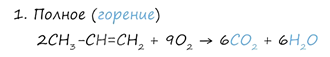
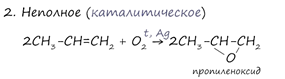
6. Окисление перманганатом калия (марганцовкой KMnO4)
 Пропускание газообразных алкенов через водный раствор KMnO4 при комнатной температуре приводит к обесцвечиванию
раствора (качественная реакция), выпадает осадок бурого цвета -
MnO2.
Пропускание газообразных алкенов через водный раствор KMnO4 при комнатной температуре приводит к обесцвечиванию
раствора (качественная реакция), выпадает осадок бурого цвета -
MnO2.
В результате реакции двойная связь разрывается, и оба атома присоединяют по гидроксигруппе (-ОН-). Соединения такого класса называются гликолями.
![]() 1. Качественная
реакция в нейтральной среде:
1. Качественная
реакция в нейтральной среде:
![]()
![]()
![]()

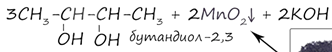
![]()
![]()
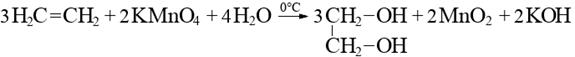
2. Окисление в кислой среде. При подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы - двойной связи, и образованием органической кислоты.
![]()
![]()
![]()
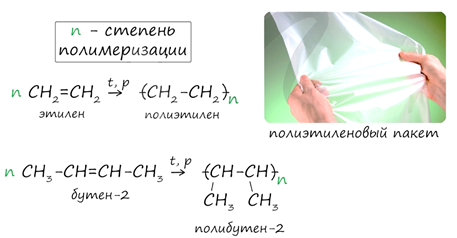
7. Полимеризация
При повышенных значениях температуры и давления в присутствии катализаторов двойные связи молекул алкенов разрываются и атомы углерода соединяются друг с другом с образованием длинных цепочек (полимеров).
Полимеризация - цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n» (степень полимеризации) обозначает число мономерных звеньев, которые входят в состав полимера.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.