
Лекция
«Химическая связь. Виды химической связи»
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
§ Ковалентная химическая связь (может быть полярной и неполярной)
§ Ионная связь
§ Водородная связь
§ Металлическая связь
1. Ковалентная связь
Ковалентная связь - связь между атомами, образованная за счет пары электронов, являющихся общими для двух элементов. Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Ковалентная неполярная связь – это связь, которая образуется между двумя одинаковыми атомами (атомами с равной электроотрицательностью). Пример образование неполярной ковалентной связи смотрите ниже на схеме.
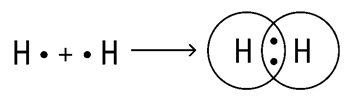
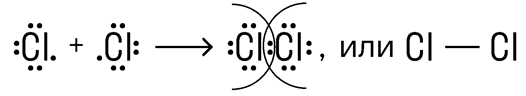
Веществами с ковалентной неполярной связью обычно являются газы (O2, Cl2, H2), жидкости (Br2) или сравнительно низкоплавкие тверды вещества с молекулярной кристаллической решеткой (S, P).
Ковалентная полярная связь – это связь между химическими элементами, которые имеют разную электроотрицательность.
Ярким примером вещества с полярной ковалентной связью является вода, соляная кислота (и другие кислоты), органические вещества. На схеме показано образование ковалентной полярной связи.
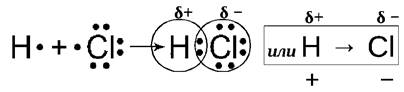
Выделяют следующие механизмы образования ковалентной полярной связи:
- обменный механизм - каждый из атомов отдаёт в общее пользование по одному неспаренному электрону. Обменный механизм представлен на примере соляной кислоты HCl.
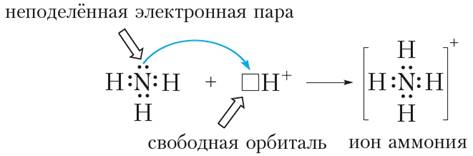
- донорно-акцепторный механизм - связь может быть образована также парой электронов, предоставляемой одним атомом, называемым донором электронов, и вакантной орбиталью другого атома, называемого акцептором электронов. Донорно-акцепторный механизм представлен на примере образования молекулы аммония NH4.
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды (металлы и неметаллы – элементы, существенно отличающиеся электроотрицательностью).
Для веществ с ионной химической связью характерна ионная кристаллическая решетка. Свойствами веществ с ионной решеткой являются кристаллическое строение, растворимость или нерастворимость в воде. Если растворимое вещество в воде, то электропроводность.
Ионная связь характерна для солей (NaCl, CaCO3), оксидов активных металлов (Na2O, СаО), оснований (NaOH).
|
|
|
![Химическая связь — виды, типы [Химия на 5!]](https://fs.znanio.ru/8c0997/93/f7/d2caace22e5a96fbd952dfdb4c1a570479.png) Металлическая связь – связь в
металлах и сплавах, образованная силами притяжения между свободными электронами
и положительно заряженными частицами металла.
Металлическая связь – связь в
металлах и сплавах, образованная силами притяжения между свободными электронами
и положительно заряженными частицами металла.
Способ образования данной связи – обобществление электронов и свободное перемещение их в поле ядер атомов металлов.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее. Свойствами веществ металлов являются металлический блеск, твердое агрегатное состояние, электропроводность, теплопроводность.
Примеры веществ: алюминий, железо и прочие металлы-простые вещества. Сплавы: сталь, латунь и др.
Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, F, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- вода H2O
- аммиак NH3
- фтороводород HF
- органические спирты, кислоты
- белки, ДНК, РНК.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.