
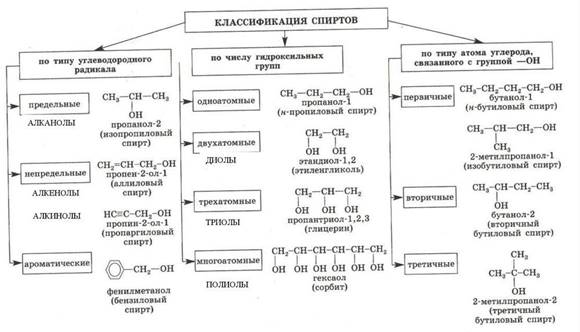
СПИРТЫ
Спирты - кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Классификация спиртов:
1. По типу углеводородного радикала:
- предельные (алканолы)
- непредельные (алкенолы и алкинолы) - ароматические.
2. По числу гидроксильных групп (-OH):
- одноатомные (одна группа OH)
- двухатомные (две группы OH - гликоли) - трехатомные (три группы OH - глицерины) - многоатомные.
3. Одноатомные спирты также подразделяются в зависимости от положения OH-группы:
- первичные (OH-группа у первичного атома углерода)
- вторичные (OH-группа у вторичного атома углерода)
- третичные (OH-группа у третичного атома углерода)
Первый член гомологического ряда предельных спиртов - метанол - CH3OH. Общая формула их гомологического ряда - CnH2n+1OH.
|
Количество атомов углерода |
Корень |
Предельный спирт CnH2n+1 |
Заместительная номенклатура |
Радикально-функциональная номенклатура |
|
С1 |
мет- |
CH3OH |
метанол |
Метиловый спирт (древесный) |
|
С2 |
эт- |
C2H5OH |
этанол |
Этиловый спирт (винный, медицинский) |
|
С3 |
проп- |
C3H7OH |
пропанол |
Пропиловый спирт |
|
С4 |
бут- |
C4H9OH |
бутанол |
Бутиловый спирт |
|
С5 |
пент- |
C5H11OH |
пентанол |
Амиловый спирт |
|
С6 |
гекс- |
C6H13OH |
гексанол |
Гексиловый спирт |
|
С7 |
гепт- |
C7H15OH |
гептанол |
Гептиловый спирт |
|
С8 |
окт- |
C8H17OH |
октанол |
Октиловый спирт |
|
С9 |
нон- |
C9H19OH |
нонанол |
Нониловый спирт |
|
С10 |
дек- |
C10H21OH |
деканол |
Дециловый спирт |
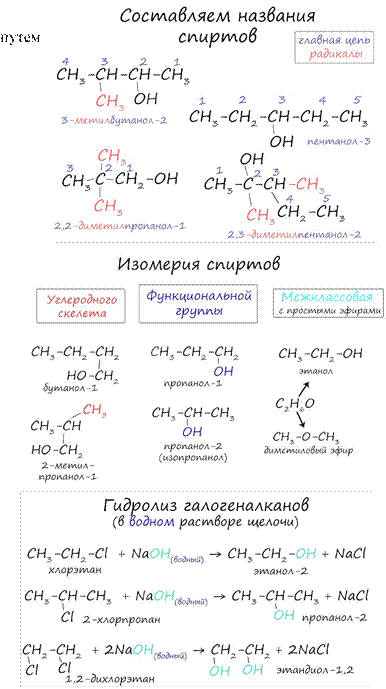 Названия спиртов
формируются добавления суффикса «ол» к названию алкана с
соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол,
пентанол и т.д.
Названия спиртов
формируются добавления суффикса «ол» к названию алкана с
соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол,
пентанол и т.д.
Выбирается самая длинная цепочка, содержащая атом углерода с гидроксигруппой. Атомы углерода нумеруем с конца, ближайшего к гидроксигруппе.
Собирается название – цифра атома углерода с радикалом, название основы, в конце цифра, указывающая расположение гидроксигруппы.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Писвязи (π-связи) - алкены, а в реакциях с водным раствором щелочи образуются спирты.
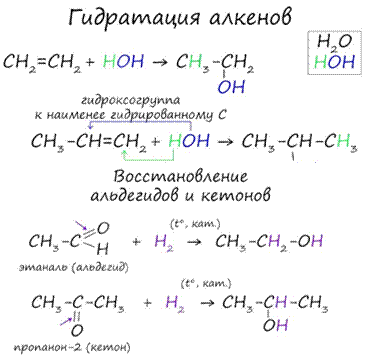
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
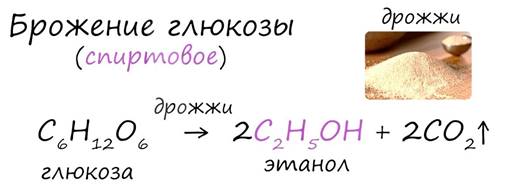
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы - образуется двухатомный спирт (гликоль).
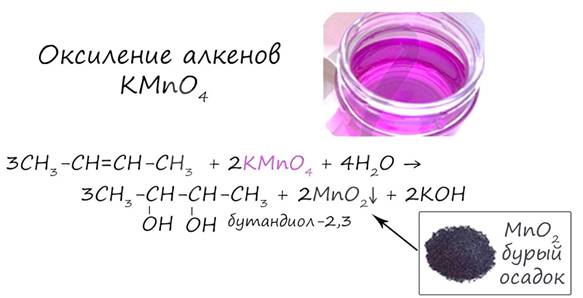
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии - кислотные. 1. Кислотные свойства
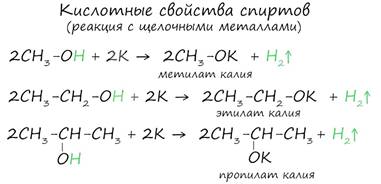 Щелочные металлы
(Li, Na, K) способны вытеснять водород из спиртов с
образованием солей: метилатов, этилатов, пропилатов и т.д.
Щелочные металлы
(Li, Na, K) способны вытеснять водород из спиртов с
образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
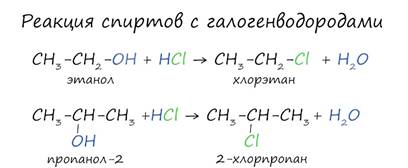 Реакция с
галогеноводородами протекают как реакции обмена: атом галогена замещает
гидроксогруппу, образуется молекула воды.
Реакция с
галогеноводородами протекают как реакции обмена: атом галогена замещает
гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты
(водоотнимающего) компонента.
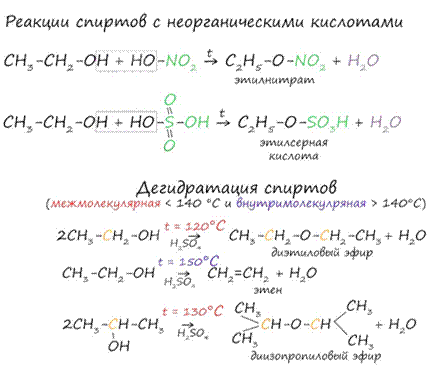 Возможен
межмолекулярный механизм дегидратации (при t < 140°С), в результате которого
образуются простые эфиры. При более высокой температуре (t > 140°С) механизм
дегидратации становится внутримолекулярный - образуются алкены.
Возможен
межмолекулярный механизм дегидратации (при t < 140°С), в результате которого
образуются простые эфиры. При более высокой температуре (t > 140°С) механизм
дегидратации становится внутримолекулярный - образуются алкены.
Названия простых эфиров формируются проще простого - по названию радикалов, входящих в состав эфира. Например:
Диметиловый эфир - CH3-O-CH3
Метилэтиловый эфир - CH3-O-C2H5
Диэтиловый эфир - C2H5-O-C2H5
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.

Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
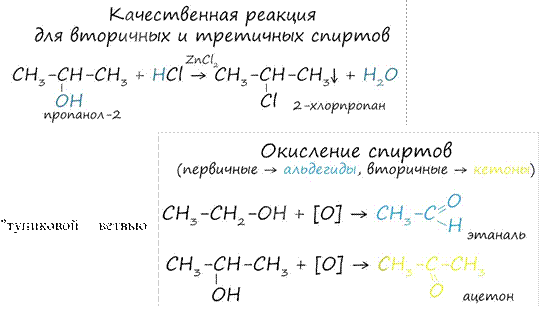 Первичные спирты
окисляются до альдегидов, а вторичные - до кетонов. Альдегиды могут быть
окислены далее - до карбоновых кислот, в отличие от кетонов, которые являются
Первичные спирты
окисляются до альдегидов, а вторичные - до кетонов. Альдегиды могут быть
окислены далее - до карбоновых кислот, в отличие от кетонов, которые являются
развития" и могут только снова стать вторичными спиртами.
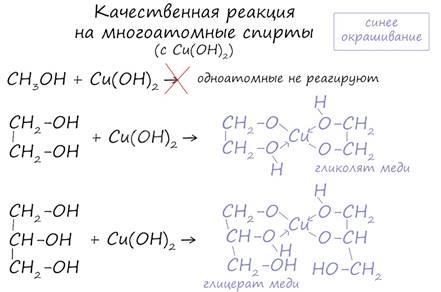
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
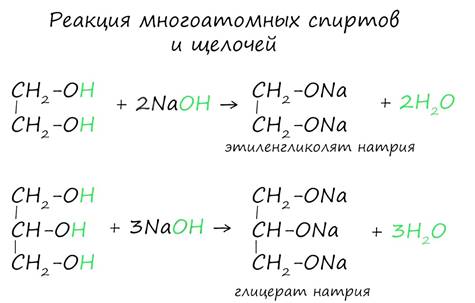
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.