
«НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ – АЛКИНЫ»
Алкины - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда - этин - CH≡CH (ацетилен). Общая формула их гомологического ряда - CnH2n-2.
 НОМЕНКЛАТУРА И
ИЗОМЕРИЯ АЛКИНОВ
НОМЕНКЛАТУРА И
ИЗОМЕРИЯ АЛКИНОВ
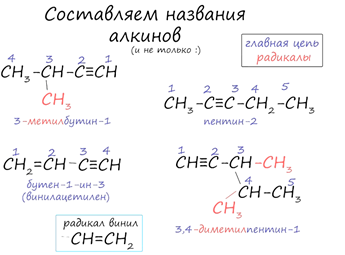
Названия алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь.
Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь.
В конце названия указывают атом углерода у которых начинается тройная связь.
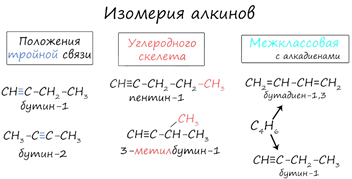 Для алкинов характерна структурная
изомерия (изомерия углеродного скелета, положения тройной связи, межклассовая
изомерия с алкадиенами).
Для алкинов характерна структурная
изомерия (изомерия углеродного скелета, положения тройной связи, межклассовая
изомерия с алкадиенами).
Пространственная геометрическая изомерия для них невозможна ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
ФИЗИЧЕСКИЕ СВОЙСТВА
При обычных условиях алкины с С2 до С4 являются газами, с С5 до С16 – жидкостями, с С17 – твердыми веществами. Чистый ацетилен практически лишен запаха. Ацетилен и его газообразные гомологи образуют с воздухом и кислородом взрывоопасные смеси.
ПОЛУЧЕНИЕ АЛКИНОВ
Ацетилен получают несколькими способами:
1. Пиролиз метана
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
![]() t=1500
0С
t=1500
0С
![]() 2CH4 CH
≡ CH + 3H2
2CH4 CH
≡ CH + 3H2
2. Разложение карбида кальция
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция (II).
CaC2 + 2H2O → CH≡CH + Ca(OH)2
3. Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.
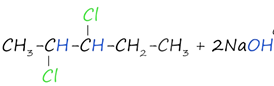
![]()
![]()
ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
Алкины - ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
1. Гидрирование. При повышенных температурах в присутствии катализаторов водород присоединяется к атомам углерода, образующим тройную связь.
t, Ni
![]() CH≡C-CH3 +
H2 CH2=CH-CH3
CH≡C-CH3 +
H2 CH2=CH-CH3
t, Ni
![]() CH2=CH-CH3 +
H2 CH3-CH2-CH3
CH2=CH-CH3 +
H2 CH3-CH2-CH3
t, Ni
![]() CH≡CH + 2H2
CH3-CH3
CH≡CH + 2H2
CH3-CH3
2. Галогенирование
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу. Также происходит обсцвечивание раствора перманганата калия (KMnO4).
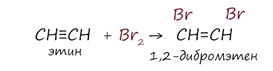
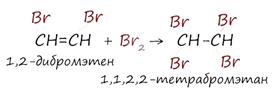
![]()
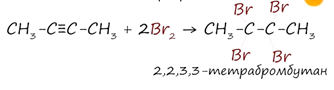
3. Гидрогалогенирование. Гидрогалогенирование протекает по правилу Марковникова. Протекает в присутствии катализаторов -–хлорида или бромида алюминия.
![]()
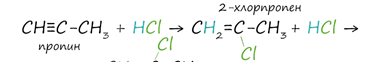
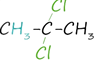
![]()
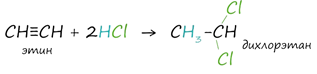
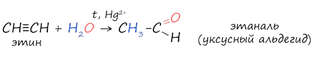
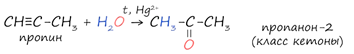
4. Реакция Кучерова
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор - соли ртути Hg2+. Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны (характерной чертой является наличие в их молекулах карбонильной группы ( =С =О).
5. Окисление
При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды - полное окисление. На воздухе алкины горят коптящем пламенем. В кислороде же горение происходит бледно-голубым пламенем.
t
![]() 2CH ≡ CH +
5O2 4CO2 + 2H2O + Q
2CH ≡ CH +
5O2 4CO2 + 2H2O + Q
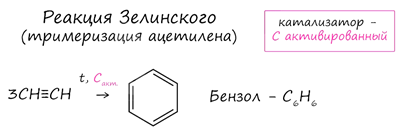
6. Реакция Н.Д. Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.
7. Димеризация ацетилена
При пропускании газообразного ацетилена через раствор солей меди (I) образуется продукт соединения двух молекул ацетилена – винилацетилен (бутен-1-ин-3). Происходит реакция димеризация ацетилена. Получение виниацетилена совершило революцию в промышленности синтетического каучука.
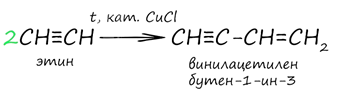
8. Образование солей алкинов
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла (кислотные свойства). Если тройная связь спрятана внутри молекулы, то образование солей невозможно. Продукты замещения можно отнести к классу солей, их называют ацетиленидами.
Реакция аммиачного раствора серебра (с гидроксидом диамминсеребра) и ацетилена - качественная реакция. Признаком реакции служит нерастворимый в воде осадок – цвет осадка ацетиленида серебра белый.

![]()
![]()
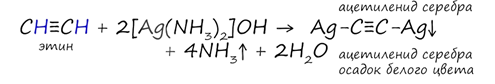
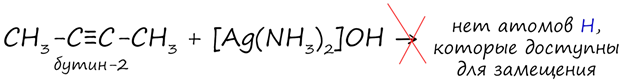
«АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ - АРЕНЫ (Бензол и его гомологи)»
Арены - ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи. Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда - бензол - C6H6. Общая формула их гомологического ряда - CnH2n-6.
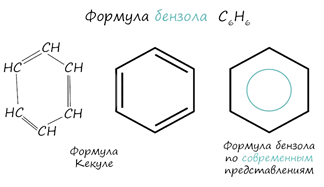 Долгое время структурная
формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными
связями не могла объяснить то, что бензол не вступает в реакции присоединения.
Как уже было сказано выше, по современным представлениям двойные связи в
молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде
кольца. За счет чередования двойных связей в молекуле бензола формируется
сопряжение. Все атомы углерода находятся в состоянии sp2 гибридизации.
Валентный угол - 120°.
Долгое время структурная
формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными
связями не могла объяснить то, что бензол не вступает в реакции присоединения.
Как уже было сказано выше, по современным представлениям двойные связи в
молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде
кольца. За счет чередования двойных связей в молекуле бензола формируется
сопряжение. Все атомы углерода находятся в состоянии sp2 гибридизации.
Валентный угол - 120°.
НОМЕНКЛАТУРА И ИЗОМЕРИЯ АРЕНОВ
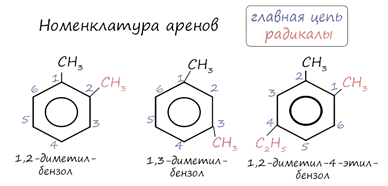 Названия аренов
формируются путем добавления названий заместителей к главной цепи - бензольному
кольцу: бензол, метилбензол (толуол), диметилбензол (ксилол), этилбензол,
пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном
порядке. Если в бензольном кольце несколько заместителей, то выбирают
кратчайший путь между ними.
Названия аренов
формируются путем добавления названий заместителей к главной цепи - бензольному
кольцу: бензол, метилбензол (толуол), диметилбензол (ксилол), этилбензол,
пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном
порядке. Если в бензольном кольце несколько заместителей, то выбирают
кратчайший путь между ними.
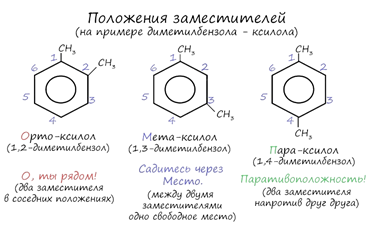
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара.
ПОЛУЧЕНИЕ АРЕНОВ
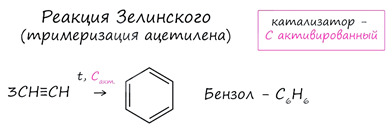 1. Реакция Зелинского
(тримеризация ацетилена)
1. Реакция Зелинского
(тримеризация ацетилена)
 Данная реакция протекает
при пропускании ацетилена над активированным углем при t = 400°C.
Данная реакция протекает
при пропускании ацетилена над активированным углем при t = 400°C.
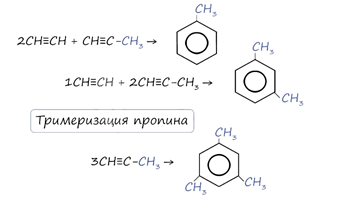
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
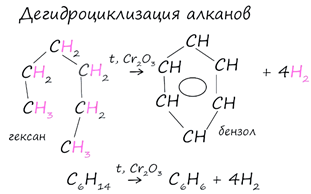 2.
Дегидроциклизация алканов
2.
Дегидроциклизация алканов
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора - Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
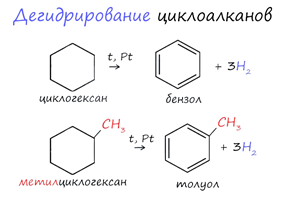
3. Дегидрирование циклоалканов
 В
результате дегидрирования уже «готовых» циклов - циклоалканов, отщепляются 3
моль водорода, и образуется соответствующий арен, с теми же заместителями,
которые были у циклоалкана.
В
результате дегидрирования уже «готовых» циклов - циклоалканов, отщепляются 3
моль водорода, и образуется соответствующий арен, с теми же заместителями,
которые были у циклоалкана.
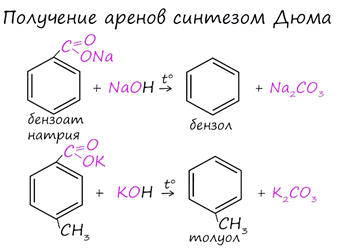
4. Синтез Дюма - Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
ХИМИЧЕСКИЕ СВОЙСТВА АРЕНОВ
Арены - ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими .
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
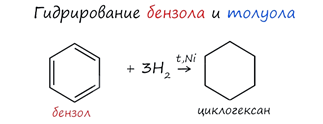
1. Гидрирование - при повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
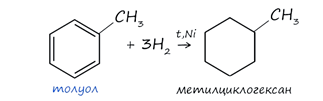
2. Галогенирование
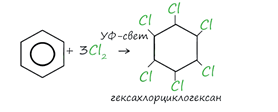
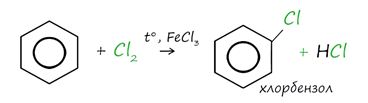 Реакция бензола с хлором
на свету приводит к образованию гексахлорциклогексана, если же использовать
только катализатор, то образуется хлорбензол.
Реакция бензола с хлором
на свету приводит к образованию гексахлорциклогексана, если же использовать
только катализатор, то образуется хлорбензол.
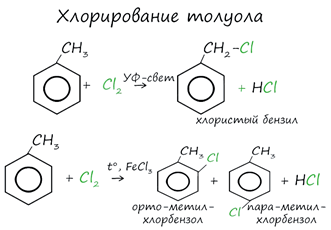
 Реакции с толуолом
протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом
водорода в нем, при действии катализатора хлор замещает один атом водорода в
бензольном кольце (в орто- или пара-положении). Почему хлор направляется именно
в орто- и пара-положения относительно метильной группы? Здесь самое время
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков
(мета-ориентанты).
Реакции с толуолом
протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом
водорода в нем, при действии катализатора хлор замещает один атом водорода в
бензольном кольце (в орто- или пара-положении). Почему хлор направляется именно
в орто- и пара-положения относительно метильной группы? Здесь самое время
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков
(мета-ориентанты).
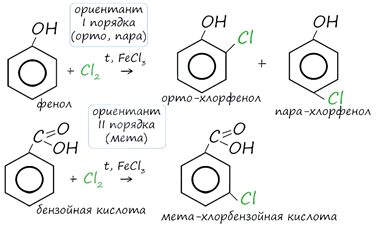
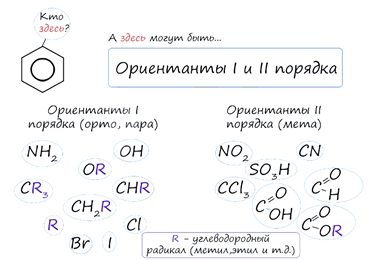
 К ориентантам
первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH2R, галогены.
К ориентантам
первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH2R, галогены.
 К
ориентантам второго: NO2, CN, SO3H, CCl3, CHO,
COOH, COOR.
К
ориентантам второго: NO2, CN, SO3H, CCl3, CHO,
COOH, COOR.
 Например,
ориентант I порядка (гидроксогруппа OH) обеспечивает протекание хлорирования в
орто- и пара-положениях. А карбоксильная группа COOH (ориентант II порядка) обуславливает
хлорирование в мета-положениях.
Например,
ориентант I порядка (гидроксогруппа OH) обеспечивает протекание хлорирования в
орто- и пара-положениях. А карбоксильная группа COOH (ориентант II порядка) обуславливает
хлорирование в мета-положениях.
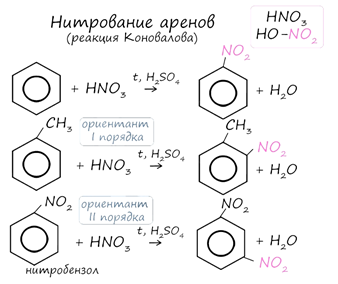
3. Нитрование (реакция Коновалова) - арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
4. Алкилирование
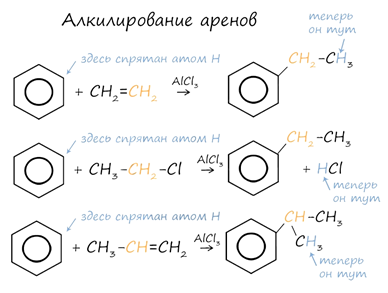 Алкилирование аренов
осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным
радикалом чаще всего выступает алкен или галогеналкан. В подобных
реакциях используют катализатор AlCl3. В случае если для
алкилирования используется алкен, то с молекулой бензола соединяется наименее
гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом
водорода переходит из бензольного кольца к радикалу.
Алкилирование аренов
осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным
радикалом чаще всего выступает алкен или галогеналкан. В подобных
реакциях используют катализатор AlCl3. В случае если для
алкилирования используется алкен, то с молекулой бензола соединяется наименее
гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом
водорода переходит из бензольного кольца к радикалу.
5. Окисление - арены, как и все органические вещества, сгорают с образованием углекислого газа и воды. Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор (на воздухе горит коптящем пламенем).
2C6H6 + 15O2 → 12CO2 + 6H2O
6. Полимеризация - в реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.