
Содержание
1. Информация об опыте 3
2. Календарно-тематическое планирование 8
3. Тема 1 Распределение электронов в атоме 12
4. Тема 2 Энергетические уровни 16
5. Тема 3 Образование ионов 26
6. Тема 4 Составление формул соединений 33
7. Тема 5 Расчеты по химическим формулам 38
8. Тема 6 Составление уравнений
химических реакций 45
9. Тема7Типы химических реакций 51
10. Тема8 Химические реакции в природе и жизнедеятельности живых организмов 59
11. Тема 9 Закон Авогадро 66
12. Тема 10 Относительная плотность газов 76
13. Тема11 Стехиометрические расчеты 83
14. Тема 12 Свойства углерода 89
Уважаемые учителя! В данной методической разработке приводятся примеры практико-ориентированных заданий для 8-го класса с целью развития функциональной грамотности у школьников 15-летнего возраста. На своих уроках я часто использую такие задания. В каждом из заданий описываются жизненные ситуации близкая и понятная ученикам. Каждое задание содержит задачу решаемую с помощью имеющихся знаний. Информация предъявляется в текстовом и нетекстовой форме (таблицы, схемы, простые столбчатые диаграммы).
Современному школьнику необходимо усвоить большой объем информации, сохранив при этом целостное восприятие мира.
Данное пособие содержит подробные конспекты уроков по химии, интегрированные с заданиями естественно-научной грамотности, международного исследования PISA.
Бабкова Лика Викторовна
информация об опыте
Бабкова Лика Викторовна учитель химии школы- гимназии №1 педагогический стаж 21 год, категория «педагог – модератор».
Тема педагогического опыта «Развитие функциональной грамотности на уроках химии».
Актуальность работы: актуальность данной исследовательской работы нахожу, в том, чтобы повысить мотивацию обучения химии через применения в своей работе задач прикладного характера, необходимых в повседневной жизни и подготовить 15-летних школьников к международному исследованию PISA, активизировать их познавательную активность на уроках химии. Повысить интерес к естественно-научной грамотности через творческий подход в изучении химии.
Функциональная грамотность – тот уровень образованности, который может быть достигнут учащимися за время обучения в основной школе, и предполагает способность человека решать стандартные жизненные задачи в различных сферах жизни и деятельности на основе преимущественно прикладных знаний, т.е. социализацию личности. Обозначив одним из приобретённых направлений образовательной деятельности социализации личности ребенка, я работаю над внедрением заданий PISA в календарно-тематическое планирование и краткосрочное планирование на уроках химии в 8-м классе.
Цель работы: поделиться опытом работы по развитию естественно-научной, функциональной грамотности школьников на уроках химии.
Согласно такому представлению функциональной грамотности, ее диагностика включает в себя:
- Процесс овладения грамотностью - освоение химического языка и химических знаков, без которых невозможно получение химической информации и использование знаний в той или иной сфере жизни и деятельности.
- Процесс обучения освоение знаний, умений и навыков по предмету и учебным дисциплинам.
3.Процесс подготовки к исследованию PISA это прежде всего, адаптация имеющихся и получаемых знаний, умений и навыков для выполнения практических и лабораторных работ, использование алгоритма при решении задач и развития читательской грамотности, математической грамотности и естественно-научной грамотности, внедрять творческие задания в различных жизненных ситуациях и тем самым подготовить ученика как всесторонне развитую личность, готовую к проблемным ситуациям в жизни.
Сегодня, на уроке, важно уметь решать реальные жизненные проблемы и самостоятельно работать с информацией, таблицей, графиком или рисунком. В основе исследования PISA лежат задания, для решения которых, мало просто знать, факты и правила. Нужно еще уметь их использовать в жизни. Сложность для школьников, в том что, дети не умеют работать с информацией, представленных в виде различных блоков. Проблема учеников в том, что ученики не определяют формат задания, бывает так, что дети не используют научные методы, а задействуют собственную интуицию, а стараются просто угадать. Проблема школьников в том, что они не умеют привлекать данные, которые не содержаться непосредственно в условиях задания.
Понятие естественнонаучной грамотности пришло из международного сравнительного исследования PISA. В рамках этого исследования оценивается функциональная грамотность, включая читательскую, математическую, естественно-научную.
Для формирования оценки естественнонаучной грамотности используются тематические блоки, которые включают описание реальной ситуации и задания, связанные с этой ситуацией. Каждое из заданий характеризуется следующими признаками: компетентность (как правило умение составляющее данную компитентость), естественно-научные знания (т.е. те знания из биологии, физики, химии, или физической географии, которые необходимы для выполнения задания); контекст (т.е. характеристика жизненной ситуации, использующейся в задании); уровень сложности. В разработке приведены примеры заданий для внедрения их в поурочные планы учителей химии с целью определять уровень развития естественно-научной грамотности учащихся. С этой целью предлагаю вашему вниманию краткосрочное планирования для 8-го класса и задачи для внедрения их в ход урока.
Задачи работы:
1.Анкетирование учащихся и учителей школы с целью выявить проблемы и определить их решения, при подготовки к международному исследованию PISA это установление и оценка степени овладения обучающимися, получившими общее среднее образование, знаниями и умениями необходимыми для полноценного функционирования в обществе. Выявить чувство тревожности и адаптации в ходе данного исследования.
2.Задача моей работы в том чтобы помочь учителям и ученикам в развитии навыков решения творческих задач и навыков поиска информации, анализа и интерпретации в ходе решения заданий PISA.
3.Развивать умения применять полученные знания в современной жизни, полученные знания использовать на примерах обычной, повседневной жизни, обратить внимание учеников на степень их сформированности и умении учиться.
4.Провести собственный внутришкольный мониторинг, готовности 15-летних школьников к международному исследованию.
5.Разработать и внедрить теоретические и практические задания адаптированные в исследовании PISA, для изучения на уроках химии похожих вопросов и задач прикладного характера в 8-м классе; разработать краткосрочное планирования всех разделов календарно-тематического планирования по программе 8-го класса, общеобразовательной школы.
Таким образом, одной из задач современного образования, это разработка учебно- методических материалов направленных на формирование у учащихся навыков, необходимых выпускникам школ для активной жизни в современном обществе, а также необходима организация мониторинга формирования способности применять полученные знания для решения различных учебных и практических задач .При этом при решении заданий в структуре функциональной грамотности, является осознание обучаемым значимости решаемой проблемы для себя лично.
Задача учителя – создать условия для самостоятельной познавательной деятельности обучающихся массовое внедрение проблемного обучения и проектного метода, групповой и коллективной работы на уроке, использование электронных образовательных ресурсов, технических средств. Функциональная грамотность – понятие мета предметное и поэтому она формируется при изучении разных школьных дисциплин и имеет разнообразные формы проявления: языковая грамотность, математическая грамотность, естественно-научная грамотность, цифровая грамотность, финансовая, культурная и гражданская грамотность. Все виды грамотностей направлены на формирование ключевых компетенций обучающихся, позволяющих школьникам решать сложные задачи: критическое мышление, креативность, коммуникативность, сотрудничество в решении проблем. Как школьники решают задачи в новых условиях -формируют такие черты как любознательность, инициативность, социальная и культурная осведомленность, упорство, лидерство.
Календарно-тематическое планирование химия 8 класс
|
№ |
Темы/Содержание раздела ДСП |
Дата |
Прим |
Цели обучения |
Кол-во часов |
Домашнее задание |
|
1-четверть 8.1А Движение электронов в атомах |
|
|||||
|
1 |
Распределение электронов в атомах
|
|
|
8.1.3.1 -понимать, что электроны в атомах распределяются последовательно по энергетическим уровням на возрастающем расстоянии от ядра |
1 |
§1 упр 1-8 |
|
2 |
Энергетические уровни. Лабораторный опыт № 1 «Изготовление моделей атомов» |
|
|
8.1.3.2 -понимать, что число электронов на каждом энергетическом уровне не превышает определенного максимального значения 8.1.3.3 -знать форму s и p орбиталей 8.1.3.4 -уметь писать электронные конфигурации и электронно-графические формулы первых 20 химических элементов |
1 |
§2 упр 1-5 |
|
3 |
Движение электронов в атоме
|
|
|
8.1.3.3 -знать форму s и p орбиталей 8.1.3.4 -уметь писать электронные конфигурации и электронно-графические формулы первых 20 химических элементов |
1 |
§3 упр 1-5 |
|
4 |
Образование ионов |
|
|
8.1.3.5 -понимать, что атомы могут принимать или терять электроны, что приводит к образованию ион |
1 |
§4 упр 1-4 |
|
5 |
Составление формул соединений |
|
|
8.1.3.6 -составлять формулы соединений методом «нулевой суммы» |
1 |
§5 упр 1-8 |
|
8.1В Формулы веществ и уравнения химических реакций |
|
|||||
|
6 |
Определение массовых долей элементов в соединениях |
|
|
8.2.3.1 -вычислять массовые доли элементов в составе вещества, выводить формулы веществ по массовым долям элементов |
1 |
§ 6 упр 1-3 стр 24 |
|
7 |
Закон сохранения массы веществ Демонстрация № 1 «Опыт, доказывающий закон сохранения массы веществ». |
|
|
8.2.3.4 -знать закон сохранения массы веществ 8.2.3.2 -устанавливать экспериментальным путем соотношение реагирующих веществ
|
1 |
§7 упр 1-6 стр 27 |
|
8 |
Составление уравнений химических реакций |
|
|
8.2.3.3 -составлять уравнения химических реакций, записывая формулы реагентов и продуктов реакции |
1 |
§8 упр 1-5 |
|
9 |
Составление уравнений химических реакций |
|
|
8.2.3.3 -составлять уравнения химических реакций, записывая формулы реагентов и продуктов реакции |
1 |
§8 упр 1-5 |
|
10 |
Типы химических реакций |
|
|
8.2.2.1 -классифицировать химические реакции по числу и составу исходных и образующихся веществ |
1 |
§9 рис 19, упр1-7 |
|
11 |
Типы химических реакций |
|
|
8.2.2.1 -классифицировать химические реакции по числу и составу исходных |
1 |
§9 упр 1-7 |
|
12 |
Химические реакции в природе и жизнидеятельности живых организмов |
|
|
8.2.2.2 -описывать химические реакции в природе и жизнедеятельности живых организмов и человека |
1 |
§10 упр 1-9 |
|
Раздел: |
8.1А Движение электронов в атомах |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Распределение электронов в атомах |
|
|
Цели
обучения в соответствии |
8.1.3.1 -понимать, что электроны в атомах распределяются последовательно по энергетическим уровням на возрастающем расстоянии от ядра |
|
|
Цели урока |
-установить характер изменений строения и свойств элементов в периодах и группах Определяет изменения свойств атомов элементов в периоде по их строению |
|
|
|
Ход урока |
|
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
||||||||||||
|
Начало
урока |
Просмотр видео « Что такое атом?» Вызов: Как происходит изменение свойств атомов элементов группах и периодах?
|
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
видео «Что такое атом»
https://www.youtube.com/watch?v=9t2EIQhPc54 |
||||||||||||
|
Середина урока 20 мин
|
Работа с терминами Работа в группе по стратегии «Посол». Каждой группе дается задание ознакомиться со своей частью темы, обсудить в группе, поделиться прочитанным, затем группы обмениваются своими участниками и слушают пересказ каждого ученика, пришедшего из другой группы 1-я группа. Строение атома 2-я группа. Распределение электронов в атоме |
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах |
5 баллов |
Карточки |
||||||||||||
|
Конец урока 10 мин |
1.На каждом энергетическом уровне в атоме может находиться максимальное число электронов. a)Запишите формулу для вычисления количества электронов . b)Назовите, электронное строение, какого элемента изображено на рисунке
с) Используя формулу (задание 1(а)), заполните таблицу по образцу:
Дескриптор: −записывает формулу расчёта количества электронов; −определяет элемент по электронному строению; −определяет энергетический уровень; −определяет максимальное число электронов на энергетическом уровне; −приводит примеры.
|
Выполняют задания для ФО |
3 балла |
Карточки |
||||||||||||
|
Рефлексия 5 мин |
Обратная связь:
: |
Обратная связь, комментарии учителя и учащихся |
|
Текст |
Задание естественно-научной грамотности
Задание «Почему снег скрепит под ногами?»
Запишите
свой ответ на вопрос.
Почему снег скрипит под ногами?
Снег заскрипел под ногами–значит, мороз крепчает» -часто говорите вы. А почему снег скрепит под ногами?
Когда мороз слабый, снежинки под ногами неслышно спрессовываются и тают, а потом ломаются. Каждая снежинка при этом издает очень слабый, почти неуловимый звук. Но если мы наступаем сразу на множество тысяч снежинок, то чуть слышимые звуки сливаются в громкий скрип. Ученные подсчитали, что если на одну чашу весов положить копеечную монету, то на другую –для равновесия – придется поместить около 10 тыс. снежинок.
________________________________________________________________________________
Запишите свой ответ.
|
Раздел: |
8.1А Движение электронов в атомах |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Энергетические уровни. |
|
|
Цели обучения в соответствии |
8.1.3.2 -понимать, что число электронов на каждом энергетическом уровне не превышает определенного максимального значения 8.1.3.3 -знать форму s и p орбиталей 8.1.3.4 -уметь писать электронные конфигурации и электронно-графические формулы первых 20 химических элементов |
|
|
Цели урока |
- учащиеся будут объяснять строение атома и энергетических уровней элемента; - описывать распределение электронов по уровням; - создавать модель электронных оболочек атома и рисовать формы электронных облаков |
|
Ход урока
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценив |
РесРесурсы |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Начало
урока |
Вызов. Дайте ответы на поставленные вопросы (работа в парах- обсуждение вопросов, индивидуальный опрос) 1. Из каких элементарных частиц состоит атом? 2. Какие элементарные частицы называют протонами? 3. Какие элементарные частицы называют нейтронами? 4.Какие элементарные частицы называют электронами? 5. Почему модель строения атома называют планетарной? При изучении какого предмета кроме химии, вы встречались со строением атома? 6.Отгадайте, о какой элементарной частице идет речь? а) Очень положительный С
массою внушительной, б)
Зарядом я похвастать не могу, в)
Он бежит по проводам, |
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Середина урока 20 мин
|
Работа с терминами Метод «Остановка автобуса»: По представленным постерам учащиеся пишут свои мнения по содержанию текста, затем передают свои записи участникам другой группы. Они дополняют информацию своими идеями и передают далее. Таким образом происходит дополнение мысли и процесс обмена информацией Дескрипторы: – полностью усваивают текст; – определяют что число электронов на каждом энергетическом уровне не превышает определенного максимального значения |
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах |
5 баллов |
Карточки |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Конец урока 10 мин
|
Задание 1. На рисунке изображено размещение электронов на энергетических орбиталях
Используя данный рисунок, заполните пустые клетки таблицы:
Дескриптор: −вычисляетмаксимальное количество электронов на энергетическом уровне; −определяет элемент по числу электронов. Задание 2.
1.Электронное строение соответствует элементу, атома . 2.Электронное строение соответствует элементу, атома с наибольшим или наименьшим радиусом 3.Электронное строение соответствует элементу третьего периода . 4.Определите элементы, которые имеют соответствующее электронное строение: A -B -C -D -E - 5.Элементы какой группы приведены в данной таблице? Дескриптор: −определяет элемент по числу электронов; −определяет элемент по электронному - строению в периодической системе |
Выполняют задания для ФО |
3 балла |
Карточки |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Рефлексия 5 мин |
Подведение итога урока. Прием « 5-5-1» Учащиеся пишут 5 предложений о том, что они освоили на уроке. Затем, сокращают эти 5 предложений до 5 слов. В конце сокращают эти 5 слов до одного. Учащиеся делятся свои ми ключевыми словами со всем классом.
|
Обратная связь, комментарии учителя и учащихся |
|
Карточки, стикеры, дерево успеха |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Задание естественно научной грамотности :
Задание «Строение атома»
1.
Что будет если из стула убрать все
атомы? ![]()
2.
При помощи «меченых атомов» советские ученые установили, что
средняя скорость передвижения воды из корня по стволу и ветвям растений 4 мм/с.
Уточните, как это было сделано и определите, за сколько времени после полива
вода достигнет верхушки метрового комнатного растения. 
Поясните свой ответ при изучении темы «Строения атома»____________________________________
|
Раздел: |
8.1А Движение электронов в атомах |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Энергетические уровни. Лабораторный опыт № 1 «Изготовление моделей атомов» |
|
|
Цели
обучения в соответствии |
8.1.3.2 -понимать, что число электронов на каждом энергетическом уровне не превышает определенного максимального значения 8.1.3.3 -знать форму s и p орбиталей 8.1.3.4 -уметь писать электронные конфигурации и электронно-графические формулы первых 20 химических элементов |
|
|
Цели урока |
- учащиеся будут объяснять строение атома и энергетических уровней элемента; - описывать распределение электронов по уровням; - создавать модель электронных оболочек атома и рисовать формы электронных облаков |
|
|
|
Ход урока |
|
|
|
|
|
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
|||||||||||||||||||||
|
Начало урока |
Вызов. Тест на знание количества электронов первых 20-ти ХЭ ПС. «У меня 7 электронов – кто я ?» (Ответ: Азот) «Мой символ Si - кто я?» (Ответ: Кремний ) « Моя подруга живет в квартире №16, её имя - ?» (Ответ: Сера) У меня 20 нейтронов и 20 электронов , а живу я в подъезде номер ?» (Ответ: Кальций) «Я – фосфор, подскажите сколько у меня электронов» (Ответ: 15) |
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2 балла |
|
|||||||||||||||||||||
|
Середина урока 20 мин
|
Работа с терминами ( дописывают термины на других языках) Работа в группах Задание: составьте схемы распределения электронов 1 группа: С, Са, О, Cl 2 группа: N, Ne, K, Ar 3 группа: Na, F, S, P Взаимопроверка работ группами по ключам ответов. Дополнительный вопрос классу: Могут ли на одном и том же энергетическом уровне находиться электроны с различной формой облаков? (Ответ: Да, но эти электроны отличаются друг от друга энергией связи с ядром). Выполнение лабораторного опыта № 1 «Изготовление моделей атомов» Цель работы: определять число электронов в атомах первых 20 элементов; использовать знания о строении атома для того, чтобы изготовить модель распределения электронов в атоме Ход работы Прежде чем рисовать модель атома, заполните таблицу
Составьте электронные конфигурации атомов данных элементов. 1 вариант. гелий, фтор, фосфор, литий, кальций, неон 2 вариант. азот, углерод, сера, натрий, алюминий, кислород По схему моделей определите атом элемента:
Сделайте вывод. |
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах |
5 баллов |
Карточки |
|||||||||||||||||||||
|
Конец урока 10 мин
|
1. Используя приведённые примеры, заполните данную ниже таблицу:
Дескриптор: −определяет элементы по электронным и электронно- графическим формулам; −составляет электронные конфигурации; − составляет электронно-графические формулы |
Выполняют задания для ФО |
3 балла |
Карточки |
|||||||||||||||||||||
|
Рефлексия 5 мин |
Подведение итога урока. Прием « 5-5-1» Учащиеся пишут 5 предложений о том, что они освоили на уроке. Затем, сокращают эти 5 предложений до 5 слов. В конце сокращают эти 5 слов до одного. Учащиеся делятся свои ми ключевыми словами со всем классом.
|
Обратная связь, комментарии учителя и учащихся |
|
Карточки, стикеры |
Задание : «Почему светятся светлячки»
По вечерам в листве и среди травы часто встречаются светящиеся точки .Это ползают и летают светящиеся насекомые –светлячки. В темную ночь, набрав светляков ,ими можно осветлить компас или часы . Если много светлячков собрать в бутылку и плотно закрыть ее, они потухнут как погаснет свеча в помещении. Высыпав светлячков из бутылки , их можно снова заставить светиться. Объясните причину этого явления .Дайте обоснованый ответ.
_________________________________________________________________________________________________
|
Раздел: |
8.1А Движение электронов в атомах |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Образование ионов |
|
|
Цели
обучения в соответствии |
8.1.3.5 -понимать, что атомы могут принимать или терять электроны, что приводит к образованию ионов |
|
|
Цели урока |
- понимать, почему одни атомы стремятся отдавать электроны, с целью завершения электронной оболочки - понимать, почему другие атомы стремятся принимать электроны, с целью завершения электронной оболочки - определить количество составных структурных единиц в ионах - оценивать общность в строении иона и атома инертного газа |
|
Ход урока
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Начало урока
|
Покер «atomic Structure» Учитель готовит «колоду карт»: 18 карточек со строением атома, 18 карточек с химическими символами. Далее он раздает карты в произвольном порядке учащимся. Принцип игры: 1 игрок громко озвучивает содержание 1-й карты Все остальные ищут карту у себя (пару, например, Si/ 1s22s22p63s23p2). Учащиеся, у которых совпал символ элемента, и электронная формула убирают карточки и т.д. Задача учащихся, как можно быстрее избавится от «карт». Ученик, который остается с наибольшим количеством карт - тему не усвоил.
Знакомство с темой урока и целями учитель организует посредством просмотра видео: Просмотр видео https://www.twig-bilim.kz/film/atom-structure-electron-shells-6520/ Вопросы по Видеофрагменту: *От чего зависит реакционная способность элементов? *Во что объединяются электроны вокруг ядровням равно…? (N=2n2) *От чего зависит химическая устойчивость частиц? *Что такое «инертность»? Представителям какой группы (подгруппы) она характерна? Чем это можно объяснить (с точки зрения строения атома и расположения е- по энергетическим уравням) |
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2 балла |
Карточки, колода карт, видео |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Середина урока 20 мин
|
Стратегия «Четыре предложения» ( в группе) 1. Мнение Одним предложением формируют мнение об основном содержании текста 2. Доказательство Одним предложением доказывают приведенное мнение 3. Пример Для обоснования доказательства приводят пример одним предложением 4. Заключение Заключение делается также одним предложением Дескрипторы: – дают определение понятию «мышца»; – систематизируют мышцы организма; – составляют вопросы по тексту Просмотр анимации, как образуются ионы http://www.bbc.co.uk/schools/gcsebitesize/science/add_aqa_pre_2011/atomic/ionicrev4.shtml
|
Учащиеся работают в группе и индивидуально |
5 баллов |
Карточки |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Конец урока 10 мин
|
Задание №1: Укажите верное соответствие: 1.электронная конфигурация Br 2. электронная конфигурация Sr 3. электронная конфигурация As 4. электронная конфигурация H
а) 1s1 b) 1s22s22p6 c) 1s22s22p63s23p6 4s2 3d10 4p6 5s 2 d) 1s22s22p63s23p64s2 3d10 4p5 e) 1s22s22p63s23p64s2 3d10 4p3 Задание № 2: Покажите образование иона для вышеуказанных атомов с использованием схемы распределения электронов по энергетическим уровням. |
Выполняют задания для ФО |
3 балла |
карточки |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Рефлексия 5 мин |
Учащимся предлагется встать на шкалу согласно осознанному восприятию материала Я несчастлив Не уверен Уверен и
счастлив
Начало класса Конец класса Учитель благодарит учащихся за активную работу на уроке. |
Обратная связь, комментарии учителя и учащихся |
|
Карточки, стикеры, дерево успеха |
||||||||||||||||||||||||||||||||||||||||||||||||||
Задания по развитию естественно-научной грамотности :
Задание «Электронное строение атома»
1.Схема атома какого химического элемента изображена на рисунке
 a)2 периода 4А группы; b)3периода 9А группы с)2
периода 6А группы d)2 периода 8А группы
a)2 периода 4А группы; b)3периода 9А группы с)2
периода 6А группы d)2 периода 8А группы
Задача2.Максимальная концентрация этого элемента отмечена в пигментной сетчатке глаза. По электронной формуле внешнего электронного слоя определите этот элемент:…6s26p0 . Напишите его названия, символа и порядкового номера, укажите семейство элемента.
Задача3.Северная орхидея венерит башмачок растет на почвах, богатых этим элементом. По электронной формуле внешнегэлектронного слоя определите этот элемент : …4s2 4p0. Напишите его названия , символ и порядковый номер , укажите семейство элемента.
Задача 4.Розовые лепестки роз при избытке этого элемента становятся голубыми и даже черными . Определите положение этого элемента в периодической системе элементов ( период, группа ,подгруппа) по электронной формуле:1s22s22p63s23p63d104s1
|
Раздел |
8.1А Движение электронов в атомах |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Составление формул соединений. |
|
|
Цели
обучения в соответствии |
8.1.3.6 -составлять формулы соединений методом «нулевой суммы» |
|
|
Цели урока |
Все учащиеся научатся: - умеют пользоваться таблицей растворимости кислот, оснований и солей Большинство учащихся научится: - могут определить атомы элементов, теряющие электроны (образование положительных ионов); понимать, что данные элементы являются металлами; - может определить атомы элементов, получающими электроны (с образованием отрицательных ионов); понимать что данные элементы являются неметаллами Некоторые учащиеся научатся: - взяв за основу заряды ионов по методу «Нулевой суммы» умеют составлять химические формул |
|
|
|
|
|
Ход урока
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Начало урока 5мин
|
Вызов. Вычислить долю его (ее) комнаты от общей площади квартиры |
Учащиеся
отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Середина урока 15 мин |
Работа с терминами в паре. Лист ФО Задание 1. Вставьте пропущенные слова в современную формулировку периодического закона. «Свойства химических элементов и образуемых ими и сложных веществ находятся в зависимости от величины
ядра атомов этих »
Задание 2. Характеристика химических элементов 2-ого периода
Дескриптор: - вставить слова в современную формулировку периодического закона. -определить характеристику химических элементов 2-ого периода |
Учащиеся вначале знакомятся с терминами, затем выполняют ФО |
8 баллов |
Карточки, лист ФО |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Конец урока 15 мин |
Выполнение СОР "Движение электронов в атомах" |
Выполняют задания СОР |
Листы СОР |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Рефлексия 5 мин |
Подведение итога урока. Прием « 5-5-1» Учащиеся пишут 5 предложений о том, что они освоили на уроке. Затем, сокращают эти 5 предложений до 5 слов. В конце сокращают эти 5 слов до одного. Учащиеся делятся свои ми ключевыми словами со всем классом. |
Обратная связь, комментарии учителя и учащихся |
|
Карточки, стикеры, рефлексивная мишень |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Задание на развитие математической грамотности:
Задание «Музыкальный альбом»
Задание №1
Иван собирается перенести фотоальбом размером 350 Мб на свою флешку, но
на ней недостаточно свободного места. Он не хочет удалять существующие
фотографии, но с удовольствием удалит один или два музыкальных альбома.
На флешке у Ивана хранятся музыкальные альбомы следующего размера.
Если Иван удалит не более двух музыкальных альбомов, хватит ли на его
флешке места, чтобы добавить фотоальбом?
|
Альбом |
Размер |
|
Альбом 1 |
1100МБ |
|
Альбом 2 |
275МБ |
|
Альбом 3 |
80МБ |
|
Альбом 4 |
455МБ |
|
Альбом 5 |
60МБ |
|
Альбом 6 |
80МБ |
|
Альбом 7 |
75МБ |
|
Альбом 8 |
125МБ |
Задание № 2.
Определите площадь пчелиной ячейки если длина его грани составляет 2,7 мм.?
Задание № 3. Ученик прилил к растворам соды и сульфата натрия, находящихся в пробирках, избыток раствора хлорида бария.
На вопрос учителя о том, в какой пробирке находился раствор сульфата натрия, ученик не мог ответить, так как спутал пробирки. При помощи какого простого опыта можно было бы дать ответ на вопрос учителя?
Задание №4 Два металла А и Б принадлежат к одному и тому же периоду и к одной и той же группе. Элемент А образует только один хлорид, а элемент Б –два хлорида, в одном из которых он проявляет более высокую валентность, чем это соответствует его положению в периодической таблице. Этот хлорид содержит 52,5%хлора. Назовите этот элемент.
Задание №5 Золотое колье 585 пробы содержит 60% меди. Определите сколько граммов чистого золота ссодержит кольцо этой пробы, имеющей массу 5 граммов.
|
Раздел: |
8.1В Формулы веществ и уравнения химических реакций |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Расчеты по химическим формулам |
|
|
Цели
обучения в соответствии |
8.2.3.1 -вычислять массовые доли элементов в составе вещества, выводить формулы веществ по массовым долям элементов |
|
|
Цели урока |
Все учащиеся должны: • Уметь вычислять массовые доли химических элементов в составе сложного вещества; • Выводить формулы веществ по массовым долям элементов. Большинство учащихся должны: • Выводить формулы веществ по массовым долям элементов и делать дальнейшие предположения по их свойствам. Некоторые учащиеся должны уметь: • Систематизировать стехиометрические параметры, которые можно определить по химической формуле. |
|
Ход урока
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
|||||||||||||||
|
Начало
урока |
Переходим к дальнейшим вычислениям по химической формуле. Каждый атом, входящий в состав молекулы имеет свою атомную массу, зная которую, мы можем определить молекулярную массу сложного вещества. У кого какие есть предложения по нахождению молекулярной массы? Дети сами укажут математическое выражение нахождения молекулярной массы оксида фосфора (+5): Mr(Р2О5) = 2Аr(P) + 5Ar(O) В этот момент похвалите, поддержите его (Good job!) Найдем значение молекулярной массы: Mr(Р2О5) = 142 у.е. Далее по химической формуле можно определить массовые доли химических элементов. Это первая часть объяснения новой темы. Массовая доля химического элемента есть отношение атомной массы этого элемента с учетом его индекса на молекулярную массу, выраженную в процентах. Конкретно для оксида фосфора это выглядит так: (омега)
ω(Р)=2Аr(P) ω(O)=5Аr(O) Подставим значения атомных масс и получим: ω(Р)= 2 ω(O)=5 43,67 + 56,33 = 100 (верно) |
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
|
|||||||||||||||
|
Середина урока 20 мин
|
Работа с терминами в паре (записать определение в тетрадь)
Работа в группе по стратегии «Посол». Каждой группе дается задание ознакомиться со своей частью темы, обсудить в группе, поделиться прочитанным, затем группы обмениваются своими участниками и слушают пересказ каждого ученика, пришедшего из другой группы 1-я группа. Вычисление массовой доли элементов в составе вещества 2-я группа. Выведение формулы веществ по массовым долям элементов Работа в парах. Определите простейшую формулу соли, которая состоит из массовых долей: калий — 26,53 % , хром — 35,37 % , кислород — 38,10 % Дескриптор: определяет формулу соли по массовым долям элементов. |
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах |
5 баллов |
карточки |
|||||||||||||||
|
Конец урока 10 мин
|
Задание 1. На рисунке цифрами обозначены массовые доли элементов, входящих в состав хлорида аммония (NH4Cl). Найдите соответствие между этими цифрами и массовой долей каждого элемента (на основе расчета). Дескриптор: −рассчитывает массовые доли элементов в составе хлорида аммония; −соотносит массовые доли элементов с диаграммой. 2. а) Рассчитайте и определите, на какой диаграмме распределение массовых долей элементов соответствует количественному составу карбоната лития.
b) Определите, на какой диаграмме распределение массовых долей элементов соответствует NH4NO3
c) Рассчитайте, в каком соединении массовые доли кислорода и серы отличаются в 2 раза.
Дескриптор − определяет массовые доли элементов карбоната лития; − определяет массовые доли элементов нитрата аммония; − определяет соединение с соотношением кислорода и серы в 2 раза. |
Выполняют задания для ФО |
3 балла |
карточки |
|||||||||||||||
|
Рефлексия 5 мин |
|
Обратная связь, комментарии учителя и учащихся |
|
стул |
Задание « Воздух и его состав»
Зарисовать диаграмму и сравнить процентное содержание кислорода в природе, если известно, что в воздухе кислорода -21%, в организме человека – 65% , в земной коре – 49 % , в воде 53 % .

Задание №2 Какой воздух легче – сухой или влажный (содержащий водяные пары) ? Дайте обоснованный ответ.
Задание №3 Для тушения пожаров применяется летучая негорючая жидкость, представляющая собой соединение углерода с хлором .Валентность углерода в этом соединении, такая же как у углерода в углекислом газе . Назовите это вещество и рассчитайте плотность его паров: по воздуху?
Задание №4 Растения в солнечный день поглощает около 5 г углекислого газа на каждый квадратный метр своей листовой поверхности .Рассчитайте, сколько приблизительно граммов углерода накопит за один день подсолнечник , листовая поверхность которого 1,8 м3?
|
Раздел: |
8.1В Формулы веществ и уравнения химических реакций |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Составление уравнений химических реакций. Демонстрация № 1 «Опыт, доказывающий закон сохранения массы веществ». |
|
|
Цели обучения в соответствии |
8.2.3.2 -устанавливать экспериментальным путем соотношение реагирующих веществ 8.2.3.3 -составлять уравнения химических реакций, записывая формулы реагентов и продуктов реакции 8.2.3.4 -знать закон сохранения массы веществ |
|
|
Цели урока |
Все учащиеся должны: • понимать закон сохранения массы вещества и доказывать его экспериментально • устанавливать экспериментальным путем соотношение реагирующих веществ Большинство учащихся должно: • прогнозировать соотношение реагирующих веществ Некоторые учащиеся должны уметь: • объяснять погрешности экспериментальных данных |
|
Ход урока
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
||||
|
Начало
урока |
|
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
|
||||
|
Середина урока 20 мин
|
Работа с терминами в паре (записать определение в тетрадь) Усвоение текста методом «Дневника Борта»: В тетради начертить таблицу из двух граф:
В первой графе пишут известную информацию, полученную из текста. Во второй графе пишут новую информацию, полученную из текста, объясняют ее значение. 1 группа – закон сохранения массы веществ 2-я группа-составление уравнений химических реакций Дескрипторы: – полностью усваивают содержание текста, знакомятся с законом сохранения массы веществ – объясняют механизм составления уравнений химических реакций Демонстрация № 1 «Опыт, доказывающий закон сохранения массы веществ». 1. Измерьте 20 мл уксусной кислоты при помощи мензурки (осторожно!!). 2. Перелейте уксусную кислоту в тигель и взвесьте при помощи весов. 3.Измерьте 10 граммов пищевой соды в другой чашке. 4.Осторожно поставьте чашку с пищевой содой, не просыпая содержимого чашки в закрывающийся пластиковый пакет на весы. 5. Осторожно поместите чашку с уксусной кислотой внутрь пакета с чашкой соды, не смешивая их. Закройте пакет. 6. Не открывая пакета, смешайте соду с уксусной кислотой. 7.Когда реакция закончится, взвесьте пластиковый пакет, не открывая его. Запишите следующие данные из эксперимента: Масса кислоты в чашке - Масса пищевой соды в чашке - Масса пищевой соды и кислоты в чашках и пластиковом пакете - Общая масса реагентов с посудой и пакетом - Чистая масса реагентов (вычислите) - Общая масса продукции реакции с посудой и пакетом - Чистая масса продуктов реакции (вычислите) - Вопросы: 1.Какое явление произошло с веществами, когда кислота реагирует с содой? Какой признак подтверждает это превращение?
2. Почему кислоту и соду смешивают в запечатанном пакете? 4. Сделайте общий вывод: изменяется ли суммарная масса |
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах |
5 баллов |
Карточки, А3,маркеры, стикеры, пищевая сода, уксусная кислота, тигель, весы, пластиковый пакет |
||||
|
Конец урока 10 мин
|
Задание 1. Почему при химической реакции масса реагирующих веществ становится равной массе продуктов реакции: 1.1– что происходит с молекулами при химических явлениях ___________ 1.2– что происходит с атомами при химических явлениях Задание 2 Запишите правые части химических уравнений и расставьте коэффициенты: 1) Аl + O2→ 2) C6H6 + O2→ 3) Mg + O2 → 4) P + O2 → 5) K + O2 → Дескриптор: -раскрывает сущность закона сохранения массы веществ; (что происходит с молекулами и атомами при химических явлениях, сделал вывод) - находит и расставляет коэффициенты; - составляет уравнения химических реакций, - записывает формулы 4 продуктов реакции горения |
Выполняют задания для ФО |
3 балла |
карточки |
||||
|
Рефлексия 5 мин |
|
Обратная связь, комментарии учителя и учащихся |
|
Стикеры цветные |
Задание «Дыхание человека»
Задание №1
В одном объеме воздуха, поступающего при вдохе около 2 литров, плотность воздуха 1,3 г/л . Сколько молекул участвует в каждом вдохе, если молярная масса воздуха равна 29?
Задание №2 Сколько воздуха расходуется на дыхание класса из 30 человек в течении 40 минут урока, если один девятиклассник делает в среднем 16 вдохов в минуту, вдыхая по 2 литра воздуха?
Задание
№3 Для вычисления площади квартиры (включая террасу и стены) можно измерить
размеры каждой комнаты , рассчитать площадь каждой из них и сложить все
площади . 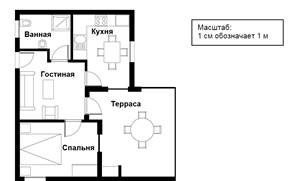
Для вычисления общей площади квартиры можно измерить размеры каждой комнаты , рассчитать площадь каждой из них и сложить все площади .Однако существует более эффективный способ, при котором для вычисления нужно измерить только 4 отрезка. Предложите свой способ решения задачи .
|
Раздел: |
8.1В Формулы веществ и уравнения химических реакций |
||||||||||||||||||||||||||
|
ФИО педагога |
|
||||||||||||||||||||||||||
|
Дата: |
|
||||||||||||||||||||||||||
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|||||||||||||||||||||||||
|
Тема урока |
Типы химических реакций |
||||||||||||||||||||||||||
|
Цели
обучения в соответствии |
8.2.2.1 -классифицировать химические реакции по числу и составу исходных и образующихся веществ |
||||||||||||||||||||||||||
|
Цели урока |
Все учащиеся должны: • классифицировать химические реакции по числу и составу исходных и образующихся веществ Большинство учащихся должно: • ориентироваться в определении типа химической реакции Некоторые учащиеся должны уметь: • прогнозировать ход химической реакции |
||||||||||||||||||||||||||
|
Тема урока
|
Типы химических реакций |
||||||||||||||||||||||||||
|
Цели обучения в соответствии с учебной программой |
8.2.2.1 -классифицировать химические реакции по числу и составу исходных и образующихся веществ Цели урока Все учащиеся должны: • классифицировать химические реакции по числу и составу исходных и образующихся веществ Большинство учащихся должно: • ориентироваться в определении типа химической реакции Некоторые учащиеся должны уметь: • прогнозировать ход химической реакции
|
||||||||||||||||||||||||||
|
|
Ход урока |
||||||||||||||||||||||||||
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
|||||||||||||||||||||||
|
Начало
урока |
Показывает ДО «Разложение малахита» Ход эксперимента: 1. Нагреть пробирку с малахитом, наблюдать почернение малахита, выделение капелек воды на стенках пробирки и интенсивное выделение пузырьков газа в стаканчике с известковой водой. 2. Наблюдать помутнение известковой воды. Изменение окраски, появление капелек воды и помутнение известковой воды, что свидетельствует о выделении углекислого газа). На доске записана реакция: (CuOH)2CO3=2CuO+CO2+H2O Учитель задает вопросы: Какие вещества образуются в качестве продуктов реакции? (сложные) Записывает на доске реакцию разложения воды Н2О=Н2+О2 А какие вещества образуются здесь в качестве продуктов? (простые) Посмотрите внимательно на обе эти реакции и скажите, что общего в исходных веществах этих реакций? ( и в первой и во второй реакции оба вещества являются сложными) Учитель записывает общую схему реакции вместе с классом (АВ → А+В, АВ2С →АВ+ВС). |
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
порошок малахита, известковая вода, пробирка с газоотводной трубкой, пробиркодержатель, спиртовка, спички. |
|||||||||||||||||||||||
|
Середина урока 20 мин |
Работа с терминами в паре (записать определение в тетрадь)
Усвоение текста методом «Дневника Борта»: в тетради начертить таблицу из двух граф:
В первой графе пишут известную информацию, полученную из текста. Во второй графе пишут новую информацию, полученную из текста, объясняют ее значение. 1 группа – химические реакции по числу веществ 2-я группа- химические реакции по и составу исходных и образующихся веществ Дескрипторы: – полностью усваивают содержание текста, знакомятся с законом сохранения массы веществ – объясняют механизм составления уравнений химических реакций Работа у доски. Из предложенного списка реакций выбрать реакции разложения, соединения, замещения, обмена • 1) C + O2 = CO2 • 2) MgCO3 = MgO + CO2 • 3) CuSO4 + Fe = Cu + FeSO4 4) 2H 2O = 2H2 + O2 5) FeCl2 + NaOH = Fe(OH)2 + NaCl 6) 2H2 + O2 = 2H2O 7) BaO + SO2 = BaSO3 8) H2SO4 + 2KOH = K2SO4 + 2H2O 9) Zn + H2SO4 = ZnSO4 + H2 10) 2Fe(OH)3 = Fe2O3 + 3H2O |
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах |
5 баллов |
Карточки, А3,маркеры, стикеры, пищевая сода, уксусная кислота, тигель, весы, пластиковый пакет |
|||||||||||||||||||||||
|
Конец урока 10 мин
|
Задание 1. А) Рассчитайте число атомов в реагентах и продуктах реакции.
b) Внимательно рассмотрев рисунок, запишите обобщённое уравнение реакции. Расставьте коэффициенты. Дескриптор: − рассчитывает число атомов реагентов и продуктов реакции; − записывает уравнение реакции; − составляет формулы согласно валентности; − уравнивает реакцию, с помощью коэффициентов Задание 2. Допишите уравнение реакции, вставив вместо знаков “?” необходимые символы элементов или формулы веществ. Ca + 2HCl → Ca”?” + H2 2Mg + “?” → 2MgO 2H2”?” + 3O2 → 2H2O + 2SO2 Fe2O3 + 3H2 → 2Fe + 3”?”O CaCl2 + 2NaOH → Ca(OH)2 + 2Na”?” Дескриптор: - составляет уравнения реакций, заполняя пропуски |
Выполняют задания для ФО |
3 балла |
карточки |
|||||||||||||||||||||||
Задание естественно-научной грамотности
Задание «Какая планета?»
Действие фантастического романа, написанного почти сто лет назад,
происходит на одной из действительно существующих планет Солнечной
системы. Эта планета находится ближе к Солнцу, чем Земля, а по размерам
она лишь немного меньше, чем наша планета.
Задание 1.
На какой планете Солнечной системы происходит действие романа?
Выберите один ответ.
А. Марс
Б. Венера
В. Юпитер
Г. Меркурий
По сюжету романа на этой планете живут существа, похожие на людей,
и растут зелёные растения. Современные реальные данные о составе
атмосферы
этой планеты показаны на диаграмме. 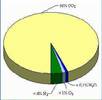
Задание 2.
Могут ли человекоподобные существа и зелёные растения существовать
на такой планете?
Запишите ниже в рамке «Могут» или «Не могут» и объясните своё
решение, используя данные на диаграмме.
Задание 3. На какой планете Солнечной системы происходит действие романа?
|
Раздел |
8.1В Формулы веществ и уравнения химических реакций |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Химические реакции в природе и жизнедеятельности живых организмов и человека. |
|
|
Цели
обучения в соответствии |
8.2.2.2 -описывать химические реакции в природе и жизнедеятельности живых организмов и человека |
|
|
Цели урока |
Все учащиеся должны: • Уметь описывать химические реакции в природе и жизнедеятельности живых организмов и человека • Знать признаки химических реакций Большинство учащихся должны: • Проводить эксперименты с соблюдением правил техники безопасности Некоторые учащиеся должны уметь: • Исследовать химические процессы, протекающие вокруг него |
|
Ход урока
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
|
Начало урока 5мин |
Вызов. Сейчас я вам раздам лепестки цветка, и на них вы напишите признаки химических реакций, а в середине будет слово Реакция. Соберем наш цветок на доске. Теперь при проведении своих опытов вы будете опираться на наш цветок, выявляя какие признаки химических реакций вы наблюдаете? |
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
Лепестки цветков, крахмал, йод |
|
Середина урока 15 мин |
Работа с терминами в паре. ПДК сернистого газа в воздухе -0,5 мг/м3.Во сколько раз концентрация превысит предельно допустимую, если в закрытом помещении площадь 70м2 с высотой потолка 4м взорвать петарды, содержащие всего 2 серы. Предложите способ по снижению концентрации сернистого газа в помещении. Задние 2 Соль жизненно необходима для жизнедеятельности человека, равно как и всех прочих живых существ. В основном в соли, используемой в быту, содержится хлорид натрия. Составная часть соли участвует в очень важных биохимических процессах живых организмов: выработке соляной кислоты – важного компонента желудочного сока, в передачи нервных импульсов, сокращении мышечных волокон. Но надо помнить, что переизбыток соли может приводить к нежелательным последствиям, например к задержке жидкости в организме и повышению кровяного давления. Вопрос 1. Существует крылатое выражение «Пуд соли съесть» вдвоем, которое один человек употребляет около 10 г соли .Сколько же времени надо провести вместе двум друзьям , чтобы за это время съесть пуд (16кг) соли? Ответ подтвердите расчОтвет:: 2,2 года. Расчёты: два человека в год съедят соли: 20 · 365= 7300 г (7,3 кг) 16 : 7,3 = 2,2 года.
Лист ФО: На рисунке приведены реагенты и продукты протекающей реакции. Определите тип реакции и напишите уравнение реакции
Дескриптор: − определяет тип реакции; − записывает уравнение реакции; − уравнивает реакцию, с помощью коэффициентов |
Учащиеся вначале знакомятся с терминами, затем выполняют эксперимент и ФО |
8 баллов |
Карточки, лист ФО,песок речной, этиловый спирт, сахарная пудра, пищевая сода, картон, жидкость для мытья посуды, столовый уксус |
|
Конец урока 15 мин |
Выполнение СОР «Формулы веществ и уравнения химических реакций" |
Выполняют задания СОР |
Листы СОР |
|
|
Рефлексия 5 мин |
Подведение итога урока. Прием « 5-5-1» Учащиеся пишут 5 предложений о том, что они освоили на уроке. Затем, сокращают эти 5 предложений до 5 слов. В конце сокращают эти 5 слов до одного. Учащиеся делятся свои ми ключевыми словами со всем классом. |
Обратная связь, комментарии учителя и учащихся |
|
Карточки, стикеры, рефлексивная мишень |
Задание №1 «Вездесущий йод»
I2 - фиолетовые кристаллы, с металлическим блеском , Пары йода обладают резким запахом , откуда и произошло название этого вещества – «фиалковый» (греч.). В виде свободного вещества – ядовит. При вдыхании паров йода появляется сильная головная боль, кашель, может быть отек легких. Йод – это элемент с небольшим содержанием его в земной коре, около одной стотысячной процента. Вместе с тем с помощью современных методов анализа можно обнаружить присутствие хотя бы незначительных следов йода в почве, воде растениях, организмах и животных. Свою славу йод приобрел благодаря активному использованию в качестве средства для дезинфекции кожи вокруг места повреждения.
Вопрос 1
Йод –неметалл, но несмотря на это обладает характерным металлическим блеском. С учетом расположения йода в ПСХЭ объясните твердое агрегатное состояние йода и наличие у него металлического свойства.
Вопрос 2
Известно, что во многих странах мира в пище человека содержится недостаточное количество йода. Как эта проблема решается в нашем государстве? На чем основано применение йодной сетки с медицинской точки зрения – спиртового раствора йода, нанесенного на место ушиба в виде сетки.
|
Раздел: |
8.2.В Стехиометрические расчеты |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
Закон Авогадро. Молярный объём |
|
|
Цели
обучения в соответствии |
8.2.3.6 -знать закон Авогадро и использовать молярный объем для расчета объема газов при нормальных и стандартных условиях; |
|
|
Цели урока |
сформировать навыки учащихся понимать закон Авогадро; - сформировать навыки учащихся распределять молярный объем газов при нормальных и стандартных условиях |
|
|
|
|
|
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
|
Начало
урока |
Эксперимент Учитель заранее заполняет 2 шарика примерно одинаковыми объемами углекислого газа, гелия и дает учащимся сравнить массы данных газов. - Почему вещества с одинаковым объемом имеют разные массы? Ознакомление с темой и целями обучения |
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
2 шарика примерно одинаковыми объемами углекислого газа, гелия |
|
Середина урока 20 мин
|
Работа с терминами Стратегия «Детектор лжи» Участники одной группы, прочитав текст, задают 8–10 вопросов участникам другой группы. Те дают правильные ответы, а на один вопрос – неправильный ответ. Участники другой группы указывают правильные и неправильные ответы. Работа у доски Задача 1. «Определите, какая масса водорода выделится при взаимодействии 730 граммов соляной кислоты и избыточного количества цинка». Совместная работа, решение задачи.
m (HCl) – 730 г. 1. Составим уравнение реакции: 2HCl + Zn → ZnCl2 + H2↑ m (Zn) – избыток. Из уравнения видно, что соляной кислоте, количеством вещества 2 моль,
2. Вычислим количество вещества (n) соляной кислоты. Для этого массу соляной кислоты нужно разделить на её молярную массу (молярная масса всегда равна молекулярной). n (HCl) = m (HCl) : M (HCl) или n (HCl) = 730 : 36,5 = 20 моль. 3. Исходя из полученных данных, мы можем составить пропорцию. Если 2 моль соляной кислоты соответствует 1 моль водорода, то, сколько моль водорода будет соответствовать 20 моль соляной кислоты? 2 моль (HCl) = 1моль (H2) 20 моль (HCl) = X моль (H2) Отсюда Х = 20*1 : 2 = 10 моль (H2) 4. Теперь нам известно, что количество вещества водорода равно 10 моль. Зная молярную массу водорода (2 г/моль), мы без труда можем вычислить массу водорода, полученного в этой реакции. m (H2) = n (H2) * M (H2) или m (H2) = 10 моль * 2 грамма = 20 граммов. 5. Записываем ответ. Ответ: m (H2) = 20 граммов. Задача 2. Определите, какой объём водорода выделится при взаимодействии 730 граммов соляной кислоты и избыточного количества цинка.
m (HCl) – 730 г. 1. Составим уравнение реакции: 2HCl + Zn → ZnCl2 + H2↑ m (Zn) – избыток. Мы уже знаем, что соляной кислоте, количеством вещества 2 моль,
2. В первой задаче мы уже вычислили количество вещества соляной кислоты – 20 моль, а водорода – 10 моль. 3. Нам известно, что моль любого газа (при н.у.) занимает объём равный 22,4 литра. Следовательно, мы можем составить новую пропорцию: 1 моль (H2) = 22,4 л. 10 моль (H2) = Х л Х = 10 * 22,4 : 1 = 224 л. Ответ: V(H2) = 224 л.
|
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах |
5 баллов |
карточки |
|
Конец урока 10 мин |
Задача 1. Какой объём при нормальных условиях займёт углекислый газ (CO2), взятый в количестве вещества 0,5 моль? Ответ: V(CO2) = 11,2 л. Задача 2. Какой объём займёт при нормальных условиях хлороводород (HCl) массой 14,6 г.? Ответ: 8,96 л. Задача 3. Какой объём займёт при нормальных условиях сероводород (H2S) массой 510 г.? Ответ: 336 л Дескриптор -определяет объема газов при нормальных и стандартных условиях; Вопрос 1
Вопрос 2 До погружения на ночь в уксусный раствор , кусочек мрамора имел массу 2,0 г . На следующий день этот кусочек вынимают из уксуса и высушивают. Какова будет масса высушенного кусочка мрамора? a)меньше , чем 2 ,0 г б)точно 2 ,0 г в) между 2,0г и 2, 4 г г)больше, чем 2,4 г Компетенция : использование научных данных для принятия решений ; Знания: физические системы Область применения : опасности и риски Контекст :личностный. |
Выполняют задания для ФО |
3 балла |
карточки |
|
Рефлексия 5 мин |
Подведение итога урока. Прием « 5-5-1» Учащиеся пишут 5 предложений о том, что они освоили на уроке. Затем, сокращают эти 5 предложений до 5 слов. В конце сокращают эти 5 слов до одного. Учащиеся делятся свои ми ключевыми словами со всем классом. Пирамида рефлексии
|
Обратная связь, комментарии учителя и учащихся |
|
Карточки, стикеры, пирамида рефлексии |
Вопрос 3
3. В бензине марки АИ-93 содержится около 0,8 г/л тетраэтилсвинца. Сколько свинца попадет в окружающую среду в результате 1000-километрового пробега легкового автомобиля, если средний расход бензина во время пробега составляет 10 л на 100 км?
Ответ: 51,26 грамма
Вопрос 4
4. Котельная сжигает 2 т угля в сутки. В составе угля 84% углерода, 5% водорода, 3,5% серы, остальное – негорючие неорганические вещества. Какова площадь леса, необходимая для восполнения потери кислорода, расходуемого на сжигание, если 1 га леса в сутки дает 10 кг кислорода?
Ответ: 535 га
|
Раздел: |
8.2.В Стехиометрические расчеты |
||||||||||
|
ФИО педагога |
|
||||||||||
|
Дата: |
|
||||||||||
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|||||||||
|
Тема урока |
Относительная плотность газов. |
||||||||||
|
Цели
обучения в соответствии |
8.2.3.7 -вычислять относительную плотность газов и молярную массу вещества по относительной плотности |
||||||||||
|
Цели урока |
Научиться производить расчеты по условию задачи и находит относительную плотность газов; используя значения относительной плотности газов, находит молярные массы газов; - вычисляет молекулярные массы газов и относительную плотность газов; - преобразовывает формулу вычисления относительной плотности для расчета молекулярной массы |
||||||||||
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
|
||||||
|
Начало
урока |
На уроках физики вы уже встречали физическую величину – плотность. Сегодня мы с вами познакомимся с этой величиной с химической точки зрения. Также введем понятие относительная плотность. 1) Плотность ρ(г/л) –плотность ρ=m/V ρ=M/Vm Например: Чему равна плотность кислорода?(5) Решение: ρ=M/Vm М(О2)=32г/моль Vm= 22,4л/моль
ρ(О2) =32г/моль / 22,4л/моль=1,43г/л
|
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
|
|
||||||
|
Середина урока 20 мин
|
Работа с учебником «Дневник Борта»: Заполнение таблицы.
Задачи (по группам). 1. Вычислите массу кислорода, взятого объемом 200 л. (285,7 г) 2. Вычислите число молекул сероводорода, если его объем равен 112 л. (30,1 * 1023) 3. Масса газа объемом 4,48 л составляет 8,8 г. Определите молярную массу этого газа. (44г/моль) |
Учащиеся вначале знакомятся с глоссарием, затем работают индивидуально, а также в группах |
5 баллов |
карточки |
|
||||||
|
Конец урока 10 мин |
Задача 1. Вычислите относительную плотность аммиака (NH3) по водороду. Задача 2. Определите молекулярную формулу вещества, содержащего 81,8% углерода и 18, 2% водорода. Относительная плотность вещества по азоту равна 1,57. Рассчитайте молярную массу полученного соединения Задача 3. Вычислите молярную массу двухатомного газа, относительная плотность которого по воздуху 1,103. Назовите этот газ. Дескриптор: −вычисляет молярные массы соединений; −правильно использует значения, данные по условию задачи; −вычисляет относительную плотность газов |
Выполняют задания для ФО |
3 балла |
карточки |
|
||||||
|
Рефлексия 5 мин |
Подведение итога урока. Прием « 5-5-1» Учащиеся пишут 5 предложений о том, что они освоили на уроке. Затем, сокращают эти 5 предложений до 5 слов. В конце сокращают эти 5 слов до одного. Учащиеся делятся свои ми ключевыми словами со всем классом.
|
Обратная связь, комментарии учителя и учащихся |
|
Карточки, стикеры, поезд |
|
||||||
Задание 1
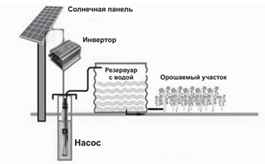
Рисунок 1. Использование солнечных насосов для закачки воды в резервуары и орошения Излишки воды накапливаются в резервуарах или цистернах. Для увеличения объёмов закачиваемой воды устанавливают большее количество солнечных модулей. Правильно подобранная фотоэлектрическая насосная система очень надёжна, не требует большого обслуживания и имеет высокую производительность. С помощью солнечного модуля мощностью 128 Вт насос может поднимать 3–4 тыс. литров воды за сутки из 200-метровой скважины. Также солнечные панели используют для сушки зерна и овощей. Для этого используют специальные сушильные сооружения, состоящие из двух основных частей: солнечного коллектора и сушильного
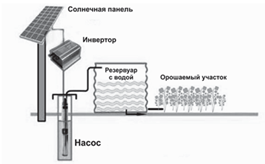
шк рис. 2
Рисунок 2. Сушка сельскохозяйственных культур с помощью солнечного коллектора Коллектор поглощает солнечные лучи и нагревает воздух, проходящий через него. Нагретый воздух путём естественной конвекции подаётся на сушильный шкаф, где он проходит через ряд стеллажей с находящимися на них продуктами питания.
Излишки воды накапливаются в резервуарах или цистернах. Для увеличения объёмов закачиваемой воды устанавливают большее количество солнечных модулей. Правильно подобранная фотоэлектрическая насосная система очень надёжна, не требует большого обслуживания и имеет высокую производительность. С помощью солнечного модуля мощностью 128 Вт насос может поднимать 3–4 тыс. литров воды за сутки из 200-метровой скважины. Также солнечные панели используют для сушки зерна и овощей. Для этого используют специальные сушильные сооружения, состоящие из двух основных частей: солнечного коллектора и сушильного шкафа рис. 2.
Нагретый воздух путём естественной конвекции подаётся на сушильный шкаф, где он проходит через ряд стеллажей с находящимися на них продуктами питания.
Укажите способ нагрева, используемый для сушки зерна.
A дуговой
B индукционный
C диэлектрический
D нагрев сопротивлением
Рекомендации по выполнению задания
Обратите внимание на текст и рисунок 2. Вспомните каждый способ нагрева и сопоставьте их с рисунком, так как сушка сельскохозяйственных культур осуществляется с помощью солнечного коллектора, верным ответом может быть только «индукционный».
Схема оценивания
Максимальное количество баллов 1
Выбирает вариант «индукционный»
Укажите существенный недостаток открытого способа нагрева зерновых и других культур.
A Требуют дополнительных источников энергии и затрат на электроэнергию.
B Сельскохозяйственные культуры подвержены загрязнению пылью и грязью.
C Сельскохозяйственные культуры подвержены повреждению птицами и грызунами.
D Коллектор должен быть ориентирован на южную сторону с оптимальным углом наклона к горизонту.
Рекомендации по выполнению задания
· «Требуют дополнительных источников энергии и затрат на электроэнергию» является неверным, так как при сушке на открытом воздухе используется солнечная энергия для уменьшения затрат на дополнительные источники энергии. Дистрактор
«сельскохозяйственные культуры подвержены загрязнению пылью и грязью» также является неверным, так как зёрна можно отчистить от грязи и пыли, этот недостаток не является существенным. «Коллектор должен быть ориентирован на южную сторону с оптимальным углом наклона к горизонту» не является верным ответом, так как к нему можно найти технологическое решение.
· «Сельскохозяйственные культуры подвержены повреждению птицами и грызунами» является единственным существенным недостатком сушки на открытом воздухе, так как грызуны могут быть переносчиками опасных для людей микроорганизмов, а также испортить качество зёрен.
|
Раздел: |
8.2.В Стехиометрические расчеты |
|
|
ФИО педагога |
|
|
|
Дата: |
|
|
|
Класс: 8 |
Количество присутствующих: |
Количество отсутствующих: |
|
Тема урока |
"Стехиометрические расчеты" |
|
|
Цели
обучения в соответствии |
8.2.3.8 -использовать закон объёмных отношений для расчетов по уравнениям реакций с участием газов |
|
|
Цели урока |
вычислять объем газов при нормальных и стандартных условиях; |
|
|
Этап урока/ Время |
Действия педагога |
Действия ученика |
Оценивание |
Ресурсы |
|
||
|
Начало
урока |
1.Какие существуют вещества в газообразном состоянии? (Н2, N2, О2, СН4, С2 Н6) 2.Какое понятие характерно для этих газов? («Объем») 3.Какой ученый предположил, что в состав газов входят 2 атома и какие? (А.Авогадро, Н2, О2, N2) 4. Какой закон был открыт Авогадро? (В равных объемных различных газов при одинаковых условиях (t и давления) содержится одинаковое число молекул) 5. По закону Авогадро 1 моль любого газа занимает объем равен (22,4 л/моль) 6.Каким законом обозначается объем газа? (V м – объем молярный) 7. По каким формулам мы находим: V, Vм, количества вещества? Vм = V v = V V = Vм ∙ v v Vм
|
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока. |
2
балла |
Карточки |
|||
|
Середина урока 15 мин
|
Игра «Пойми меня» тексту, тот считается победителем Дескрипторы: – полностью усваивают текст, определяют закон объемных отношений – раскрывают сущность понятий терминов; – сравнивают активность металлов Работа у доски: Задача 1. Рассчитайте, какой объем кислорода расходуется при взаимодействии с ним 10м³ водорода. Задача 2. Определение количества вещества по известному объему газа и вычисление объема газа (н.у.) по производству количеству вещества. Задача 3. Вычислите, какой объем (при н.у.) занимают 96 г кислорода. Сначала находим молярную массу кислорода О2. Оно равно М (О2) = 32 г/моль. Дескриптор: -Используют закон объёмных отношений для расчетов по уравнениям реакций с участием газов |
Учащиеся работают в группах, а затем у доски |
5 баллов |
Карточки |
|||
|
Конец урока 15 мин |
|
Выполняют задание |
|
Лист с заданием |
|||
|
Рефлексия 5 мин |
Обратная связь осуществляется на основе метода «Сэндвич». Рефлексия может проводится письменно или устно. 1 слой – положительное мнение об уроке; 2 слой – критическое мнение с указаниями по улучшению; 3 слой – положительное мнение, но с пожеланиями для улучшения в будущем |
Обратная связь, комментарии учителя и учащихся |
|
Стикеры |
|||
Атлет из Гренландии съедает в тёплой комнате 2 пачки орехов, чтобы восполнить белковый запас после тренировки. Пищевая ценность ореха указана на упаковке.
Если предположить, что в организме не происходит накопления энергии, то какую массу воды он испарит с поверхности кожи, чтобы установилась первоначальная температура? (удельная теплота парообразования воды - 44 кДж/г).
Рекомендации по выполнению задания
· Обратите внимание на массу орешков на упаковке. Указано, что 50 г. Так как атлет съел 2 пачки, то общая масса орешков составит 100 г.
· Энергетическая ценность орешков, указанная на упаковке составляет 1209 кДж, умножаем его на 2 и получаем 2418 кДж.
· Делим его на удельную теплоту парообразования воды – 44 кДж/г и получаем значение 54,95г.
|
Раздел долгосрочного планирования: 8.4В Углерод и его соединения (4 ч.) |
Школа: КГУ СШГ№1 Средняя школа -гимназия №1 г. Кокшетау |
|
Дата: |
Ф.И.О. учителя:Бабкова Л.В. |
|
Класс: 8 |
Участвовали: 15 Не участвовали: |
|
Тема урока |
Свойства углерода.Практическая работа №6 «Физические и химические свойства углерода». |
|
Цели обучения, которые помогает достичь данный урок |
8.4.3.5 -исследовать физические и химические свойства углерода |
|
Цель урока
|
Все учащиеся: дают общую характеристику элемента углерода в ПСХЭ, различают аллотропные видоизменения углерода, физические свойства , понимают ключевые понятия: окислитель, восстановитель, кислотный оксид, кислота. Большинство: учащихся умеют составляют уравнения реакций характеризующие химические свойства углерода, и доказать их при помощи химических экспериментов. Некоторые: учащиеся: сделают вывод о химических свойствах углерода, на основании химических опытов |
|
Критерии оценки |
Учащийся достиг цели если; - дает общую характеристику углероду, объясняет свойства аллотропные видоизменений углерода ; -проводит опыты и составляют уравнения реакций подтверждающие свойства углерода; - объясняет явление адсорбции; -на основании химического эксперимента делает выводы; |
|
Языковые цели |
Основные понятия: физические и химические свойства углерода, окислитель, восстановитель, кислотный оксид, адсорбция, кислота, восстановление оксида меди Основные фразы используемые на уроке: Аллотропия углерода –алмаз, графит….. Физические свойства углерода: цвет, агрегатное состояние…. При взаимодействии углерода с простыми веществами...... При взаимодействии углерода со сложными веществами..... В ходе экмперимента образуется ..... |
|
Привитие ценностей |
Общенациональная идея «Мәңғілік Ел», ценность 4 «Экономический рост на основе индустриализации и новации Труд и творчество, обучение на протяжении всей жизни.». Уважение. Необходимость уважения, к мнению одноклассников во время работы в группах. Дружелюбие. Необходимость совместного планирования деятельности при работе в группе обеспечивает терпимость и дружелюбные отношения в группе, лидерство. |
|
Межпредметная связь |
естествознание 6 класс «Виды и источники энергии» |
|
Предшествующие знания. |
Химия 7 класс |
|
Запланированные этапа урока |
Виды упражнений, запланированных на урок: |
Ресурсы |
|||||||||||||||||||
|
Начало урока
1 мин
3 мин
2 мин
1мин
3мин
3мин
2мин
Средина урока
3 мин
4 мин
1мин
4 мин
1 мин
2 мин
3 мин
2 мин
3 мин
|
Орг. Момент: Приветствие, проверка готовности учащихся, посещаемость Первый этап урока 1. Психологический настрой учащихся: Я рада видеть ваши лица, ваши улыбки, и думаю , что этот день принесет вам радость, общение друг с другом. Сядьте удобно, закройте глаза и повторяйте за мной: «Я в школе, я на уроке . Я радуюсь этому. Внимание мое растет. Я как разведчик, все замечу. Память моя крепка. Голова мыслит ясно. Я хочу учиться . Я готов к работе. Я работаю.» 2. Упражнение «Пожелание успеха» Деление на группы с помощью разного сорта конфет , которые учитель раздает каждому ученику. 1.группам «ЛИМОНЫ» 2.группа «АПЕЛЬСИНЫ» 3 Группа «КИВИ» Второй этап урока Актуализация изученного материала: 1. Метод тесты(Закрытые врпросы)
Вопрос 1 Оцените суждения: · А)углерод является неметаллом · B)углерод находится в VIA группе Периодической системы · С)имеет 4 электрона на внешнем электронном слое · D)в соединениях с металлами имеет положительные степени окисления Вопрос 2 Углерод проявляет окислительные свойства при взаимодействии с веществами: · A)O2 · B)Si · C)Ca · D)Fe2O3 Вопрос 3 Укажите правильные утверждения: · A)углекислый газ в твёрдом состоянии называется "сухой лёд" · B)оксид углерода (II) используется в промышленности для восстановления металлов · C)оксид углерода (II) является токсичным веществом · D)оксид углерода (II) является кислотным оксидом Вопрос 4 Кристаллическая решётка у алмаза: · A)молекулярная · B)ионная · C)атомная · D)металлическая Вопрос 5 Во сколько раз углекислый газ тяжелее водорода? Вопрос 6 Оксид углерода (IV) реагирует с веществам · A)водой · B)оксидом кальция · C)кислородом · D)сульфатом калия Вопрос 7 Какой объём (л) кислорода (н.у.) необходим для сгорания 4 л CO? Углерод проявляет восстановительные свойства при взаимодействии с веществами: · A)F2 · B)Si · C)Al · D)Cr2O Вопрос 9 Какая масса (г) карбида алюминия образуется при сплавлении 13,5
г алюминия с углеродом? 1.а 2.в 3 б 4.с 5.- 6а 7в 8d 9- 9 баллов -молодец, так держать 6баллов-есть над чем работать 5 баллов и менее-будь успешее и все получиться Третий этап урока Определение темы урока метод «Ассоциативный ряд» Картинки на доске: известняк, огонь газа, карандаши , кусочек мела, жемчуг - Что объединяет эти картинки? - Как вы думаете какова тема нашего урока? Учащиеся называют тему урока ставят для себя смарт цели. Мотивация. Далее учитель сообщает, что углерод – один из важнейших элементов. Простые вещества, образованные им находят широкое применение. Чтобы разумно использовать вещество, прежде всего необходимо хорошо знать его свойства. - Углерод и его соединения имеют огромное значение для человека, широко распространены в природе. . Тот факт, что в человеческом организме содержится 16 кг атомов углерода (это составляет 1 333 333 моль вещества или 8*1041 степени атомов) говорит об углероде как основе всего живого. Метод «чтение с пометками» -Объясните явление аллотропии. Ученики читают текст учебника и обсуждают в группах , чем отличается алмаз и графит Ученики совместно заполняют таблицу Можно ли отличить алмаз от графита по каким свойствам? Составить кластер ( работа в группе) Диаграмма
Венна Цвет?Кристаллическая решетка ? Твердость ? Температура плавления? Формативное оценивание – химоны. Четвертый этап урока Рассказ учителя .При обычных условиях углерод весьма инертен, однако при высоких температурах он вступает в реакцию с различными веществами.В химических реакциях углерод может проявлять в реакции с различными веществами как окислитель так и восстановитель.Углерод может менять степень окисления отдавая или принимая электроны . Ребята давайте посмотрим на доску , какими химическими свойствами обладает углерод ? Химическое свойство №1 Взаимодействие с кислородом : углерод может реагировать с кислородом по разному в зависимости от количества кислорода.Метод «моделирования» Ученики сами составляют уравнения с карточками для подстановки : Углерод + кислород = оксид углерода С + O2 = CO2 При избытке кислорода и недостатке кислорода C+O2 = CO2 +393,8кДж; 2С+ O2 = 2CO+221кДж -Приступим к практической работе, у вас на столах есть оборудование и реактивы, рассмотрите их. Практическая работа №6 «Физические и химические свойства углерода» Оборудование и реактивы: пробирки газоотводная трубка, штатив, спички, известковая вода, микроскоп, активированный уголь. Демонстрационный опыт учителем Эксперимент №1 Горение угля. В пробирку поместить нитрат калия и осторожно расплавить его. В полученный расплав поместить раскаленный древесный уголь. Наблюдайте горение угля. Объясните, почему горение угля в пробирке с кислородом становиться сильнее. Дескриптор
Ребята , какие существуют окислители и восстановители, что вы об этом знаете из жизни? ( ответы учеников) ЗАДАНИЕ 1 Существует утверждение, что люди погибнут от удушья значительно раньше. Каждая машина, прошедшая 15 км, выбрасывает 3250кг углекислого газа, 530 кг угарного газа, промышленность ежедневно выбрасывает в атмосферу около 1,5 млн. тонн углекислого газа. Поступление углекислого газа в атмосферу за счет сжигания ископаемого топлива характеризует график:
А как считаете вы, грозит ли гибель человечеству? Если да, то каковы пути ее предотвращения Оценивание - ученики записывают ответы в тетради и читают вслух Формативное оценивание – химоны. Записывают в тетради определение восстановителями и окислителями Атомы которые , легко отдают свои валентные электроны, при этом их степень окисления увеличивается называются восстановителями. Атомы которые, легко принимают электроны при этом их степень окисления уменьшается, называются окислителями. Работа с презентацией Углерод может быть как окислителем так и восстановителем. 1). С + O2 = 2). CuO + C = 3). C+H2 = Выбрать из предложенных уравнений реакций. Где углерод ведет себя как окислитель, а где углерод ведет себя как восстановитель? Эксперимент №2 Изучение физических свойств углерода. Адсорбция Для проведения опыты нужны: уголь, графит , активированный уголь. а) Физические свойства угля. Исследуйте внешний вид данных веществ. Отметьте цвет, какими являются на ощупь эти вещества. Если есть микроскоп рассмотрите активированный уголь. Запишите все наблюдения в тетрадь. Дескриптор
Опыт губка и чашка с водой (учитель выбирает одного ученика и предлагает продемонстрировать опыт у доски) Губку опустить в воду . б)Адсорбция. Поместите уголь в пробирку со слабым раствором марганцовки и взболтайте. Раствор обесцветился. Объясните наблюдаемое явление. Ученики записывают определение что такое адсорбция Поглощение газообразных или растворенных веществ поверхностью твердого вещества называют адсорбцией, а обратный процесс десорбцией. Дескриптор
Химическое свойство углерода №2 Взаимодействие с оксидами металлов: Углерод восстанавливает металлы из их оксидов. Fe2O3 +3C = 2Fe + 3CO Химическое свойство № 3Взаимодействие с металлами Укажите окислитель и восстановитель в уравнении реакции. 0 0 +3 -4 4Al +3C = Al4C3 1)Математическая грамотность
(Решение задачи у доски) Физминутка В нашем классе все друзья , Я и ты и он и я Обними того кто слева , Улыбнись тому, кто справа , Мы одна семья. Пожалей того, кто слева, Помаши тому кто прямо Получи заряд Шаг вперед и два назад Дружный мы отряд. Сели встали, сели встали Отдохнули неустали !!!! Задание PISA КУРЕНИЕ ТАБАКА Табак курят в виде сигарет, сигар и курительных трубок. Исследования показывают, что заболевания, связанные с курением табака, каждый день убивают около 13500 людей во всем мире. По прогнозам, к 2020 годузаболевания, связанные с курением табака, будут причиной 12% всех смертей в мире. Табачный дым содержит много вредных веществ. Наиболее разрушительные вещества – смола, никотин и угарный газ. Вопрос 6.1 Табачный дым вдыхают в легкие. Смола от дыма оседает в легких, и это нарушает их нормальную деятельность. Что из перечисленного является функцией легких? A .Доставлять насыщенную кислородом кровь ко всем частям вашего тела. B. Насыщать вашу кровь кислородом, которым вы дышите. C .Очищать вашу кровь, уменьшая до нуля количество углекислого газа. D. Превращать молекулы углекислого газа в молекулы кислорода. ОЦЕНКА ВЫПОЛНЕНИЯ ЗАДАНИЯ Ответ принимается полностью – 1 балл. Тип вопроса: c выбором ответа Компетенция: научное объяснение явлений Содержание: системы живой природы Область применения: здоровье Контекст: личностный
|
Презентация в программе Pover Point
Учебник химия 8 класс Автор М.К.Оспанова К.С.Аухадиева Т.Г.Белоусова Алматы : «Мектеп» 2018г
Приятная музыка
Слайд 1-4
Слайд 5
Слайд 6-8
Слайд 9- 10
https://my.mail.ru/mail/gopri/video/47/922.html
Слайд 11
Слайд 12
Слайд 13
Слайд 14
Слайд 15 -16
Слайд 17 -18
Видео you Tube. com
Слайд 18
Слайд 19
Слайд 20
Слайд 21
Слайд 22
Слайд 23-25
|
|||||||||||||||||||
|
Конец урока 2 мин
|
Домашние задание: Дифференцированное домашнее задание А. (слабо мотивированный ученик) параграф 53, стр207вопросы №1.2 Б.(ученик средней мотивации) творческая задание написать эссе «Применение углерода» В.(высокомотивированный
ученик)Решить задачу:Какой объем (н.у) углекислого газа попадет в
вытяжной шкаф, если при прокаливании 20г Никита наденет противопыльную
маску? Примесей
в малахите 5%. Рефлексия
«Дерево успеха»
|
Слайд 26
Слайд 27
|
|||||||||||||||||||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Охрана здоровья и соблюдение техники безопасности |
|||||||||||||||||||
|
1.Создание групп для выполнения практической работы 2.Дифференцированные задания для подготовки домашнего задания с учетом индивидуальных особенностей 3.Темп работы в группе 4.Распределение ролей в группе Успешное выполнение работы взаимооценивание .
|
1.Работа в группе взаимооценивание, слаженность коллектива, правильность выполнения задания. 2.Учетиль оценивает формативным оцениванием(химоны) с помощью поощрительных слов 3.Критериальное оценивание 4.Разноуровневое домашнее задание 5. Ресурсы 6.Образовательные цели
|
|
|||||||||||||||||||
|
Рефлексия по уроку |
|
|
|||||||||||||||||||
|
Общая оценка две вещи, лучше всего прошедшие на уроке (касающиеся преподавания и обучения) 1: 2: Что могло бы посодействовать тому, чтобы урок прошел лучше(касающиеся преподавания и обуч 1Что я выяснил на этом уроке о классе или о достижениях/ затруднениях отдельных учеников на что обратить внимание на следующем уроке?
|
|
||||||||||||||||||||
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.