
Практические задания.
Решите задачи. Укажите типы данных расчетных задач.
Задача 1. Какой объем занимают 5 моль О2 при н.у.?
Дано: n (O2) = 5 моль
V (O2) =?
Решение:
V (O2) = n×22,4 V (O2) = 22,4×5 = 112л.
Ответ: 112 л
Расчет объемов и объемных долей газов с использованием газовых законов (Авогадро, Бойля – Мариотта, Гей-Люссака, Менделеева – Клапейрона).
Задача 2. Какое количество вещества содержит водород объемом 33,6 л при н.у.?
Дано:
н.у. V m = 22, 4 л/моль
V (H 2) = 33,6 л
Найти: ν -?
Решение:
ν (Н 2) = V (Н 2)/V m = 33,6 л/ 22,4 л/моль = 1,5 моль.
Ответ: ν (Н 2) = 1,5 моль.
Вычисление массы вещества по его количеству и обратный расчет.
Задача 3. Какой объем займут 56 г газа СО при н.у.?
M (CO) = Ar (C) + Ar (O) = 12 + 16 = 28 г / моль.
Найти: υ (СО) = m/M = 56 г / 28 г/моль = 2 моль V (CO) -? V (CO) = υ (CO) · Vm = 2 моль · 22,4 л / моль = 44,8 л
Ответ: V (CO) = 44,8 л.
Расчет объемов и объемных долей газов с использованием газовых законов (Авогадро, Бойля – Мариотта, Гей-Люссака, Менделеева – Клапейрона).
Задача 4. В каком объеме содержится 3 · 1023 молекул водорода Н2 при н.у.?
Дано: N(H₂) = 3·10²³ молекул
Найти:V(H₂)
Решение: Vm = 22,4 л\моль Na = 6,023 · 10²³ моль⁻¹ V = N\Na · Vm = 3·10²³\ 6,023 · 10²³ моль⁻¹ · 22,4 л\моль = 11,2 л
Ответ:11,2 л.
Расчет объемов и объемных долей газов с использованием газовых законов (Авогадро, Бойля – Мариотта, Гей-Люссака, Менделеева – Клапейрона).
Задача 5. Какова молярная масса газа, если 1 л его имеет массу 3,17 г?
1)
объем одного моля газа = 22,4 л, значит у нас
n=1/22,4=0.045 (моль)
2) молярная маса M=m/n=3,17/0,045=70,44
(г/моль)
Ответ: 70,44г/моль.
Вычисление массы вещества по его количеству и обратный расчет.
Задача 6. Вычислить массовые доли каждого из элементов, входящих в состав хлорида натрия NaCl.
Mr(NaCl)=23+35,5=58,5 w(Na)=23*1:58,5*100=39% w(Cl)=35,5*1:58,5*100=60%
Определение массовой доли элемента в веществе по его молекулярной массе и наоборот.
Задача 7. Найдите относительную атомную массу серы, если один атом серы имеет массу 53,3 · 10-24 г.
Относительная атомная масса атома показывает во сколько раз атомная масса больше 1 / 12 массы атома углерода.
1) рассчитаем массу 1 / 12 атома углерода
масса атома углерода - 1, 993·10⁻²⁶
значит 1 / 12 массы атома углерода будет
1, 993·10⁻²⁶ / 12 = 0, 166·10⁻²⁶ (кг)
2) рассчитаем во сколько раз масса атома серы больше 1 / 12 массы атома углерода
m(S) / m (1 / 12 C) = 5.
31·10⁻²⁶ / 0.
166·10⁻²⁶ = 31.
99≈ 32
32 - это и есть относительная атомная масса серы.
Ar(S) = 32
значит атом серы в 32 раза больше 1 / 12 массы атома углерода.
Вычисление
массы вещества по его количеству и обратный расчет.
Задача 8. Вещество содержит 1,59% водорода, 22,22% азота и 76,19% кислорода. Определите формулу вещества.
Дано: ω (Н) = 1,59%
ω (N) = 22.22%
ω (O)= 76.19%
Найти: Нх: Ny: Оz.
Решение: H:N:O=X:Y:Z 1,59/1: 22/14: 76,19/16 = 1,59:1,59:4,77 = 1:1:3
Ответ: HNO3.
Вывод формул соединений по количественному составу.
Задача 9. Определите массу раствора с массовой долей карбоната натрия 0,1 и массу кристаллогидрата Na2CO3 10H2O, которые нужно взять для приготовления раствора массой 540 г с массовой долей Na2CO3 = 0,15?
M(Na2CO3*10H2O)=286г/моль
w(Na2CO3)=37,063% масса р-ренного в-ва в новом растворе=540*0,15=81 г
Примем массу 10% раствора за х г, а массу кристаллогидрата за у г, тогда: 0,1x+0,37063y=81 x+y=540 решаем систему х=440,23 г - это масса 10% р-ра у=99,77 г - это масса кристаллогидрата
Ответ: 99,77г.
Вычисление массы вещества по его количеству и обратный расчет.
Задача 10. При сгорании 2,3 г вещества образовалось 4,4 г углекислого газа и 2,7 г воды. Установить формулу вещества.
Дано:
m(в-ва) = 2,3 г
m (CO2) = 4,4 г
m(H2O) = 2,7 г
Д(возд.) = 1,59
МФ в-ва = ?
Решение:
2,3 г 4,4 г 2,7 г
Х + О2 → СО2 + Н2О
Так как при сгорании данного вещества образуется оксид углерода (IV) и вода, то
из этого следует, что в состав данного вещества входят углерод и водород.
4,4 г х г
СО2 С 4,4 г / 44 г = х г / 12 г
1 моль 1 моль
m = 44 г m = 12 г х = 12 * 4,4 / 44 = 1,2 г
2) Найдем сколько граммов водорода содержат 2,7 г воды, столько же
водорода содержалось в веществе
2,7 г х г
Н2О 2Н 2,7 г / 18 г = х г / 2 г х = 2,7 * 2 / 18 = 0,3 (г)
1 моль 2 моль
m = 18 г m = 2 г
3) Находим массу кислорода, содержащегося в веществе:
2,3 г – (1,2 + 0,3) = 0,8 г
4) Находим отношение чисел атомов:
СХНУОZ Х : У : Z = 1,2/12 : 0,3/1 : 0,8/16 = 0,1 : 0,3 : 0,05 = 2 : 6 : 1
Простейшая формула вещества С2Н6О
Mг (C2H6O) = 46
5) Находим относительную молекулярную массу исследуемого
вещества по его относительной плотности паров по воздуху:
Mг (вещ-ва) = Мг возд. * Д возд. = 29 * 1,59 = 46,11
В данном случае постейшая формула С2Н6О является истинной.
Ответ: С2Н6О
Вывод формул соединений по количественному составу.
Задание 2.
Составьте алгоритмы решения расчетных задач:
1. алгоритм вычисления относительных молекулярных масс;
2. алгоритм вычисления массовой доли элемента в веществе по формуле вещества;
3. алгоритм нахождения массовой доли растворенного вещества;
4. алгоритм нахождения массы растворенного вещества, если известны массовая доля растворенного вещества и масса раствора;
5. алгоритм нахождения массы воды, необходимой для приготовления раствора, если известны массовая доля растворенного вещества и масса раствора;
6. алгоритм нахождения массы раствора;
7. алгоритм вычисления количества вещества по известной массе вещества;
8. алгоритм вычисления объемной доли газообразного вещества в газовой смеси;
9. алгоритм вычисления массы газообразного вещества с использованием объемной доли и количества вещества данного соединения в газовой смеси.
При написании алгоритмов необходимо помнить требования к решению и оформлению расчетных задач:
Общий алгоритм решения расчетной задачи:
Она состоит из следующих этапов:
Она состоит из следующих этапов:
4. Провести проверку результатов.
5. Составить условие обратной задачи.
Заполните таблицу:
Алгоритм решения задач на _________
|
Последовательность действий |
Пример выполнения действий |
|
|
|
1. алгоритм вычисления относительных молекулярных масс
1.Записываем символ относительной молекулярной массы Mr. 2.После символа Mr в круглых скобках записываем формульный состав соединения, относительная молекулярная или формульная масса которого вычисляется. 3.Для вычисления относительной молекулярной (или формульной) массы находим сумму произведений относительных атомных масс элементов на соответствующие индексы химической формулы: Пример: Мr(О2) = 2Ar(О) = 2•16 = 32; Mr(NO2) = Ar(N)+2Ar(O) = 14+2•16 = 46; Mr (H2SO4) = 2 Ar (H) + Ar (S) + 4 Ar (O) = 2•1+32+4•16 = 98; Mr (C12H22O11) = 12 Ar (C) +22 Ar (H) +11 Ar (O) = 12•12+22•1 +11•16 = 342.
2. алгоритм вычисления массовой доли элемента в веществе по формуле вещества;
Массовая доля элемента ω(Э) % - это отношение массы данного элемента m (Э) во взятой молекуле вещества к молекулярной массе этого вещества Mr (в-ва).
Массовую долю элемента выражают в долях от единицы или в процентах:
ω(Э) = m (Э) / Мr(в-ва) (1)
ω% (Э) = m(Э) · 100%/Мr(в-ва)
Сумма массовых долей всех элементов вещества равна 1 или 100%.
Как правило, для расчетов массовой доли элемента берут порцию вещества, равную молярной массе вещества, тогда масса данного элемента в этой порции равна его молярной массе, умноженной на число атомов данного элемента в молекуле.
Так, для вещества АxВy в долях от единицы:
ω(A) = Ar(Э) · Х / Мr(в-ва) (2)
Из пропорции (2) выведем расчетную формулу для определения индексов (х, y) в химической формуле вещества, если известны массовые доли обоих элементов и молярная масса вещества:
Х = ω%(A) · Mr(в-ва) / Аr(Э) · 100% (3)
Разделив ω% (A) на ω% (В) , т.е. преобразовав формулу (2), получим:
ω(A) / ω(В) = Х · Ar(А) / У · Ar(В) (4)
Расчетную формулу (4) можно преобразовать следующим образом:
Х : У = ω%(A) / Ar(А) : ω%(В) / Ar(В) = X(А) : У(В) (5)
Расчетные
формулы (3) и (5) используют для определения формулы вещества.
Если известны число атомов в молекуле вещества для одного из элементов и его массовая доля, можно определить молярную массу вещества:
Mr(в-ва) = Ar(Э) · Х / W(A)
Пример 1. Определите массовые доли химических элементов в серной кислоте H2SO4 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу серной кислоты:
Mr (H2SO4) = 1 · 2 + 32 + 16 · 4 = 98
2. Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2 : 98 = 0,0204, или 2,04%;
ω(S) = 32 : 98 = 0,3265, или 32,65%;
ω(О) = 64 : 98 =0,6531, или 65,31%
Пример 2. Определите массовые доли химических элементов в оксиде алюминия Al2O3 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу оксида алюминия:
Mr( Al2O3) = 27 · 2 + 16 · 3 = 102
2. Вычисляем массовые доли элементов:
ω(Al) = 54 : 102 = 0,53 = 53%
ω(O) = 48 : 102 = 0,47 = 47%
Массовая доля вещества - отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) = m(Х) / m,
где ω(X) - массовая доля вещества Х,
m(X) - масса вещества Х,
m - масса всей системы
Массовая доля - безразмерная величина. Её выражают в долях от единицы или в процентах.
Пример 1. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
Молярная масса BaCl2·2H2O составляет:
М(BaCl2·2H2O) = 137+ 2 · 35,5 + 2 · 18 = 244 г/моль
Из формулы BaCl2·2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H2O. Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
m(H2O) = 2 · 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
ω(H2O) = m(H2O)/m(BaCl2 · 2H2O) = 36 / 244 = 0,1475 = 14,75%.
Пример 2. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
|
Дано:
m(Ag )=5,4 г
m = 25 г |
Решение Определяем количество вещества серебра, находящегося в
аргентите: n(Ag ) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль.
Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита: n(Ag2S) = 0,5 · n(Ag) = 0,5 · 0,05 = 0,025 моль Рассчитываем массу аргентита: m(Ag2S) = n(Ag2S) · М(Ag2S) = 0,025 · 248 = 6,2 г . Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г. ω(Ag2S) = m(Ag2S) / m = 6,2/25 = 0,248 = 24,8%. |
3. Алгоритм вычисление массовой доли растворенного вещества
Задание: Вычислить массовую долю соли (NaCl) в растворе, полученном при растворении в 475 г воды 25 г соли.
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать формулу для нахождения массовой доли |
ω (%) = (mв-ва/mр-ра) * 100% |
|
2. |
Найти массу раствора |
mр-ра = m(H2O) + m(NaCl) = 475 + 25 = 500 г |
|
3. |
Вычислить массовую долю, подставив значения в формулу |
ω (NaCl) = (25/500)*100%=5% |
|
4. |
Записать ответ |
Ответ: массовая доля NaCl составляет 5% |
4. алгоритм нахождения массы растворенного вещества, если известны массовая доля Расчет массы вещества в растворе по его массовой доле
Задание: Сколько граммов сахара и воды необходимо взять для получения 200 г 5 % раствора?
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать формулу для определения массовой доли растворённого вещества |
ω = mв-ва/mр-ра mв-ва= mр-ра |
|
2. |
Вычислить массу соли |
mсоли = 200*0,05=10 г |
|
3. |
Определить массу воды |
m(H2O) = mр-ра - mсоли = 200 - 10 = 190 г |
|
4. |
Записать ответ |
Ответ: необходимо взять 10 г сахара и 190 г воды |
растворенного вещества и масса раствора;
5. алгоритм нахождения массы воды, необходимой для приготовления раствора, если известны массовая доля растворенного вещества и масса раствора;
Задача.
Вычислить массу соли и воды, необходимые для приготовления 40 г раствора NаСl с массовой долей 5%.
1. Запишите условие задачи с помощью общепринятых обозначений
Д![]() ано:
ано:
m р-ра = 40г
ω = 5%
![]() m (NаСl) - ?
m (NаСl) - ?
m (Н2О) - ?
Решение:
1. Рассчитайте массу растворенного вещества по формуле:
m в-ва= ω ∙ m р-ра/100%
m (NаСl) = 5% · 40г/100% = 2г
2. Найдите массу воды по разности между массой раствора и массой растворенного вещества:
m р-ля = m р-ра – m в-ва
m (Н2О) = 40г – 2г = 38 г.
3. Запишите ответ.
Ответ: для приготовления раствора необходимо взять 2г соли и 38г воды.
6. алгоритм нахождения массы раствора;
|
Последовательность действий |
Примеры
|
|
1.Прочтите текст задачи.
2.Запишите кратко условие и требование задачи с помощью общепринятых обозначений.
3.Запишите формулу для расчета массы раствора по массе его компонентов: m(р-ра)= m(в-ва)+m(H2O)
4.Запишите формулу для расчета массы раствора по массовой доле растворенного вещества: m(р-ра)=- m(в-ва)-----
5.Полученные в шагах 3и4 формулы сведите в одно уравнение с одним неизвестным х (масса растворенного вещества) и решите его m(р-ра)= m(в-ва)+m(H2O)= m(в-ва)--- m(р-ра)=х х =
6.Вычислите массу раствора по формуле (см. шаги 3 и 4)
7.Запишите ответ
|
1.Рассчитайте массу раствора, содержащего 160г. воды, если массовая доля сульфата меди в нем составляет 0,2.
2.Найти: Решение: m(р-ра)______ Дано: m(H2O)=160г. m(CuSO4)=0,2
3. m(р-ра)= m(CuSO4)+m(H2O)
4.m(р-ра)=- m(CuSO4)-----
5. m(р-ра)= m(CuSO4)+m(H2O)= =m(CuSO4)
m(CuSO4)=х
х+ m(H2O)=-----------=
х=--------------- =- ------- =40г.
6.40+160=200г.
7.Ответ: масса раствора 200г.
|
7. алгоритм вычисления количества вещества по известной массе вещества;
v = m/M
2) Если нам известна масса вещества, то количество вещества находится по следующей формуле:
v = m/M
где
v — количество вещества;
m — масса вещества;
M — молярная масса вещества находится по химической формуле вещества, при помощи периодической системы Д. И. Менделеева, путём суммирования атомных масс всех входящих в молекулу атомов с учётом имеющихся индексов.
8. алгоритм вычисления объемной доли газообразного вещества в газовой смеси;
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
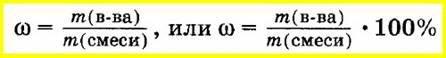
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
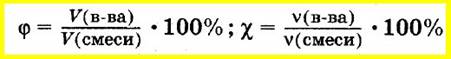
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:

Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
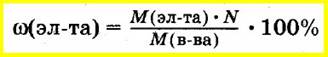
9. алгоритм вычисления массы газообразного вещества с использованием объемной доли и количества вещества данного соединения в газовой смеси.
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
1.Прочитайте текст задачи.
Смесь кальция и оксида кальция массой 5 г обработала водой. В результате реакции выделилось 1,68 л газа (н.у.). Определите массовую долю оксида кальция в исходной смеси.
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
2.Дано:
mсмеси = 5 г
Vгаза = 1,68 л (н.у.)
ω (CaO) = ?
3. Составьте уравнения химических реакций. Оба компонента смеси взаимодействуют с водой, но только при взаимодействии кальция с водой выделяется газ (водород). Поэтому расчёт производим по уравнению 1.
3.Решение:
1) Са + 2Н2О = Са(OН)2 + Н2↑
2) CаO + Н2О = Са(OН)2
4. Над формулами записать, что известно по условию задачи Х г 1,68 л
Са + 2Н2О = Са(OН)2 + Н2↑
4. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу кальция).
Mr (Са) = Ar(Са) = 40
M (Са) = 40 г/моль
m (Са) = 1 моль · 40 г/моль = 40 г
Х г 1,68 л
Са + 2Н2О = Са(OН)2 + Н2↑
6 22,4 л
6. Составьте пропорции и определите массу кальция в смеси
7. Рассчитать массу оксида кальция в смеси
m (CaO) = m (смеси) - m (Са) = 5 г – 3 г = 2 г
8. Рассчитать массовую долю оксида кальция в смеси
количественный метод
выполняем пункты 1 - 3
4. Рассчитать количество газообразного вещества – водорода, зная, что Vm - величина постоянная для любого газа (н.у.) 22,4 л/моль
5. Над формулами записать известные величины и расчётное количество фосфора, под формулой количество фосфора по уравнению реакции (коэффициент перед формулой); составить и решить пропорцию
Х моль 0,075 моль
Са + 2Н2О = Са(OН)2 + Н2↑
1 моль 1 моль
6. Рассчитать массу кальция в смеси
Mr (Са) = Ar(Са) = 40
M (Са) = 40 г/моль
7. Рассчитать массу оксида кальция в смеси
m (CaO) = m (смеси) - m (Са) = 5 г – 3 г = 2 г
8. Рассчитать массовую долю оксида кальция в смеси
Запишите ответ.
Ответ:
10.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.