
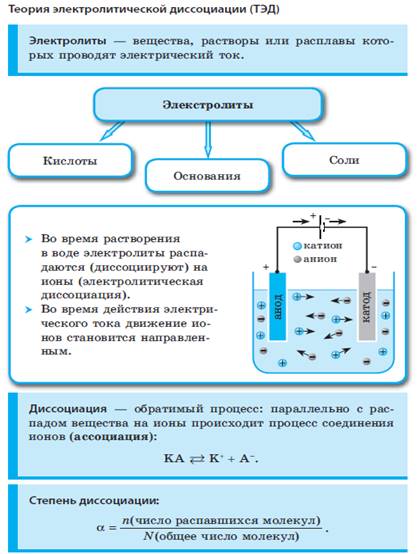
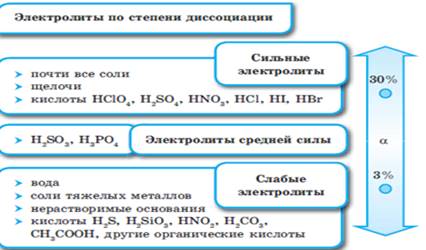
Электролитическая диссоциация.
Водородный показатель§19с 88,№ 2-7.
Кислоты – это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют:
![]()
Распространенные сильные кислоты:
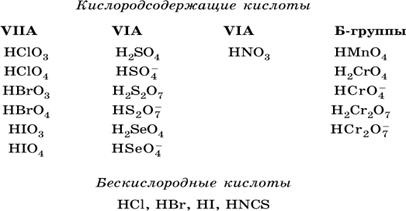
В разбавленном водном растворе (условно до 10 %‑ного или 0,1‑молярного) эти кислоты диссоциируют полностью. Для сильных кислот НnА в список вошли их гидроанионы (анионы кислых солей), также диссоциирующие полностью в этих условиях.
Основания – это электролиты, которые при диссоциации поставляют в водный раствор гидроксид‑ионы и никаких других отрицательных ионов не образуют:

Диссоциация малорастворимых оснований Mg(OH)2, Cu(OH)2, Mn(OH)2, Fe(OH)2 и других практического значения не имеет.
К сильным основаниям (щелочам) относятся NaOH, КОН, Ва(ОН)2 и некоторые другие. Самым известным слабым основанием является гидрат аммиака NH3∙ Н2O.
Средние соли – это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н+, и любые анионы, кроме ОН‑:
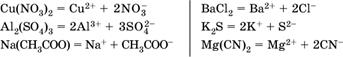
Речь идет только о хорошо растворимых солях. Диссоциация малорастворимых и практически нерастворимых солей значения не имеет.
Аналогично диссоциируют двойные соли:
![]()
Кислые соли (большинство из них растворимы в воде) диссоциируют полностью по типу средних солей:
![]()
Образующиеся гидроанионы подвергаются, в свою очередь, воздействию воды:
а) если гидроанион принадлежит сильной кислоте, то он сам диссоциирует также полностью:
![]()
и полное уравнение диссоциации запишется в виде:
![]()
(растворы таких солей обязательно будут кислыми, как и растворы соответствующих кислот);
б) если гидроанион принадлежит слабой кислоте, то его поведение в воде двойственно – либо неполная диссоциация по типу слабой кислоты:
![]()
либо взаимодействие с водой (называемое обратимым гидролизом):
![]()
При α1 > α2 преобладает диссоциация (и раствор соли будет кислым), а при α1 > α2 – гидролиз (и раствор соли будет щелочным). Так, кислыми будут растворы солей с анионами HSO3‑, H2PO4‑, H2AsO4‑ и HSeO3‑, растворы солей с другими анионами (их большинство) будут щелочными. Другими словами, название «кислые» для солей с большинством гидроанионов не предполагает, что эти анионы будут вести себя в растворе как кислоты (гидролиз гидроанионов и расчет отношения между α1 и а2 изучаются только в высшей школе).
Оснóвные соли MgCl(OH), Cu2CO3(OH)2 и другие в своем большинстве практически нерастворимы в воде, и обсуждать их поведение в водном растворе невозможно.
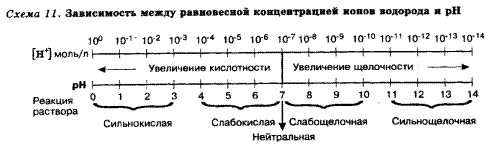
В воде содержание ионов Н+ и ОН одинаково; в водных растворах кислот появляется избыток ионов Н+, в водных растворах щелочей – избыток ионов ОН (за счет диссоциации кислот и оснований).



 1
2 3 4 5 6 7 8
1
2 3 4 5 6 7 8
|
pH13 12 11 9 7 1 2 3 |
|
|
|
р-р NaOH Na2CO3 NH3 NaHCO₃ NaCl HCl CH3COOH AlCl3 |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.