
Зябкина О.А. Учитель химии МБОУ Митрофановской СОШ
Тема:
Соединения алюминия
Элементы содержания: амфотерность оксида и гидроксида алюминия.
Требования к уровню подготовленности выпускников.
Уметь: составлять уравнения реакций с участием соединений алюминия.
Цель: продолжить формирование умений составлять уравнения реакций с участием амфотерных соединений.
Оборудование: растворы хлорида алюминия, гидроксида натрия, соляной кислоты, карбоната натрия, таблицы «Соединения алюминия в природе», образцы минералов и горных пород.
Ход урока
I. Проверка домашнего задания.
Опрос у доски: химические свойства алюминия;
устно: перечислить физические свойства алюминия; объяснить, исходя из электронного строения, почему у алюминия переходные свойства; почему свойства бериллия и алюминия сходны? Проверка упр. 1.
II. Объяснение нового материала.
Вспомните, какие соединения называют амфотерными. Как можно получить гидроксид алюминия? Как доказать его амфотерность?
Учитель проводит опыты, ученики записывают уравнения реакций:
![]()
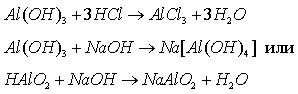
Гидроксид алюминия разлагается при нагревании:
![]()
Оксид алюминия химически пассивен и реагирует с концентрированными кислотами и щелочами при нагревании:
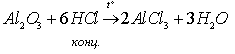
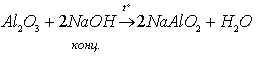
Из расплава оксида алюминия электролизом получают Al:
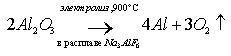
Распознать ионы алюминия можно так:
1) при добавлении к соли алюминия щёлочи выпадает белый осадок, растворяющийся в избытке щёлочи;
2) при добавлении к соли алюминия карбоната натрия выпадает осадок Аl(ОН)3 и выделяется углекислый газ:
![]()
Домашнее задание: § 13, упр. 5, 6.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.