
Справочные материалы по химии для подготовки к ЕГЭ .
Растворимость кислот, оснований, солей в воде, цвет осадка
|
|
|
|
|
ГИДРОЛИЗ СОЛЕЙ ПО КАТИОНУ |
|||||||||||||||||||||
|
|
|
КАТИОНЫ ГИДРОКСИДОВ (ОСНОВАНИЙ) |
|||||||||||||||||||||||
|
|
СИЛЬНЫХ |
СЛАБЫХ |
АМФОТЕРНЫХ |
Слабоамфотерных |
|||||||||||||||||||||
|
|
ИОНЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
OH– |
гидроксид |
|
Р |
Р |
Р |
Р |
М |
Р↑ |
Бл |
Бл |
3 |
Бл |
— |
— |
Бл |
Сз |
Бл |
Бл |
Бл |
Бл |
Бр |
С |
|||
|
|
|
NO3– |
нитрат |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Гд |
Р |
Р |
|
|
SO4 2– |
сульфат |
Р |
Р |
Р |
Р |
Бл |
М |
Р |
Р |
Р |
Р |
Р |
М |
Н Г |
Р |
Р |
Р |
Р |
Бл |
Р |
Р |
Р |
|||
|
I– |
иодид |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Ж |
К |
Р |
М |
Р |
Р |
Ж |
Ок |
— |
— |
|||
|
Br– |
бромид |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Бж |
М |
Р |
Р |
Р |
Р |
Бж |
Гд |
Р |
Р |
|||
|
Cl– |
хлорид |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Бл |
Р |
Р |
Р |
Р |
Р |
Бл |
Р |
Р |
Р |
|||
|
|
|
SO3 2– |
сульфит |
Р↑ |
Р |
Р |
Р |
Бл |
Бл |
Р |
М |
Сз |
3 |
Бл |
Бл |
— |
Гд |
Гд |
Гд |
Бл |
Бл |
— |
— |
НГ |
|
|
PO43 – |
ортофосфат |
Р |
Р |
Р |
Бл |
Бл |
Бл |
Р |
Бл |
Бл |
3 |
Бл |
Ж |
Бл |
Бл |
3 |
Бл |
Бл |
Бл |
Бл |
Бж |
Гл |
|||
|
CH3CO O– |
ацетат |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Гд |
Р |
Н Г |
Р |
Р |
Гд |
— |
Р |
|||
|
CO3 2– |
карбонат |
Р↑ |
Р |
Р |
М |
Бл |
Бл |
Р |
Бл |
Бл |
Н Г |
Бл |
Бж |
Н Г |
Гд |
Гд |
Н Г |
Н Г |
НГ |
Гд |
Гд |
НГ |
|||
|
S2– |
сульфид |
Р↑ |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Ч |
Ч |
Т |
Ч |
Ч |
Гд |
Гд |
Гд |
Бл |
Ч |
Бр |
— |
Ч |
|||
|
SiO3 2– |
метасиликат |
Бл |
Р |
Р |
Бл |
Бл |
Бл |
— |
Бл |
Ср |
Гд |
Т |
— |
— |
Гд |
Гд |
Гд |
Рз |
Бл |
Гд |
Гд |
НГ |
|||
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
Р — растворимые; Р↑ — летучие или распадаются с выделением газа; М — малорастворимые; НГ— осадок основной соли вследствие гидролиза; Гд — соль разлагается водой; черточка (—) — вещество не существует. Цвета осадков: Бл — белый, Бж — бледно-желтый, Бр — бурый, Гл — голубой,Ж — желтый, 3 — зеленый,
К — красный, Ок — оранжево-красный, Рз — розовый, С — синий, Сз — серовато-зеленый, Ср — серый, Т — телесный, Ч — черный.
ОКРАСКА ИНДИКАТОРОВ В РАЗЛИЧНЫХ СРЕДАХ
|
индикатор |
|
среда |
|
|
кислотная |
нейтральная |
щелочная |
|
|
лакмус |
красный |
фиолетовый |
синий |
|
фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
метилоранж |
красный |
оранжевый |
желтый |
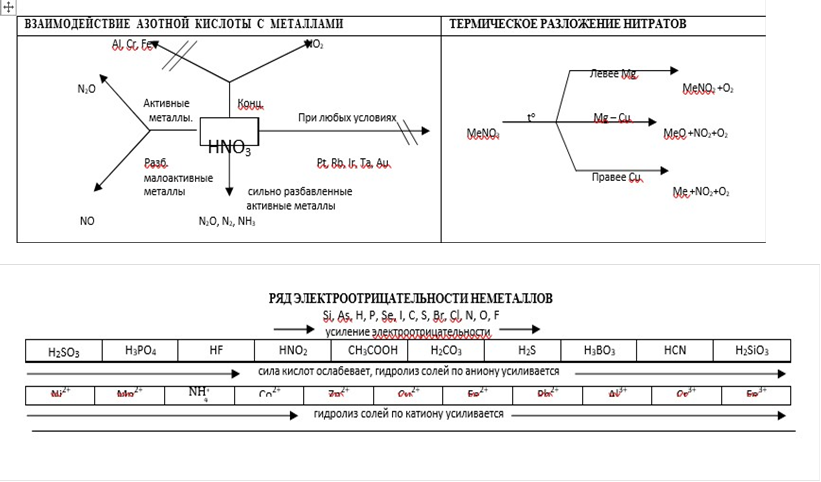
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ МЕТАЛЛОВ С КИСЛОТАМИ
|
Металлы
Кислоты |
Активные металлы (щелочные и щелочноземельные) |
Металлы средней активности |
Малоактивные металлы |
Благородны е металлы |
|
|
K, Ba, Ca, Na, Mg |
Al, Fe, Cr |
Zn , Sn |
Pb, Cu, Hg, Ag |
Au, Pt, Os, Ir |
|
|
H2SO4 конц. |
Соль + H2O + H2S ↑ 8K + 5H2SO4 = 4K2SO4 + 4H2O + H2S 4Ca + 5H2SOS 4 = 4CaSO4 + 4H2O + H2 |
Пассивиру ет металл (При нагревании Со ль +H2O + SO2 ↑ (или NO2)) 2Al+3H2SO4= Al2(SO4)3+4H2 O+SO2 |
Соль +H2O + S или SO2 ↑ Zn + 2H2SO4 = ZnSO4 + 2H2O + SO2 |
Соль + H2O + SO2 ↑ 2Ag+2H2SO4(K)=Ag2SO4 +SO2+2H2O Cu+2H2SO4=CuSO4+SO2 +2H2O |
|
|
HNO3 конц. |
Соль + H2O + N2O или NO ↑ 5H2O + N2O 3 = 4Ca(NO3)2 + 4Ca + 10HNO 8K + 10HNO = 8KNO + 5H O + N2O 3 3 2 |
Соль +H2O + NO2 ↑ Ag+2HNO3 =AgNO3+NO2+H2O Cu+4HNO3=Cu(NO3)2 +2NO2+2H2O |
|||
|
HNO3 разб. |
Соль + H2O + N2O или N2 ↑ |
Соль + H2O + NO ↑ 3Zn+8HNO3=3Zn(NO3)2+4H2O+2NO 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O |
|||
|
HNO3 очень разб. |
Соль + H2O + NH3 (NH4NO3) 8K+10HNO3=8KNO3+5H2O+N H4NO3 8Na +9HNO3 3H 2O+NH3 =8NaNO +3 |
Соль + H2O + N2O (или NH3) 8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O N2O 3 = 4Zn(NO3)2 + 5H2O + 4Zn + 10HNO |
Соль + H2O + NO ↑ 3Cu+8HNO3 =3Cu(NO3)2+2NO+4H 3Ag + 4HNO3 = 3AgNO2O3 + NO + 2H2O |
||
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ
|
|
Окислен- ная форма |
|
|
усиление окислительных свойств ионов |
|
||||||||||||||||||
|
Li+ |
К+ |
Ва2+ |
Са2+ |
Na+ |
Mg2+ |
Be2+ |
Аl3+ |
Мn2+ |
Zn2+ |
Cr3+ |
Fe2+ |
Cd2+ |
Ni2+ |
Sn2+ |
Pb2+ |
Fe3+ |
2H+ |
Cu2+ |
Ag+ |
Hg2+ |
Au3+ |
||
|
Восстанов- ленная форма |
Li |
К |
Ва |
Са |
Na |
Mg |
Be |
Аl |
Мn |
Zn |
Cr |
Fe |
Cd |
Ni |
Sn |
Pb |
Fe |
H2 |
Cu |
Ag |
Hg |
Au |
|
|
|
|
усиление восстановительных свойств атомов |
|
||||||||||||||||||||
|
Е°, В |
-3,04 |
-2,92 |
-2,91 |
-2,87 |
-2,71 |
-2,37 |
-1,85 |
-1,66 |
-1,18 |
-0,76 |
-0,74 |
-0.45 |
-0,40 |
-0,26 |
-0,14 |
-0,13 |
-0,04 |
0,00 |
0,34 |
0,80 |
0,85 |
1,50 |
|
ОКРАСКА ПЛАМЕНИ СОЕДИНЕНИЯМИ ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
|
Металл IA группы |
Окраска пламени |
|
Металл IIА группы |
Окраска пламени |
|
Li |
Карминово-красная |
Be |
|
Нет |
|
Na |
Желтая |
Mg |
|
Нет |
|
K |
Фиолетовая |
Ca |
|
Оранжево-красная |
|
Rb |
Синевато-красная |
Sr |
|
Карминово-красная |
|
Cs |
Синяя |
Ba |
|
Желтовато-зеленая |
ВЗАИМОСВЯЗЬ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
|
|
Металл |
Вода |
Оксид металла |
Основание |
Соль |
|
Неметалл |
Соль Fe+S=FeS |
- |
- |
- |
- |
|
Вода |
Щелочь + Н2 (1) 2Na + H2O=2NaOH+H2 |
- |
Щелочь (4) BaO+H2O=Ba(OH)2 |
- |
- |
|
Оксид неметалла |
- |
Кислота H2O+SO3=H2SO4 |
Соль CaO+CO2=CaCO3 |
Соль + вода 2NaOH+CO2=Na2CO3+ H2O |
- |
|
Кислота |
Соль + Н2 (2) Fe+HCl=FeCl2+H2 |
- |
Соль + вода CaO+2HCl=CaCl2+ H2O |
Соль + вода NaOH+HCl=NaCl+H2O |
Новая соль и новая кислота (6) BaCl2 +H2SO4=BaSO4+2HCl |
|
Соль |
Новая соль и новый металл (8) CuSO4+Fe=FeSO4+Cu |
Гидролиз некоторых солей (3) |
- |
Новая соль и новое основание (5) FeSO4+2NaOH=Fe(OH)2+Na2SO4 |
Две новые соли (7) BaCl2 +FeSO4=BaSO4+FeCl2 |
1. С водой реагируют только активные металлы. Те, которые в ряду напряжения металлов стоят до Mg.
2. С разбавленными серной и соляной кислотой, фосфорной кислотой и некоторыми другими кислотами реагируют только металлы, стоящие в ряду напряжения металлов до Н2. Азотная кислота реагирует с металлами по-другому, водород никогда не выделяется.
3. Гидролизу не подвергаются соли, образованные сильной кислотой и сильным основанием.
4. С водой реагируют только оксиды тех металлов, которые образуют растворимые основания (щелочи).
5. Реакция протекает только, если в результате образуется нерастворимое соединение.
6. Более сильная кислота вытесняет менее сильную из ее соли, менее летучая - более летучую. Условие протекания реакции - образование осадка или газообразного соединения.
7. Условие протекания реакции - образование осадка или газообразного соединения.
8. Более активный металл вытесняет менее активный из его соли (смотреть ряд напряжения металлов).
ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
1S2/2S22P6/3S23P6/4S23d104P6/5S24d105P6/6S24f145d106P6/7S25f146d107P6/8S2…
ТРИВИАЛЬНЫЕ НАЗВАНИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
п/п № |
Тривиальное название |
Химическое название |
Формула |
|
1. |
Азурит |
Карбонат и гидроксид меди (II) |
CuCO3.Cu(OH)2 |
|
2. |
Аланат |
Алюмогидрид лития |
Li[AlH4] |
|
3. |
Алебастр |
Сульфат кальция (полугидрат) |
CaSO4·2Н2О |
|
4. |
Аммонийная селитра |
Нитрат аммония |
NH4NO3 |
|
5. |
Аммонал |
Нитрат аммония, алюминий, углерод |
NH4NO3 + Al + C |
|
6. |
Аммофос |
Гидро и дигидрофосфаты аммония |
NH4H2PO4+(NH4)2HPO4 |
|
7. |
Ангидрит |
Сульфат кальция |
CaSO4 |
|
8. |
Ангидрон |
Перхлорат магния |
Mg(ClO4)2 |
|
9. |
Английская соль |
Декагидрат сульфата магния |
MgSO4·7Н2О |
|
10. |
Апатит |
Фосфат и фторид кальция |
3Ca3(PO4)2.CaF2 |
|
11. |
Арсин |
Гидрид фосфора |
PH3 |
|
12. |
Баритовая селитра |
Нитрат бария |
Ва(NO3)2 |
|
13. |
Белая сажа |
Оксид кремния (IV) аморфный |
SiO2 |
|
14. |
Белый графит |
Нитрид бора (гекс.) |
ВN(гекс |
|
15. |
Берлинская лазурь |
Смесь гексацианоферратов |
KFe[FeII(CN)6] |
|
16. |
Бертолетова соль |
Хлорат калия |
КСlO3 |
|
17. |
Болотный газ |
Метан |
СН4 |
|
18. |
Боразон |
Нитрид бора |
BN(куб.) |
|
19. |
Баритовая селитра |
Нитрат бария |
Ва(NO3)2 |
|
20. |
Баритовые белила |
Сульфат бария |
BaSO4 |
|
21. |
Белый графит |
Нитрид бора |
ВN(гекс.) |
|
22. |
Берлинская лазурь |
Смесь гексацианоферратов |
KFe[FeII(CN)6] |
|
23. |
Бертолетова соль |
Хлорат калия |
КСlO3 |
|
24. |
Боксит |
Дигидрат оксида алюминия |
Аl2О3. 2H2O |
|
25. |
Болотный газ |
Метан |
СН4 |
|
26. |
Бура |
Декагидрат тетрабората натрия |
Na2B4O7·10H2О |
|
27. |
Бурый железняк |
Оксид железа (III) |
2Fe2O3.3H2O |
|
28. |
Бурый газ |
Оксид азота (IV) |
NO2 |
|
29. |
Ванадиевый купорос |
Гептагидрат сульфата ванадия |
VSO4·7H2O |
|
30. |
Веселящий газ |
Оксид азота (I) |
N2O |
|
31. |
Водяной газ |
Оксид углерода (II) и водород |
CO+H2 |
|
32. |
Гашеная известь |
Гидроксид кальция |
Cа(ОН)2 |
|
33. |
Гипс |
Дигидрат сульфата кальция |
CaSO4·2H2O |
|
34. |
Глауберова соль |
Декагидрат сульфата натрия |
Na2SO4·10H2O |
|
35. |
Глина |
Оксиды кремния и алюминия |
Аl2О3 SiO2.nH2O |
|
36. |
Глинозем |
Оксид алюминия |
Аl2О3 |
|
37. |
Горный хрусталь |
Оксид кремния (IV) |
SiO2 |
|
38. |
Горькая соль |
Гептагидрат сульфата магния |
MgSO4. 7H2O |
|
39. |
Гремучее серебро |
Нитрид серебра |
Ag3N |
|
40. |
Гремучий газ |
Водород + кислород (2:1) |
2H2 + O2 |
|
41. |
Двойной суперфосфат |
Дигидрофосфат кальция |
Са(Н2РО4)2 |
|
42. |
Доломит |
Карбонаты кальция и магния |
СаCO3. MgCO3 |
|
43. |
Едкий барит |
Гидроксид бария |
Ва(ОН)2 |
|
44. |
Едкий натр |
Гидроксид натрия |
NaOH |
|
45. |
Едкое кали |
Гидроксид калия |
КОН |
|
46. |
Железная окалина |
Оксиды железа (II и III) |
Fe3O4 |
|
47. |
Железный колчедан |
Сульфид железа |
FeS2 |
|
48. |
Железный купорос |
Гептагидрат сульфата железа (II) |
FeSO4·7H2O |
|
49. |
Желтая кровяная соль |
Гексацианоферрат калия (II) |
K4[Fe(CN)6]·3Н2О |
|
50. |
Жженая магнезия |
Оксид магния |
MgO |
|
51. |
Жженый гипс |
Сульфат кальция |
2CaSO4·H2O |
|
52. |
Известковая селитра |
Нитрат кальция |
Ca(NO3)2·H2O |
|
53. |
Известковая вода |
Раствор гидроксида кальция |
Ca(OH)2 |
|
54. |
Известняк |
|
CaCO3 |
|
55. |
Индийская селитра |
Нитрат калия |
KNO3 |
|
56. |
Кальцинированная сода |
Карбонат натрия |
Na2CO3 |
|
57. |
Кальцит |
Карбонат кальция |
CaCO3 |
|
58. |
Каменная соль |
Хлорид натрия |
NaCl |
|
59. |
Карбид кальция |
Карбид кальция |
CaC2 |
|
60. |
Карборунд |
Карбид кремния |
SiC |
|
61. |
Каустик (каустическая сода) |
Гидроксид натрия |
NaOH |
|
62. |
Кварц |
Оксид кремния |
SiO2 |
|
63. |
Киноварь |
Сульфид ртути |
HgS |
|
64. |
Кипелка |
Оксид кальция |
CaО |
|
65. |
Кобальтовый купорос |
Гептагидрат сульфата кобальта |
CoSO4·7H2O |
|
66. |
Красная кровяная соль |
Гексацианоферрат калия (III) |
К3[Fе(СN)6] |
|
67. |
Корунд |
Оксид алюминия |
Аl2О3 |
|
68. |
Кремнезем |
Оксид кремния |
SiO2 |
|
69. |
Криолит |
Фториды алюминия и натрия 1:3 |
3NaF.AlF3 |
|
70. |
Летучая щелочь |
Гидроксид аммония |
NH4OH |
|
71. |
Лисий хвост |
Оксид азота (IV) |
NO2 |
|
72. |
Ляпис |
Нитраты серебра и калия 1:2 |
AgNO3 . KNO3 |
|
73. |
Магниевая селитра |
Нитрат магния |
Mg(NO3)2·H2O |
|
74. |
Магнезия белая |
Карбонат магния |
MgCO3 |
|
75. |
Малахит |
Гидроксокарбонат меди (II) |
(CuОН)2CO3 |
|
76. |
Медный купорос |
Пентагидрат сульфата меди |
CuSO4·5Н2О |
|
77. |
Мел, мрамор |
Карбонат кальция |
CаCO3 |
|
78. |
Медный блеск |
Сульфид меди (I) |
Сu2S |
|
79. |
Натронная селитра |
Нитрат натрия |
NaNO3 |
|
80. |
Нашатырь |
Хлорид аммония |
NH4Сl |
|
81. |
Нашатырный спирт |
Гидроксид аммония |
NH4ОН |
|
82. |
Негашеная известь |
Оксид кальция |
CаО |
|
83. |
Никелевый купорос |
Гептагидрат сульфата никеля |
NiSO4·7Н2О |
|
84. |
Норвежская селитра |
Нитрат кальция |
Ca(NO3)2·H2O |
|
85. |
Олеум |
Р-р оксида серы(VI) в серной кислоте |
H2SO4 +SO3 |
|
86. |
Пиролюзит |
Оксид марганца (IV) |
MnO2 |
|
87. |
Питьевая сода |
Гидрокарбонат натрия |
NaHCO3 |
|
88. |
Плавиковая кислота |
Фтороводород |
HF |
|
89. |
Поваренная соль - см. |
Хлорид натрия |
NaCl |
|
90. |
Поташ |
Карбонат калия |
K2CO3 |
|
91. |
Преципитат |
Дигидрат гидрофосфата кальция |
СаНРО4·2Н2О |
|
92. |
Пушонка |
Гидроксид кальция |
Са(ОН)2 |
|
93. |
Рудничный газ |
Метан |
СН4 |
|
94. |
Свинцовый крон |
Хромат свинца |
РbСrО4 |
|
95. |
Свинцовый купорос |
Сульфат свинца |
PbSO4 |
|
96. |
Свинцовый сахар |
Тригидрат ацетата свинца (II) |
Pb(СН3СОО)2·3Н2О |
|
97. |
Сернистый газ |
Оксид серы (IV) |
SO2 |
|
98. |
Серный газ |
Оксид серы (VI) |
SO3 |
|
99. |
Силан |
Гидрид кремния (IV) |
SiH4 |
|
100. |
Силикагель |
Гидрат оксида кремния (IV) |
SiO2·nH2O (n<=6) |
|
101. |
Сода кальцинированная |
Карбонат натрия |
Na2CO3 |
|
102. |
Сода питьевая (пищевая) |
Гидрокарбонат натрия |
NaHCO3 |
|
103. |
Сода кристаллическая |
Декагидрат карбоната натрия |
Na2CO3·10Н2О |
|
104. |
Сода каустическая |
Гидроксид натрия |
NaOH |
|
105. |
Сулема |
Хлорид ртути |
HgCl2 |
|
106. |
Суперфосфат двойной |
Гидрат дигидрофосфата кальция |
Ca(H2PO4)2 Н2О |
|
107. |
Суперфосфат простой |
Дигидрофосфат и сульфат кальция |
Ca(H2PO4)2. CaSO4 |
|
108. |
Сусальное золото |
Тонкие листочки Аu |
пластинки SnS2 |
|
109. |
Сухой лед |
Оксид углерода (IV) |
СО2 |
|
110. |
Тальк |
Оксиды магния и кремния |
2MgO . 4SiO2 . H2O |
|
111. |
Титановые белила |
Оксид титана (IV) |
ТiO2 |
|
112. |
Угарный газ |
Оксид углерода (II) |
СО |
|
113. |
Углекислый газ |
Оксид углерода (IV) |
СО2 |
|
114. |
Угольный ангидрид |
Оксид углерода (IV) |
СО2 |
|
115. |
Феррицианид |
Гексацианоферрат калия (III) |
К3[Fе(СN)6] |
|
116. |
Ферроцианид |
Гексацианоферрат калия (II) |
K4[Fe(CN)6] |
|
117. |
Хлорная известь |
Гипохлорит и хлорид кальция |
Ca(ClO)2 + CaCl2 |
|
118. |
Хлористое железо |
Хлорид железа (II) |
FeCl2 |
|
119. |
Хлорное железо |
Хлорид железа (III) |
FeCl3 |
|
120. |
Хромовый купорос |
Гептагидрат сульфата хрома (II) |
CrSO4·7H2O |
|
121. |
Хромпик |
Бихроматы калия, натрия |
К2Сг2О7, Na2Cr2O7· |
|
122. |
Цементит |
Карбид железа (III) |
Fe3C |
|
123. |
Цинковые белила |
Оксид цинка |
ZnO |
|
124. |
Цинковая обманка |
Сульфид цинка |
ZnS |
|
125. |
Цинковый купорос |
Гептагидрат сульфата цинка |
ZnSO4·7H2O |
|
126. |
Циркониевые белила |
Оксид циркония |
ZrO2 |
|
127. |
Чилийская селитра |
Нитрат натрия |
NaNO3 |
|
128. |
Ювелирная бура |
Пентагидрат тетрабората натрия |
Na2B4O7·5H2O |
ТРИВИАЛЬНЫЕ НАЗВАНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
Тривиальное название |
Структурная формула |
Систематическое название |
|
Альдегид муравьиный, формальдегид |
НСНО – |
метаналь |
|
Р-р формальдегида в н2о |
НСНО – |
формалин |
|
Альдегид уксусный ацетальдегид |
СН3-СНО |
– этаналь |
|
Примечание: из аминокислот необходимо знать систематические названия только аминоуксусной и аминопропионовой кислот, для остальных – только тривиальные |
||
|
Аланин |
CH2–CH(NН2)–COOH – |
α-аминопропионовая кислота |
|
Глицин |
H2N–CH2–COOH |
– аминоуксусная кислота |
|
Серин– |
ОН–СН2–СН(NН2)–COOH |
α-амино-β-оксипропионовая кислота |
|
Тирозин |
ОН-С6Н4–СН2–СН(NН2)–COOH – |
β-(пара-оксифенил)-αаминопропионовая кислота
|
|
Фенилаланин–- |
С6Н5–СН2–СН(NН2)–COOH |
α-амино -β-фенилпропионовая кислота |
|
Цистеин |
HS-СН2–СН(NН2)–COOH |
– α-амино-β-тиопропионовая кислота |
|
ацетон |
СН3-С(О)-СН3 |
пропанон |
|
Виноградный сахар |
С6Н12О6 |
глюкоза |
|
Древесный спирт |
СН3ОН |
метанол |
|
Хлоропрен |
СН2=ССlСН=СН2 |
2-хлор-1,3-бутадиен |
|
Фенол (карболовая кислота) |
С6Н5-ОН |
– гидроксибензол |
|
Резорцин |
НО-С6Н4-ОН |
1,3-дигидроксибензол |
|
Плодовый сахар |
С6Н12О6 |
– фруктоза |
|
Пикриновая кислота |
НО-С6Н2-(NО2)3 |
2,4,6-тринитрофенол |
|
Парафины |
CnH2n+2 |
– алканы |
|
Ацетилен
|
CH ≡ CH
|
Этин
|
|
Анилин
|
|
Фениламин
|
|
Бензиловый спирт
|
|
|
|
Винилацетилен |
CH2 = CH — C ≡ CH |
Бутен-1-ин-3 |
|
Дивинил |
H2C = CH — CH = CH2 |
Бутадиен-1,3 |
|
Изобутан
|
|
2-метилпропан
|
|
Изопрен
|
|
2-метилбутадиен-1,3
|
|
Крезол
|
|
Метилфенол
|
|
Ксилол
|
|
Диметилбензол
|
|
Пропилен |
CH2 = CH- CH3 |
Пропен
|
|
Стирол
|
|
Винилбензол
|
|
Толуол
|
|
Метилбензол
|
|
Хлоропрен
|
|
2-хлорбутадиен-1,3
|
|
Кумол
|
|
Изопропилбензол
|
|
Пирогаллол
|
|
1,2,3-тригидроксибензол
|
|
Пирокатехин
|
|
1,2-дигидроксибензол
|
|
Этилен |
СH2 = CH2 |
Этен |
|
Глицерин
|
|
Пропантриол
|
|
Глицерат меди
|
|
|
|
Нитроглицерин
|
|
|
|
Этиленгликоль
|
|
Этандиол
|
|
Тротил*
|
|
2,4,6 – тринитротолуол*
|
|
Хлороформ |
СНСl3 – |
трихлорметан |
|
Фосген |
COCl2 - |
карбонил-хлорид, оксид-дихлорид углерода |
НАЗВАНИЯ РАДИКАЛОВ, ИХ ФОРМУЛЫ
|
Название радикала
|
Структурная форма радикала
|
|
изопропил |
|
|
Бензил
|
|
|
Винил |
H2C = CH — |
|
Фенил |
С6Н5- |
|
|
|
НАЗВАНИЯ ОРГАНИЧЕСКИХ КИСЛОТ, СОЛЕЙ И ЭФИРОВ
|
Название кислоты |
Структурная формула |
Систематическое название |
Названия солей и эфиров |
|
Муравьиная кислота |
HCOOH |
Метановая кислота |
Формиат |
|
Уксусная кислота |
CH3COOH |
Этановая кислота |
Ацетат |
|
Пропионовая |
C2H5-COOH |
Пропановая кислота |
Пропионат |
|
Масляная кислота |
C3H7-COOH |
Бутановая кислота |
Бутират |
|
Валериановая |
C4H9-COOH |
Пентановая кислота |
Валерат |
|
Капроновая |
C5H11-COOH |
Гексановая кислота |
Капролат |
|
Щавелевая к-та |
HOOC-COOH |
Этандиовая кислота |
Оксалат |
|
Бензойная к-та |
C6H5-COOH |
Фенилуксусная к-та |
Бензоал |
|
Акриловая к-та |
H2C = CH-COOH |
Пропеновая кислота |
Акрилат |
|
Метакриловая кислота |
СН2=С(СН3)-СООН – 2- |
метилпропеновая кислота |
|
|
Линолевая к-та |
С17H31СООН |
|
Линолеат |
|
Олеиновая |
С17H33СООН |
|
Олеат |
|
Пальмитиновая |
С15H31СООН |
|
Пальмитат |
|
Пикриновая |
|
2,4,6- тринитрофенол |
Пикрат |
|
Стеариновая |
С17H35СООН |
|
Стеарат |
|
Фталевая |
|
1,2-бензолдикарбоновая кислота |
Фталат
|
|
Терефталевая кислота
|
|
1,4-бензолдикарбоновая кислота
|
Терефталат
|
|
. Изофталевая (мфталевая) кислота |
НООС-C6H4-COOH – 1,3 |
бензолдикарбоновая кислота
|
|
|
Молочная кислота
|
|
2-гидроксипропановая
|
Лактат |
|
Глицин
|
H2N-CH2-COOH |
Аминоуксусная к-та
|
Аминоацетат*
|
|
Аланин
|
|
2-аминопропионовая кислота
|
Аминопропиона |
ЦВЕТА НЕКОТОРЫХ ОКСИДОВ, ОСНОВАНИЙ И СОЛЕЙ
|
Белый |
Черный |
Желтый |
Бурый |
Серо(зеленый) |
Красный |
Голубой |
Розовый |
|
BaSO4 |
FeS |
AgBr |
Fe(OH)3 |
CuSiO3 |
HgI2 |
Cu(OH)2 |
Mn(OH)2 |
|
PbSO4 |
FeSiO3 |
AgI |
(CH3COO)3Fe |
Ni(OH)2 |
CuSO3 |
|
MnSiO3 |
|
Zn3(PO4)2 |
NiS |
Cr(OH)2 |
MnS |
Cr(OH)3 |
Cu2O |
|
MnCO3 |
|
AlPO4 |
CrPO4 |
FePO4 |
MnO2 |
Ni3(PO4)2 |
HgS |
|
|
|
ZnS |
CuS |
(CH3COO)2Sn |
|
NiCO3 |
Ag2CrO4 |
|
|
|
H2SiO3 |
PbS |
BaCrO4 |
|
Fe(OH)2 |
Cu |
|
|
|
Li3PO4 |
Ag2S |
Ag2CO3 |
|
Cr2O3 |
Fe2O3 |
|
|
|
Ba3(PO4)2 |
CuO |
Ag3PO4 |
|
|
|
|
|
|
CaSO3 |
FeO |
PbI2 |
|
|
|
|
|
|
CaSO4 |
Fe3O4 |
|
|
|
|
|
|
|
(CH3COO)2Ca |
|
|
|
|
|
|
|
|
CaCO3 |
|
|
|
|
|
|
|
|
CaS |
|
|
|
|
|
|
|
|
Mg(OH)2 |
|
|
|
|
|
|
|
|
Al(OH)3 |
|
|
|
|
|
|
|
|
Be(OH)2 |
|
|
|
|
|
|
|
|
Pb(OH)2 |
|
|
|
|
|
|
|
|
Sn(OH)2 |
|
|
|
|
|
|
|
|
PbCl2 |
|
|
|
|
|
|
|
ЦВЕТА РАСТВОРОВ СОЛЕЙ
|
зеленый |
сине-голубой |
малиновый |
желто-бурый |
оранжевый |
лимонный |
|
Cr3+ |
Cu2+ |
MnO 4− |
Fe3+ |
Cr2O7 2− |
CrO 42− |
|
Fe2+ |
|
|
|
|
|
|
MnO 42− |
|
|
|
|
|

Осадки белого цвета образуют практически все нерастворимые соединения Ca, Ba, Mg, Al, Zn, Be, Pb. Ag.
Осадки белые, объемные - Mg(OH)2, Zn(OH)2, Be(OH)2, Al(OH)3
Осадки белые, мелкокристаллические - CaCO3 , ВaCO3 , MgCO3 , PbCO3, Са3(РО4)2 , Ва3(РО4)2 , Mg 3(РО4)2 .,
ВaSO4,, Li3РО4, Li2SiO3, Pb SO4, ZnS
FeS, MnS, ZnS реагируют с хлороводородом
ГИДРОЛИЗ
Гидролиз – обменное взаимодействие веществ с водой, приводящее к их разложению. Если рассматривать соли, как продукты взаимодействия кислот и оснований, можно выделить четыре типа солей и три случая гидролиза.
1. Соль сильного основания (щелочи) и сильной кислоты (HCl, HClO4, HClO3,HNO3, H2SO4) гидролизу не подвергается, среда раствора – нейтральная, рН=7.
2. Соль сильного основания (щелочи) и слабой кислоты (HClO, HClO2,
HNO2, H2S, H2SiO3, HF, H2CO3 включая органические кислоты).
Гидролизуется обратимо по аниону, среда раствора – щелочная, рН>7.
3. Соль слабого основания (NH3∙H2O, органические амины, нерастворимые гидроксиды металлов) и сильной кислоты гидролизуется обратимо по катиону, среда раствора – кислая, рН<7.
4. Соль слабого основания и слабой летучей кислоты гидролизуется обратимо по катиону и аниону. Реакция среды зависит от относительной силы кислоты и основания, но близка к нейтральной. Некоторые соли слабого основания и слабой летучей кислоты (H2S, H2CO3, H2SO3) гидролизуются по катиону и аниону необратимо с образованием соответствующей кислоты и основания. Такие соли в таблице растворимости обозначены прочерками.
Среда раствора NaHCO3 –щелочная, рН>7, Na2HPO4– щелочная, рН>7, NaH2PO4– кислая, рН<7
ЭЛЕКТРОЛИЗ
Электролиз –физико-химический окислительно-восстановительный процесс, протекающий в растворах или расплавах электролитов под действием электрического тока, заключающийся в выделении на электродах составных частей растворённых веществ или других веществ - продуктов вторичных реакций на электродах. процесс на катоде K(-): катион принимает электроны и восстанавливается процесс на аноде A(+): анион отдает электроны и окисляется
Электролиз отличается от обычных окислительно-восстановительных реакций. При электролизе полуреакции разделены в пространстве: восстановление происходит только на катоде, а окисление – на противоположном электроде - аноде.
КАТОДНЫЕ И АНОДНЫЕ ПРОЦЕССЫ
|
Li K Ca Na Mg Al |
Mn Zn Fe Ni Sn Pb |
Cu Hg Ag Pt Au |
|
Me+ne¯≠ 2H2O+2e¯=H2+2OH− |
Me+n+ne¯=Me0 2H2O+2e¯=H2+2OH− |
Me+n+ne¯=Me0 |
|
На катоде всегда восстанавливаются молекулы воды |
На катоде могут восстанавливаться и ионы металла, и воды в зависимости от плотности тока, Т и концентрации соли |
На катоде всегда восстанавливаются ионы металлов |
|
Анод |
Кислотный остаток |
|
|
Бескислородный Cl−,Br−,I−,S2− |
Кислородсодержащий NO3−,SO42−,PO43−,F− |
|
|
на аноде окисляются ионы кислотного остатка |
на аноде окисляются молекулы воды |
|
|
нерастворимый |
Окисление аниона (кроме фторидов): Ac m−−me¯=Ac0 |
В щелочной среде: 4OH−–4e¯→2H2O+O2 В кислой, нейтральной среде: 2H2O–4e¯→4H++O2 |
|
|
|
|
|
растворимый |
Окисление металла анода: Me0−ne¯=Me+n анод раствор |
|
ПОЛУЧЕНИЕ НЕКОТОРЫХ МЕТАЛЛОВ ЭЛЕКТРОЛИЗОМ
Cu – раствор CuSO4, Cr – раствор CrSO4, Fe – раствор FeCl2, Ca – расплав CaCl2
Щелочные и щелочноземельные металлы – расплав солей (чаще всего хлоридов).
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.