
«Строение атома»
Цели урока:
Обучающая: ввести понятие радиоактивности, показать её практическое применение.
Развивающая: развивать умение производить наблюдения, делать выводы, обобщать, умение сравнивать, умение выделять главное в тексте.
Воспитывающая: воспитать интерес к предмету и позитивное отношение к учебе; формировать научное мировоззрение, систему взглядов на мир.
Дидактический тип урока: изучение нового материала.
Оборудование:
v таблицы
v мультимедийный проектор
v компьютер
План урока
1. Организационный момент.
2. Актуализация знаний (слайд 2, приложение 1).
3. Мотивация.
4. Изучение нового материала (слайд 3-7).
5. Рефлексия учебная (слайд 8).
6. Закрепление нового материала (слайд 9, приложение 2).
7. Домашнее задание (слайд 10).
Ход урока.
1. Организационный момент.
Готовность учеников к уроку.
2. Актуализация знаний (слайд 2, приложение 1).
3. Мотивация.
Учащимся предлагаем ответить на несколько вопросов.
1. Попробуйте изобразить или представить атом или молекулу?
4. Изучение нового материала (слайд 3-7).
Вариант 1.
Для изучения темы урока загружаем материал, используя ссылку:
http://files.school-collection.edu.ru/dlrstore/669bee8a-e921-11dc-95ff-0800200c9a66/4_2.swf
Если скорость интернета мала или его нет, весь материал для
изучения темы находится на слайдах презентации.
Вариант 2.
Явление радиоактивности давало основания предположить, что в состав
атома входят отрицательно и положительно заряженные частицы. Кроме того, было известно, что атом в целом нейтрален.
Опираясь на эти и некоторые другие факты, английский физик Джозеф Джон Томсон предложил в 1903 г. одну из первых моделей строения атома. По предположению Томсона, атом представляет собой шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрицательному заряду электронов, поэтому электрический заряд атома в целом равен нулю.
Модель строения атома, предложенная Томсоном, нуждалась в экспериментальной проверке. В частности, важно было проверить, действительно ли положительный заряд распределен по всему объему атома с постоянной плотностью. Поэтому в 1911 г. Резерфорд совместно со своими сотрудниками провел ряд опытов по исследованию состава и строения атомов.
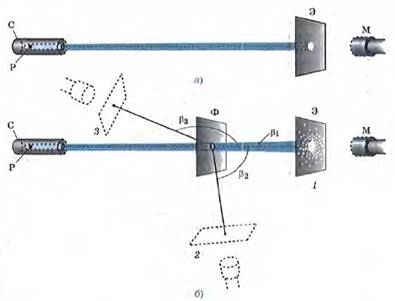
Поскольку α-частицы непосредственно увидеть невозможно, то для их обнаружения служит стеклянный экран Э. Экран покрыт тонким слоем специального вещества, благодаря чему в местах попадания в экран α-частиц возникают вспышки, которые наблюдаются с помощью микроскопа М. Такой метод регистрации частиц называется методом сцинтилляций (т. е. вспышек).
Вся эта установка помещается в сосуд, из которого откачан воздух (чтобы устранить рассеяние α-частиц за счет их столкновений с молекулами воздуха).
Если на пути α-частиц нет никаких препятствий, то они падают на экран узким, слегка расширяющимся пучком (см. рис.). При этом все возникающие на экране вспышки сливаются в одно небольшое световое пятно.
Если же на пути α-частиц поместить тонкую фольгу Ф из исследуемого металла (см. рис. б), то при взаимодействии с веществом α-частицы рассеиваются по всем направлениям на разные углы Р (на рисунке изображены только три угла: (βl, β2 и β3).
Когда экран находится в положении 1, наибольшее количество вспышек расположено в центре экрана. Значит, основная часть всех α-частиц прошла сквозь фольгу, почти не изменив первоначального направления (рассеялась на малые углы). При удалении от центра экрана количество вспышек становится все меньше и меньше. Следовательно, с увеличением угла рассеяния β количество рассеянных на эти углы частиц резко уменьшается.
Перемещая экран вместе с микроскопом вокруг фольги, можно обнаружить, что некоторое (очень небольшое) число частиц рассеялось на углы, близкие к 90е (это положение экрана обозначено цифрой 2), а некоторые единичные частицы — на углы порядка 180е, т. е. в результате взаимодействия с фольгой были отброшены назад (положение 3).
Именно эти случаи рассеяния α-частиц на большие углы дали Резерфорду наиболее важную информацию для понимания того, как устроены атомы веществ. Проанализировав результаты опытов, Резерфорд пришел к выводу, что
столь сильное отклонение α-частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле. Было рассчитано, что такое поле могло быть создано зарядом, сконцентрированным в очень малом объеме (по сравнению с объемом атома).
Поскольку масса электрона примерно в 8000 раз меньше массы α-частицы, электроны, входящие в состав атома, не могли существенным образом изменить направление движения α-частиц. Поэтому в данном случае речь может идти только о силах электрического отталкивания между α-частицами и положительно заряженной частью атома, масса которой значительно больше массы α-частицы.
Исходя из этих соображений, Резерфорд предложил ядерную (планетарную) модель атома. Согласно этой модели в центре атома находится положительно заряженное ядро, занимающее очень малый объем атома. Вокруг ядра движутся электроны, масса которых значительно меньше массы ядра. Атом электрически нейтрален, поскольку заряд ядра равен модулю суммарного заряда электронов.
На основании результатов вышеописанных опытов Резерфорд сумел оценить размеры атомных ядер. Оказалось, что в зависимости от массы атома его ядро имеет диаметр порядка 10-14—10 -15 м, т. е. оно в десятки и даже сотни тысяч раз меньше атома (атом имеет диаметр около 10-10 м).
Таким образом, в результате опытов по рассеянию α-частиц была доказана несостоятельность модели атома Томсона, выдвинута ядерная модель строения атома и проведена оценка диаметров атомных ядер.
5. Рефлексия учебная (слайд 8).
1. Что представлял собой атом, согласно модели, предложенной Томсоном?
Ответ. Равномерно заполненный положительным зарядом шар, внутри которого расположены электроны.
2. Какой вывод был сделан Резерфордом на основании того, что некоторые α-частицы после взаимодействия с фольгой отклонялись на большие углы?
Ответ. Внутри атома находится положительный заряд, сконцентрированный в малом объеме.
3. Что представляет собой атом, согласно планетарной модели Резерфорда?
Ответ. В центре атома располагается ядро, вокруг которого обращаются электроны.
6. Закрепление нового материала (слайд 9, приложение 2).
7. Домашнее задание (слайд 10).
§ 66.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.