При подготовке уроков, внеклассных мероприятий, занятий кружковой работы учителю химии необходимо подбирать постоянно ресурсный материал, который может быть использован на разных этапах работы. Такой материал должен быть интересен для ребят, занимателен и в то же время носить обучающий характер. В предлагаемой разработке даны материалы обобщающего, систематизирующего характера. Материал может быть использован в качестве опоры при повторении тем, подготовке к зачетам выпускным экзаменам.
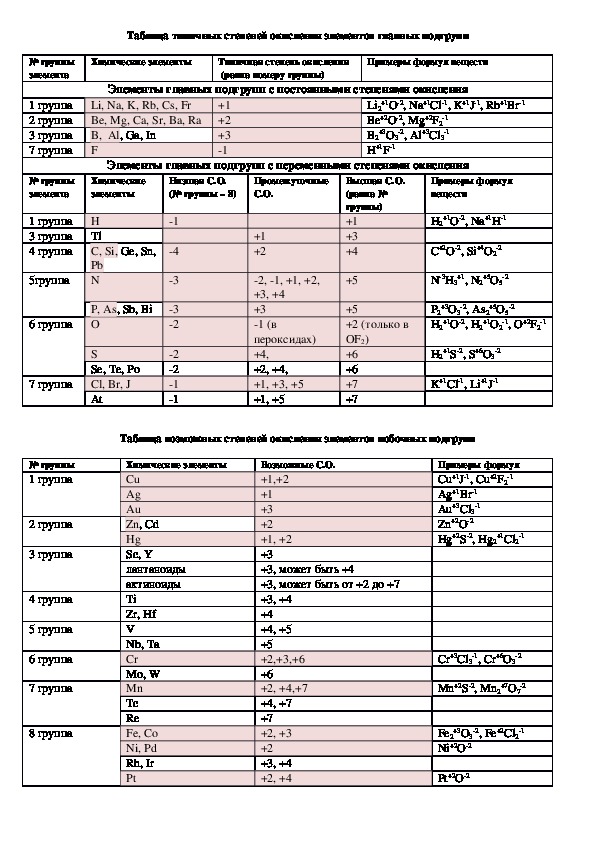
Таблица типичных степеней окисления элементов главных подгрупп
№ группы
элемента
Химические элементы
Типичная степень окисления
(равна номеру группы)
Примеры формул веществ
Элементы главных подгрупп с постоянными степенями окисления
Li, Na, K, Rb, Cs, Fr
1 группа
2 группа Be, Mg, Ca, Sr, Ba, Ra
3 группа B, Al, Ga, In
7 группа
F
+1
+2
+3
1
+1O2, Na+1Cl1, K+1J1, Rb+1Br1
Li2
Be+2O2, Mg+2F2
1
B2
2, Al+3Cl3
+3O3
H+1F1
1
Элементы главных подгрупп с переменными степенями окисления
№ группы
элемента
Химические
элементы
Низшая С.О.
(№ группы – 8)
Промежуточные
С.О.
1 группа
3 группа
4 группа
5группа
6 группа
7 группа
№ группы
1 группа
2 группа
3 группа
4 группа
5 группа
6 группа
7 группа
8 группа
Н
Tl
C, Si, Ge, Sn,
Pb
N
P, As, Sb, Bi
O
S
Se, Te, Po
Cl, Br, J
At
1
4
3
3
2
2
2
1
1
+1
+2
2, 1, +1, +2,
+3, +4
+3
1 (в
пероксидах)
+4,
+2, +4,
+1, +3, +5
+1, +5
Высшая С.О.
(равна №
группы)
+1
+3
+4
Примеры формул
веществ
H2
+1O2, Na+1H1
C+2O2, Si+4O2
2
+5
N3H3
+1, N2
+5O5
2
+5
+2 (только в
ОF2)
+6
+6
+7
+7
P2
H2
+3O3
2, As2
+1O2, H2
+5O5
+1O2
2
1, O+2F2
1
H2
+1S2, S+6O3
2
K+1Cl1, Li+1J1
Таблица возможных степеней окисления элементов побочных подгрупп
Химические элементы
Сu
Ag
Au
Zn, Cd
Hg
Sc, Y
лантаноиды
актиноиды
Ti
Zr, Hf
V
Nb, Ta
Сr
Mo, W
Mn
Tc
Re
Fe, Co
Ni, Pd
Rh, Ir
Pt
Возможные C.O.
+1,+2
+1
+3
+2
+1, +2
+3
+3, может быть +4
+3, может быть от +2 до +7
+3, +4
+4
+4, +5
+5
+2,+3,+6
+6
+2, +4,+7
+4, +7
+7
+2, +3
+2
+3, +4
+2, +4
1
Примеры формул
Cu+1J1, Cu+2F2
Ag+1Br1
Au+3Cl3
1
Zn+2O2
Hg+2S2, Hg2
+1Cl2
1
Cr+3Cl3
1, Cr+6O3
2
Mn+2S2, Mn2
+7O7
2
2, Fe+2Cl2
1
Fe2
+3O3
Ni+2O2
Pt+2O2Ru, Os
+4,+8