
ТОГОАУ ДПО «Институт повышения квалификации работников образования»
Курсы повышения квалификации
«Проектирование образовательного процесса по химии в условиях реализации ФГОС»
Самостоятельная работа
Технологическая карта урока по химии,
10 класс
Авторы:
(Ковтун Е.В., Трегубова Е.Ю.)
Место прохождения стажировки:
(Лицей № 14, г.Тамбов)
Организатор стажировки:
(Матвеева М.В.)
Тамбов 2016
Предмет_органическая химия____________________________________________________________________________________________
Класс 10_________________________________________________________________________________________________________
Тема урока Предельные одноатомные спирты ______________________________________
Тип урока: изучение нового материала
Планируемые результаты обучения:
личностные развитие мотивов учебной деятельности и формирование смысла обучения, социальных и межличностных отношений.
предметные давать определение «спирты», распознавать спирты среди других веществ, составлять формулы спиртов и называть их, классифицировать, описывать физические и химические свойства спиртов.
метапредметные: умение соотносить свои действия с планируемыми результатами; владение основами самоконтроля, самооценки; умение организовывать учебное сотрудничество и совместную деятельность с учителем , одноклассниками
Технологии и техники ИКТ, обучение в сотрудничестве
Оборудование и реактивы: пробирки, штатив для пробирок, этиловый спирт, металлический натрий, лучина, спички, спиртовка, медная проволока, химический стакан
Ресурсы (учебники, наглядные пособия, информационные источники и т.д.) учебник: Габриелян О.С. Химия 10 класс: 2014; таблицы, компьютер, мультимедиа проектор, ЦОР, презентация.
|
Этапы урока (время) |
Деятельность учителя |
Деятельность учащихся |
Формируемые УУД |
Формы оценивания |
|||
|
Личностные |
Регулятивные |
Коммуникативные |
Познавательные |
|
|||
|
1.Организа- ционный момент (1 мин) |
Приветствие учащихся |
Приветствуют учителя |
|
|
|
|
|
|
2.Проверка домашнего задания (5 мин) |
Тестовая проверка знаний (ИКТ) |
Решение теста |
самоопределение
|
оценка, саморегуляция |
|
|
Бальная после проверки учителем |
|
3.Мотивация учебной деятельности, воспроизведение и коррекция опорных знаний, навыков и умений (7 мин) |
Рассказ о значении спиртов для человека. Постановка проблемы: чем обусловлены области применения? От чего зависят свойства веществ? |
Слушают, наблюдают, отвечают на вопросы, выдвигают гипотезы о строении, изомерии, применении делают записи в тетрадь |
смыслообразование |
принимают учебную цель и задачу, прогнозируют оценку, само-регуляция |
слушают учителя, строят высказывания |
анализируют, доказывают, аргументируют свою точку зрения |
словесная |
|
4.Изучение нового материала (10 мин) |
Каждая группа получает свое задание (опережающие задания) : I группа: Составить вопросы по предложенным на карточках текстам II группа: строение спиртов, изомерия. III группа: эксперимент - доказать способность этилового спирта окисляться до ацетальдегида (записать уравнение реакции) |
Ученики I группы работают с текстами и составляют мини-тест
Ученики II группы - составляют изомеры, классифицируют спирты
Ученики III группы -вспоминают правила работы в химической лаборатории, проводят реакции, описывают признаки. |
смыслообразование |
прогно-зирование, коррекция |
коллективно обсуждают материал, взаимно контролируют действия друг друга, работая в парах |
строят логические цепи рассуждений, приводят доказательства
|
взаимопроверка |
|
5. Проверка усвоения нового учебного материала (10мин) |
Предлагает отчитаться груп-пам о проделанной работе.
|
I группа - зачитывает вопросы и просит на них ответить
II группа готовит ответы на доске химическим свойствам спиртов
III группы рассказывает о проведении эксперимента |
смыслообразование; |
прогно-зирование, коррекция |
участвуют в обсуждении содержания материала, дополняют |
осуществляют взаимопроверку |
бальная |
|
5.1. |
Организует работу с использованием ЭОР по теме «Спирты» |
Составление конспекта по презентации |
смыслообразование; |
|
Участвуют в обсуждении содержания материала. |
|
|
|
6.Первичное закрепление материала (10 мин) |
Записать изомеры, их названия, уравнения взаимодействия с натрием, хлороводородом, уксусной кислотой I группа – для гексанола; II группа – для пентанола; III группа – для октанола |
Выполняют задания |
смыслообразование; |
Осуществляют самопроверку |
контролируют действия друг друга, работая в парах |
Выполняют задания. |
Взаимопроверка бальная после проверки учителем |
|
7.Рефлексия (1 мин) |
Вопрос: ваши личные достижения за урок? |
Фронтально отвечают на по-ставленный вопрос. |
|
Самоанализ, самооценивание. |
Обсуждают. |
Анализируют, и оценивают результат. |
Благодарит за урок Оценивание за работу на уроке |
|
9. Домашнее задание (2мин) |
Консультация по выполнению до- машнего задания Подготовить
презентацию по теме « Влияние спиртосодержащих напитков на здоровье
человека». |
Записывают до- машнее задание |
|
|
|
Записывают задание. |
|
Карточки к этапу урока «4.Изучение нового материала»
Задание для первой группы
Составьте вопросы , отражающие тему «Спирты» по предложенным текстам:
1.«За период с 9 по 10 сентября 2001 года, эстонский город Пярну стал известен как место самого массового отравления метиловым спиртом в истории современной Европы. В результате употребления метанола 68 человек погибли, четыре десятка их собутыльников стали инвалидами 2-ой степени, 3 человека стали инвалидами 1-ой степени. Большая часть выживших страдала потерей зрения и острыми поражениями ЦНС и поражениями мозга.
В мае-июле 2011 года 6 российских туристов скончались от отравления метанолом в Турции. С 28 мая в больницы начали поступать российские туристы с жалобами на симптомы острого отравления. Выяснилось, что в напитках, в частности, в коктейле «виски с колой», который употребляли туристы, содержался технический спирт — метанол».
2.«Как ни странно, но дезинфицирующие свойства спирта можно использовать намного шире. Например ,очистить сантехнику в ванной .Если протирать хромированные поверхности ,шланги ,краны, то ополаскивать не нужно. Отчистив, спирт испарится сам.
Зимой спирт, в растворе с водой ,поможет удалить наледь на окнах.
Так нами любимые мобильные телефоны ,можно очистить от грязи и микробов с помощью того же спирта.
Чернильные пятна от ручки на ткани можно перед стиркой замочить на 3 минуты в растворе спирта.
Несмываемый маркер тоже поддастся спирту, если возникла необходимость.»
3.«Кислород гидроксильной группы имеет sp3-гибридизацию. Средние длины связей 0,143 нм (С—О) и 0,091 нм (О—Н). Обе связи полярны. Полярностью группы ОН и. ее способностью образовывать водородные связи объясняют относительно высокие значения т-р кипения и диэлектрич. проницаемости спиртов.
Большинство реакций спиртов протекает с разрывом связей О—H или С—О. Для спиртов характерны также реакции, в которых участвуют H-атом (окисление), b-H-атом (дегидратация) или d-Н-атом (окислит. циклизация).
При взаимодействии спиртов с карбоновыми кислотами образуются сложные эфиры: реакцию проводят в избытке спирта с одновременным удалением воды в присутствии катализаторов (НС1, BF3, H2SO4 и др.).
При действии окислителей (Na2Cr2O7, KMnO'4, N-бром-сукцинимид и др.) первичные спирты превращаются в альдегиды (и далее в к-ты), вторичные - в кетоны (окисление вторичных спиртов в условиях реакции Оппенауэра также приводит к кетонам); такие же превращения могут осуществляться каталитическое дегидрированием спиртов в газовой (напр., пропусканием паров спиртов над Cu, Ag, Cr, Ni) или жидкой фазе (над Rh, Ru, Os). Третичные спирты устойчивы к окислению в нейтральных и щелочных средах, в кислой среде происходит отщепление воды и расщепление углеродного скелета с образованием кетонов или к-т с меньшим числом атомов углерода. В промышленности часто применяют каталитическое окисление спиртов кислородом воздуха (так получают СН2О из СН3ОН, СН3СНО и СН3СООН из С2Н5ОН) и электрохимическое окисление».
Задание для второй группы
Изомерия
спиртов. Изомеры спиртов
имеют одинаковую молекулярную формулу, но разный порядок соединения атомов в
молекулах.
Два вида изомерии спиртов:
1) изомерия
углеродного скелета;
2) изомерия
положения гидроксильной группы в молекуле.
Представим изомеры спирта С5Н11ОН этих двух видов в
линейно-уголковой форме записи:
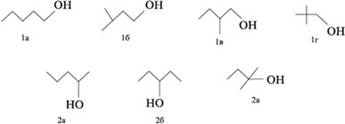
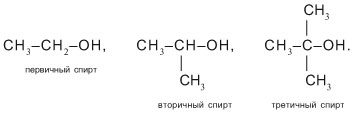
По числу атомов С, связанных со спиртовым (–С–ОН) углеродом, т.е. соседних с ним, спирты называют первичными (один сосед С), вторичными (два С) и третичными (три С-заместителя при углероде –С–ОН). Например:
Задача. Составьте по одному изомеру спиртов молекулярной формулы С6Н13ОН с главной углеродной цепью:
а) С6, б) С5, в) С4, г) С3
и назовите их.
Задание для третьей группы
Проведите эксперимент, Соблюдайте правила работы с огнеопасными жидкостями и нагревательными приборами.
Налейте в пробирку 1 мл этилового спирта. Накалите на пламени спиртовки спираль из медной проволоки. Опустите медную проволоку в пробирку со спиртом.
1. Что происходит с медной проволокой? Обратите внимание на запах образующегося альдегида
2. Сделайте вывод о лабораторном способе получения альдегидов.
3. Составьте уравнение реакции окисления этилового спирта оксидом меди (II).
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.