
муниципальное автономное общеобразовательное
учреждение города Калининграда гимназия № 40
имени Ю.А. Гагарина
Учебно-исследовательская работа
Качественного определение синильной кислоты в растительном материале
Работу выполнил ученик 7-б класса
Карпенков Николай Игоревич.
Научный руководитель:
Сытенкова В.Н., учитель химии.
Калининград, 2020 г.
Содержание
Введение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3-4
1. Теоретическая часть. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5-9
1.1 Горький миндаль. Общая характеристика
1.2 Состав и полезные свойства
1.3 Применение в медицине
1.4 Применение в кулинарии
1.5 Вред, и противопоказания
1.6 Амигдалин
1.7 Берлинская лазурь
2. Практическая часть. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .10-13
2.1 Методика эксперимента
2.2 Реактивы и приборы
2.3 Проведение эксперимента
Заключение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .14
Литература и источники. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
Приложение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .16-20
Введение
При проведении следственных действий при расследовании отдельных преступлений широко применяется качественный анализ. Одним из типов реакций при этом являются реакции осаждения с образованием осадков различного цвета. Специфическим реактивом на ионы 3-х валентного железа является ферроцианид калия, с которым он образует синий осадок берлинской лазури.
Цель работы: качественное определение синильной кислоты в растительном материале.
Задачи работы:
1) познакомиться с необходимой литературой по данной теме;
2) подготовить природное сырьё и необходимые реактивы;
3) провести эксперименты по выбранной методике.
Объект изучения: горький миндаль.
Предмет изучения: качественного определение синильной кислоты в растительном материале.
Рабочая гипотеза: для качественного открытия синильной кислоты в растительном материале можно использовать реакцию с образованием берлинской лазури.
Методы исследования
1) Изучение дополнительной литературы и сбор необходимой информации.
2) Проведение эксперимента.
3) Компьютерные технологии.
Практическая значимость работы. Материалы работы можно использовать при проведении уроков химии, внеклассных мероприятий, кружков и т.п.
1. Теоретическая часть
1.1 Горький миндаль. Общая характеристика
Горький миндаль ценится не меньше сладкого. Из его ядрышек получают миндальное масло, которое широко используется в медицине и входит в состав лекарственных средств. Его часто применяет в косметических целях: изготавливают крема, маски, бальзамы и мыло.
Миндаль — небольшое дерево, которое относится к семейству розоцветных и произрастает в местах с субтропическим климатом. Плодоносит растение на пятый год, а живет в среднем до 150 лет. (См. приложение, рис. №1-3)[1]
Орехи миндального дерева бывают сладкими и горькими. На употребление вторых налагается определенный запрет. Оба сорта очень схожи, и человеку, который не знает, как отличить один косточковый плод от другого, будет полезно узнать об особенностях, пользе и противопоказаниях горьких орехов.
Отличие от сладкого миндаля. Внешне отличить сладкий миндаль от горького очень сложно. Существенной разницы между ними нет. Второй обладает более мелкими размерами и прочной скорлупой, которую можно расколоть лишь плоскогубцами. Еще одно отличие горького миндаля от сладкого – специфический запах. Целое ядро не пахнет, но если его измельчить, то оно обретет насыщенный миндальный аромат, обусловленный наличием амигдалина. Это токсичное вещество, которое попадая в желудок образует яд.
Гликозид амигдалина содержится в ядрах и семенах многих плодовых растений. Если варенье на косточках долго хранится, опасное соединение в нем распадается на глюкозу и синильную кислоту – сильнейший яд. Содержание гликозида амигдалина в яблочных косточках – 0,6%, в вишне –0,8%, в сливах и абрикосах – 1%, в горьком миндале – 3%. В сладкой костянке это значение едва доходит до 0,2%[2]
1.2 Состав и полезные свойства. Орех с горечью имеет те же противопоказания и полезность, что и сладкие сорта. Только в отличии от них,[3] содержит много гликозида амигдалина. Поэтому его нельзя употреблять в пищу без предварительной обработки. Доза из 10 штук может стать смертельной.
Польза горького миндаля обусловлена его составом:
· белки, углеводы;
· витамины Е, А, С, РР и группы В;
· микроэлементы: кальций, железо, цинк, фосфор, магний;
· клетчатка;
· жирные кислоты;
· моносахариды;
Мононенасыщенные жирные кислоты снижают уровень вредного холестерина. Витамин Е защищает кожу и организм от преждевременного старения. Витамин С способствует регенерации, образованию и строению клеток. Микроэлементы улучшают работу сердца, нервной и эндокринной системы, отвечают за формирование и здоровье костей. Содержание биологически активных веществ в горьких сортах превышает концентрацию этих элементов в других орехах. Горькие плоды приносят пользу лишь тогда, когда употребляются в меру и с умом.
В этой сфере горький миндаль превосходит своего собрата. Лечебными свойствами обладают практически все части растения: листья, кора, ядра и скорлупа. Целебные качества этих продуктов известны еще с древних пор.
Листья собирают весной, когда заканчивается цветение, а орехи – осенью. Ядра очищают и высушивают. В дальнейшем из них производят жирное масло, которое добавляют в лечебные мази, инъекции и эмульсии. Врачи выделяют следующие свойства горького миндаля:
· болеутоляющее;
· противопростудное;
· спазмолитическое;
· противовоспалительное;
· послабляющее;
· седативное.
1.4 Применение в кулинарии
Горький миндаль в малых количествах используют для приготовления сладостей, десертов и других блюд. Убрать горечь посредством термической обработки нельзя, зато под действием тепла улетучивается яд, благодаря чему орехи становятся безвредными. Горький миндаль входит в состав многих восточных блюд. Его добавляют исключительно для аромата. В больших количествах не используют, так как горечь плода может испортить весь вкус. Жареный миндальный орех несет ту же пользу, что и сырой. Но при тепловой обработке витамины разрушаются. Единственное преимущество жаренного миндаля в том, что он легче расщепляется в желудке.
1.5 Вред и противопоказания
Вред, который может нанести горький орех, обусловлен высокой калорийностью продукта и токсичным веществом в его составе. Людям с ожирением, нужно ограничить прием ореха, либо полностью исключить его из рациона. Еще одним ограничением к употреблению миндаля является нарушение сердечного ритма.[4]
В процессе расщепления орехов, в организме человека образуется синильная кислота, переизбыток которой чреват сильнейшим отравлением.[5] Смертельная доза для маленького ребенка – 10 горьких косточек, для взрослого – 50. Успокаивает лишь то, что съесть за раз такое количество очень сложно, а все из-за того, что орех горчит. Амигдалин содержится не только в горьковатых ядрах, но и в миндальном масле. Несмотря на это, продукт ценится в медицине, поскольку способен лечить многие заболевания. Врачи не советуют использовать масло самостоятельно, по причине того, что риск отравиться им очень велик. Прежде чем употреблять ядра горького миндаля следует проконсультироваться со специалистом и установить оптимальную суточную дозу. Содержание токсичного вещества – не повод для полного отказа от горького миндаля. При тепловой обработке смертельный яд в составе орехов расщепляется, и они становятся безвредным. Чтобы обезопасить себя, достаточно обжарить ядра миндаля.
1.6 Амигдали́н (от греч. ἀμυγδάλη — миндаль) — органическое соединение. Химическая формула C20H27NO11. Ромбические кристаллы с температурой плавления 215 °C. (См. приложение Рис. №4)
Цианогенный гликозид, содержащийся в ядрах косточек и семенах многих растений рода Слива (Prunus) и трибы Яблоневые (Maleae), придавая им горький вкус. Впервые выделен из горького миндаля Prunus amygdalus var. amara, содержится также в ядрах персиковых и абрикосовых косточек.[6]
1.7 Берлинская лазурь
Краситель замечательного синего цвета с таким поэтическим названием появился в Германии около двухсот лет назад. Полагают, что берлинская лазурь была случайно получена в начале 18 в. в Берлине красильным мастером Дизбахом. Краски на основе берлинской лазури не так уж хороши, как казались вначале: они очень неустойчивы по отношению к щелочам, под действием которых разлагаются с выделением гидроксида железа Fe(OH)3, и поэтому не пригодны для красок, имеющих щелочную реакцию, и для окраски по известковой штукатурке. Поэтому в настоящее время берлинская лазурь имеет лишь ограниченное практическое применение – ее используют, например, для получения печатной краски, синей копирки, подкрашивания бесцветных полимеров типа полиэтилена. Зато сама реакция образования берлинской лазури уже более 200 лет с успехом используется в аналитической химии.
Комплексные ферроцианиды железа нашли широкое применение для качественного анализа растворов на присутствие даже очень малых количеств ионов Fe2+ и Fe3+: синее окрашивание можно заметить, даже если в литре раствора содержится всего 0,7 мг железа! Соответствующие реакции приводятся во всех учебниках аналитической химии.
Реакция на ионы Fe3+: 4FeCl3 + 3K4[Fe(CN)6] →Fe4[Fe(CN)6]3 + 12KCl (образуется берлинская лазурь);
Реакция на ионы Fe2+: 3FeCl2 + 2K3[Fe(CN)6] →Fe3[Fe(CN)6]2 + 6KCl (образуется турнбулева синь).
Однако в 20 веке было установлено, что берлинская лазурь и турнбулева синь – это одно и то же вещество! [7]
FeCl3 + K4[Fe(CN)6] →КFe[Fe(CN)6] ↓ + 3KCl
Берлинская лазурь
FeCl2 + K3[Fe(CN)6] →КFe[Fe(CN)6] ↓ + 2KCl
Турнбулева синь[8]
2. Практическая часть
2.1 Методика эксперимента
Для качественного открытия синильной кислоты в растительном материале применяют цветные пробы:
реакцию с образованием изопурпуровой кислоты и реакцию с образованием берлинской лазури.
Для постановки реакции образования берлинской лазури (только эта реакция имеет значение в судебно-медицинской практике) исследуемый материал измельчают, смешивают с водой до консистенции густой кашицы, подкисляют виннокаменной или щавелевой кислотой и перегоняют с водяным паром. Для реакции используют первые порции дистиллята (около 5 мл), в которые переходит синильная кислота в случае ее наличия в исследуемом материале. К дистилляту, подщелоченному едким натром, последовательно добавляют небольшие количества (несколько капель) раствора сернокислой закиси железа и хлорного железа; смесь хорошо взбалтывают и слабо подкисляют 10%-ным раствором соляной кислоты. На присутствие синильной кислоты указывает образование синего осадка берлинской лазури (в случае значительных количеств синильной кислоты). Образование осадка и окрашивание раствора при ничтожных количествах синильной кислоты могут наступить только через 24—48 часов; окончательно устанавливают результаты реакции только по истечении этого времени.
Для открытия очень малых количеств синильной кислоты можно применить микрореакцию на синильную кислоту. Для воспроизведения этой реакции требуется предметное стекло с лункой и подобранное к нему покровное стекло. В углубление предметного стекла помещают каплю перегона; на нижнюю поверхность покровного стекла — каплю 10%-ного раствора азотнокислого серебра, слегка подкрашенного метиленовой синькой. При наличии в перегоне синильной кислоты жидкость на покровном стекле мутнеет от образования в ней цианистого серебра; под микроскопом видны синие иглы.
2.2 Реактивы и приборы
Сырой горький миндаль (См. приложение. Фото № 1, 2, 6)
Раствор гидроксида натрия (NaOH) 10%
Раствор хлорида железа (III) (FeCl3)
Раствор сульфата железа (II) (FeSO4)
Соляная кислота (HCl) 12%
Ступка с пестиком
Три колбы (плоскодонная и конические)
Воронка
Фильтровальная бумага
Две пробирки
Пипетки
Лакмусовая бумажка
2.3 Проведение эксперимента
Подготовка природного сырья
Для проведения эксперимента надо взять 20 г сырого горького миндаля, снять скорлупу и измельчить ядра пестиком в ступке. (См. приложение. Фото № 3,4) Измельчённый горький миндаль надо поместить в колбу и залить 100 мл воды. (См. приложение. Фото № 5, 7)
Получившуюся суспензию оставляем на 2-3 дня, чтобы амигдалин экстрагировался в раствор. По истечению этого времени вода в суспензии становится мутной, желтоватого цвета, с сильным запахом горького миндаля. Теперь надо отфильтровать данную суспензию, а после фильтрования дать фильтрату отстоятся 1 день, чтобы в осадок выпали нерастворимые частицы горького миндаля, оставшиеся в растворе.
Ещё раз фильтруем раствор и добавляем к фильтрату 5 мл 10% раствора гидроксида натрия (NaOH) для образования цианида натрия (NaCN).
Даём ещё раз раствору постоять 2-3 дня. В осадок выпадают ненужные нерастворимые частицы. Раствор желательно ещё раз отфильтровать, после чего получается готовый для исследования растительный материал.
(См. приложение. Фото № 8-12)
2.4 Постановка эксперимента
Контрольный эксперимент
(См. приложение. Фото №16-18)
Эксперимент с растительным материалом
Для качественного определения наличия цианидов в подготовленном растительном материале нальём в 2 пробирки по 2 мл получившегося раствора. Если у раствора щелочная среда, то его надо аккуратно подкислить 12% раствором соляной кислоты.
В одну пробирку добавим раствор хлорида железа (III) (FeCl3), а в другую раствор сульфата железа (II) (FeSO4).
В 1-й пробирке (куда был добавлен хлорид железа (III)) раствор окрасился в тёмно-красный цвет. Это образовался цианид железа (III) (Fe(CN)3),
(FeCl3 + 3NaCN = Fe(CN)3 + 3NaCl), но гексацианоферрат, то есть берлинская лазурь так и не образовался. (См. приложение. Фото №)
во 2-й пробирке (куда был добавлен сульфат железа (II)) реакция произошла не сразу, изначально никаких изменений не произошло. Через 10-15 сек. раствор начал мутнеть и темнеть, через пол часа в растворе образовался тёмный осадок. Это сначала образовался нерастворимый цианид железа (II) (Fe(CN)2), а потом в избытке цианида он стал гексацианоферратом железа (II).
(FeSO4 + 2NaCN = Fe(CN)2 + Na2SO4 Fe(CN)2 + NaCN = Fe3[Fe(CN)6]2.) (См. приложение. Фото №)
(См. приложение. Фото № 13-15)
2.5 КОНТРОЛЬНЫЙ ЭКСПЕРИМЕНТ:
Возьмём планшет, гексацианоферрат калия (II) (K4[Fe(CN)6]), гексацианоферрат калия (III) (K3[Fe(CN)6]), сульфат железа (II) (FeSO4), и хлорид железа (III) (FeCl3). Нальём в планшет несколько капель гексацианоферрата калия (II), и гексацианоферрата калия (III), далее прильём к гексацианоферрату калия (II) сульфат железа (II), а к гексацианоферрату калия (III) хлорид железа (III). В ячейке куда был добавлен сульфат железа (II) выпал тёмный осадок нерастворимого гексацианоферрата железа (II) (FeSO4 + K4[Fe(CN)6] = Fe3[Fe(CN)6]2 + KSO4), а во второй куда был добавлен хлорид железа (III) образовался синий гексацианоферрат железа (III) то есть берлинская лазурь (FeCl3 + K3[Fe(CN)6] = Fe4[Fe(CN)6]3).
Дата и время начала эксперимента
10.10.20. 14:00
Дата и время окончания эксперимента
16.10.20. 18:00
Заключение
В судебно-медицинской практике реакция с целью качественного открытия синильной кислоты в растительном материале имеет значение только реакция образования берлинской лазури. Этот факт стал определяющим в выборе объекта изучения данной учебно-исследовательской работы. Им стал горький миндаль. Растительный материал и реактивы доступны, методика эксперимента выполнима в рамках школьной и домашней лаборатории.
Горький миндаль имеет специфический запах, обусловленный наличием амигдалина. Это токсичное вещество, которое попадая в желудок, образует яд. Гликозид амигдалина содержится в ядрах и семенах многих плодовых растений. Варенье на косточках при длительном хранении может стать опасным для здоровья и жизни человека. Гликозид амигдалина распадается при этом с образованием синильной кислоты, которая является сильнейшим ядом.
В ходе исследовательской работы изучена дополнительная литература. На основе выбранной методики была осуществлена экспериментальная часть.
Цель работы «Качественное определение синильной кислоты в растительном материале» достигнута. Задачи выполнены. Рабочая гипотеза (для качественного открытия синильной кислоты в растительном материале можно использовать реакцию с образованием берлинской лазури) подтверждена.
Литература и источники
· Быстрые методы определения вредных веществ в воздухе | Перегуд Ева Абрамовна, ... Автор обложке: Е. А. Перегуд, М. С. Быховская, Е. В. Гернет.
https://nutsexpert-ru.turbopages....
· Миндаль обыкновенный — Википедия ru.wikipedia.org › wiki › Ми
· Амигдалин — Википедия ru.wikipedia.org › wiki › Амигдалин
· ЛАЗУРЬ БЕРЛИНСКАЯ | Энциклопедия Кругосвет
www.krugosvet.ru › enc › himiya › lazur-berlinskaya
· Кузнецова Н.Е. Химия: 9 класс: учебник для учащихся общеобразовательных организаций.-М.: Вентана-Графф,2016.
·
Приложение
Фото №1. Фото №2.


Фото №3. Фото №4.


Фото №5. Фото №6.


Фото №7. Фото №8.


Фото№9. Фото№10.


Фото№11. Фото№12.


Фото№13.
 Фото№14.
Фото№14.
Фото№15. 

Фото№16. Фото№17. 

Фото№18.

Рис. №1. Рис.
№4. Структурная формула амигдалина 
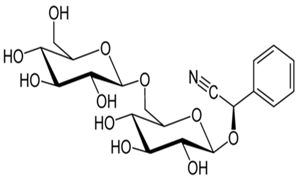
Рис. № 2 Рис. №3.


Скачано с www.znanio.ru
[1] Миндаль обыкновенный — Википедия
ru.wikipedia.org › wiki › Ми
[2] https://nutsexpert-ru.turbopages....
[4] https://nutsexpert-ru.turbopages....
[5] https://nutsexpert-ru.turbopages....
[6] Амигдалин — Википедия
ru.wikipedia.org › wiki › Амигдалин
[7] ЛАЗУРЬ БЕРЛИНСКАЯ | Энциклопедия Кругосвет
www.krugosvet.ru › enc › himiya › lazur-berlinskaya
[8] Кузнецова Н.Е. Химия: 9 класс: учебник для учащихся общеобразовательных организаций.-М.: Вентана-Графф,2016.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.