
Областное государственное бюджетное
профессиональное образовательное учреждение
«Рославльский медицинский техникум»
|
Рассмотрено на заседании ЦМК специальности «Фармация» Протокол № ___ от «___» __________2022 г. _______________ М.В. Терещенкова |
УТВЕРЖДАЮ Зам. директора по УМР ОГБПОУ «Рославльский медицинский техникум» _______________ Л.А. Иванова «___» _______________ 2022 г. |
Контроль качества лекарственных средств – производных фурана
Учебно-методическое пособие
по МДК 02.02 «Контроль качества лекарственных средств»
для студентов специальности 33.02.01 Фармация
Составитель: преподаватель Т.А. Вишневская
Рославль
2022
Учебно-методическое пособие состоит из двух разделов (теоретического и практического), и содержит подробное описание работ по контролю качества лекарственных средств – производных фурана, необходимые для изучения и закрепления теоретического материала по контролю качества и приобретения практических навыков фармацевтического анализа лекарственных средств рассматриваемой группы. В пособии рассмотрен контроль качества лекарственных средств внутриаптечного и промышленного производства. Пособие включает задания для самоподготовки и самоконтроля, а также приложения, необходимые для оформления результатов контроля качества и ведения протоколов анализа.
Учебно-методическое пособие предназначено для самостоятельной подготовки студентов отделения специальности 33.02.01 Фармация, выполнения практических занятий. Методики анализа могут быть рекомендованы для использования в работе провизоров-аналитиков контрольно-аналитических лабораторий и аптек при химическом контроле качества лекарственных средств.
СОДЕРЖАНИЕ
|
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА…………………………………………..... |
5 |
|
РАЗДЕЛ I. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ ОБЩАЯ ХАРАКТЕРИСТИКА ФУРАНА И ЕГО ПРОИЗВОДНЫХ….. Синтез лекарственных веществ – производных 5-нитрофурана. Фармакологическая активность………………………………………..... Физико-химические свойства лекарственных средств – производных 5-нитрофурана…………………………………………….. Методы фармацевтического анализа лекарственных средств – производных 5-нитрофурана…………………………………………….. Общая характеристика и методы фармацевтического анализа лекарственных средств – производных бензофурана………………….. РАЗДЕЛ II. ПРАКТИЧЕСКАЯ ЧАСТЬ КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ – ПРОИЗВОДНЫХ 5-НИТРОФУРАНА…………….……………………….. ПРАКТИЧЕСКОЕ ЗАДАНИЕ 1. Установление подлинности лекарственных средств – производных 5-нитрофурана………………... ПРАКТИЧЕСКОЕ ЗАДАНИЕ 2. Фармакопейный анализ субстанции фурацилина………………………………………………….. ПРАКТИЧЕСКОЕ ЗАДАНИЕ 3. Контроль качества лекарственных средств – производных 5-нитрофурана внутриаптечного изготовления………………………………………….. ПРАКТИЧЕСКОЕ ЗАДАНИЕ 4. Контроль качества лекарственных средств – производных 5-нитрофурана промышленного производства…………………………………………... ЗАДАНИЯ ДЛЯ САМОПОДГОТОВКИ И САМОКОНТРОЛЯ……….. СПИСОК ЛИТЕРАТУРЫ…………………………………………………… ПРИЛОЖЕНИЕ……………………………………………………………..... |
9
9
13
15
22
26
33
35
38
45 52 52 54
|
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
ВЭЖХ – высокоэффективная жидкостная хроматография
ГСО – Государственный стандартный образец
ГЖХ – газо-жидкостная хроматография
ГФ – Государственная Фармакопея
ДНК – дезоксирибонуклеиновая кислота
ЕФ – Европейская Фармакопея
ИК – инфракрасный
КАЛ – Контрольно-аналитическая лаборатория
МЗ РФ – Министерство здравоохранения Российской Федерации
МФ – Международная Фармакопея
НТД – нормативно-техническая документация
ОАО – Открытое акционерное общество
ОКК – Отдел контроля качества
ООО – Общество с ограниченной ответственностью
ОФС – Общая фармакопейная статья
РЛС – Регистр лекарственных средств
ТСХ – тонкослойная хроматография
УФ – ультрафиолетовый
ФС – Фармакопейная статья
ФСП – Фармакопейная статья предприятия
USP – Фармакопея США
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
В настоящее время химия гетероциклических соединений по праву занимает одно из ведущих мест. Долгосрочный и неиссякаемый интерес связан с тем, что гетероциклы не только широко встречаются в природе, входят в состав сложных натуральных молекул, но и с тем, что они, в большинстве своем, обладают важной способностью трансформироваться в другие гетероциклические системы. Это свойство используется не только в живой природе и живых организмах, но широко применяется в лабораторной синтетической практике.
На основе гетероциклических систем создано множество современных лекарственных средств. Получение многих из них стало возможным вследствие изучения биологической активности гетероциклических природных соединений. В свою очередь, изучение их синтетических аналогов служит основой для дальнейшего синтеза новых лекарств.
Гетероциклические системы составляют структуру многих ценнейших лекарственных средств как природного происхождения (алкалоиды, витамины, антибиотики, ферменты), так и синтетических (анальгин, фурацилин, хинозол и др.).
В настоящее время в практической медицине широко используются лекарственные средства – производные фурана (препараты 5-нитрофуранового ряда): фурагин, фурадонин, фуразолидон, фурацилин и эрсефурил. Они отличаются широким спектром антимикробного действия, сравнительно низкой токсичностью и дешевизной получения. Препараты синтезируются на предприятиях Латвии и Китая, а как лекарственные формы выпускаются в Российской Федерации и Республике Белорусь. Планируется внедрить полный производственный процесс отдельных лекарственных средств на предприятиях России «ICN-Лексредства». Субстанция фуразолидона уже сегодня производится на базе ООО «Томский химико-фармацевтический завод».
Лекарственные средства – производные фурана считаются средствами выбора при лечении неспецифических инфекционно-воспалительных заболеваний почек, мочевыводящих путей и органов мочеполовой системы. Применяют их в терапии циститов, острых и хронических уретритов, пиелонефритов и других заболеваний. Следует отметить, что в последние годы обнаружено прооксидантное и цитотоксическое действие препаратов 5-нитрофуранового ряда.
В связи с широким практическим использованием 5-нитрофурановых соединений аналитические методы и методики их определения имеют большое значение. Они необходимы широкому кругу фармацевтов, работникам контрольно-аналитических лабораторий, клиницистам (для создания схем индивидуального дозирования) и другим специалистам, применяющим эти препараты.
Цель: изучить свойства, реакции определения подлинности и методы количественного определения лекарственных средств – производных фурана.
Задачи:
- дать общую характеристику гетероциклической системе – фуран;
- изучить физико-химические свойства лекарственных средств – производных фурана;
- изучить свойства, реакции определения подлинности и методы количественного определения лекарственных средств – производных 5-нитрофурана;
- применить методики качественного и количественного определения лекарственных средств – производных 5-нитрофурана, исходя из имеющихся в лаборатории оборудования и реактивов;
- осуществить контроль качества и дать оценку доброкачественности субстанций лекарственных средств – производных 5-нитрофурана (субстанции фурацилина, фурадонина, фуразолидона) и лекарственных форм с фурацилином внутриаптечного и промышленного производства.
В процессе самоподготовки и теоретических занятий студент должен знать:
- химическую номенклатуру лекарственных средств – производных фурана;
- химические формулы, русские и международные непатентованные названия лекарственных средств – производных 5-нитрофурана, применяемых в медицинской практике;
- реакции определения подлинности и методы количественного определения лекарственных средств – производных 5-нитрофурана;
- условия хранения и применение в медицинской практике лекарственных средств – производных 5-нитрофурана.
В процессе самоподготовки, теоретических и практических занятий студент должен уметь:
- применять методики качественного и количественного определения лекарственных средств – производных 5-нитрофурана, исходя из имеющихся в лаборатории оборудования и реактивов;
- осуществлять контроль качества и давать оценку доброкачественности субстанций лекарственных средств – производных 5-нитрофурана (субстанции фурацилина, фурадонина, фуразолидона) и лекарственных форм с фурацилином внутриаптечного и промышленного производства;
- соблюдать правила охраны труда и техники безопасности при работе в лаборатории контроля качества лекарственных средств ОГБПОУ «Рославльский медицинский техникум».
ПЕРЕЧЕНЬ ОБЩИХ И ПРОФЕССИОНАЛЬНЫХ КОМПЕТЕНЦИЙ,
КОТОРЫМИ ДОЛЖЕН ОВЛАДЕТЬ СТУДЕНТ
ПО ИТОГАМ ВЫПОЛНЕНИЯ ПРАКТИЧЕСКОЙ ЧАСТИ
|
ПК 2.3 |
Владеть обязательными видами внутриаптечного контроля лекарственных средств |
|
ПК 2.4 |
Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности, противопожарной безопасности |
|
ПК 2.5 |
Оформлять документы первичного учета |
|
ОК 1 |
Понимать сущность и социальную значимость будущей профессии, проявлять к ней устойчивый интерес |
|
ОК 2 |
Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество |
|
ОК 3 |
Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность |
|
ОК 5 |
Использовать информационно-коммуникативные технологии в профессиональной деятельности |
|
ОК 6 |
Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями |
|
ОК 8 |
Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразование, осознанно планировать повышение своей квалификации |
РАЗДЕЛ I. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
ОБЩАЯ ХАРАКТЕРИСТИКА ФУРАНА И ЕГО ПРОИЗВОДНЫХ
Гетероциклические соединения (гетероциклы) – органические соединения, содержащие циклы, в состав которых наряду с углеродом входят и атомы других элементов. Могут рассматриваться как карбоциклические соединения с гетерозаместителями (гетероатомами) в цикле.
Фуран (оксол-2,4-диен) – органическое соединение с формулой C4H4O, пятичленный гетероцикл с одним атомом кислорода. Представляет собой бесцветную жидкость с характерным запахом.
Сам фуран не обладает физиологической активностью, но его нитропроизводные, особенно 5-нитрофураны, обладают антибактериальной активностью и применяются в медицине в виде различных производных.
Фуран – родоначальник большой группы органических соединений, многие из которых имеют практическое значение, например фурфурол, тетрагидрофуран, α-метилфуран (сильван).
Фуран является ароматическим соединением с шестью p-электронами.
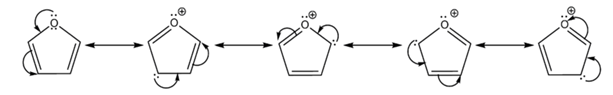
Фуран был впервые синтезирован в 1870 году.
Изучение химиотерапевтического действия 5-нитрофуранов было начато в нашей стране в 1943 г. Работа проводилась под руководством академика С. А. Гиллера. В этом институте были созданы фурацилин, фурадонин, фуразолидон.
Синтез лекарственных веществ – производных 5-нитрофурана.
Фармакологическая активность
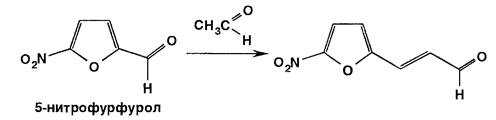
Исходным продуктом для синтеза всех препаратов нитрофуранового ряда является весьма доступное вещество – фурфурол, получаемый из отходов различных сельскохозяйственных продуктов (кукурузные кочерыжки, подсолнечная лузга и др.).
Используемые в качестве лекарственных веществ, производные 5-нитрофурана имеют различные заместители в положении 2:
Из многочисленных синтезированных в 50-е гг. XX в. в Институте органического синтеза Академии наук Латвии (С.А. Гиллер, К.К. Вентер, Р.Ю. Калнберг) производных нитрофурана в качестве химиотерапевтических средств наиболее широко в настоящее применяют: нитрофурал (фурацилин), нитрофурантоин (фурадонин), фуразолидон, фуразидин (фурагин).
Исходный продукт синтеза производных 5-нитрофурана – фурфурол (α-фурилальдегид). Его получают из отходов деревообрабатывающей промышленности, а также из соломы, шелухи подсолнечника, коробочек хлопчатника путем обработки разведенной серной кислотой и отгонки с водяным паром. При этом происходит образование фурфурола из пентоз (моносахаридов) и пентозанов (полисахаридов), содержащихся в этом сырье.
Промышленным способом получения фурфурола – фуран-2-карбальдегида – является кислотный гидролиз полисахаридов, в состав которых входят пентозы – пятиатомные сахара, содержащиеся в различном растительном сырье.
Фурфурол получают из шелухи семян подсолнечника, кукурузных початков, соломы, отрубей, вследствие чего он и получил свое название (латинское furfur – отруби).
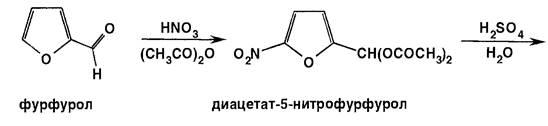
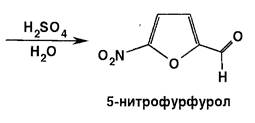
Из фурфурола нитрованием получают 5-нитрофурфурол. Процесс этот наиболее экономичен при последовательном получении вначале диацетата 5-нитрофурфурола, который затем гидролизуется разведенной серной кислотой до 5-нитрофурфурола:
Дальнейший синтез основан на конденсации 5-нитрофурфурола с различными веществами, содержащими аминогруппу, по общей схеме:
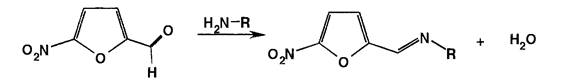
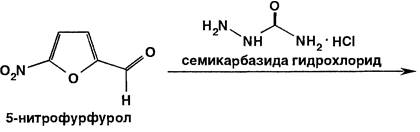
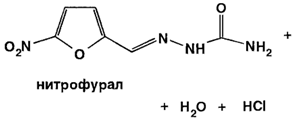
Для синтеза нитрофурала на 5-нитрофурфурол действуют семикарбазида гидрохлоридом:
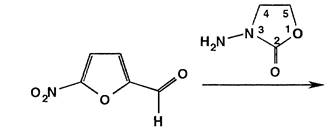
Фуразолидон синтезируют аналогично конденсацией 5-нитрофурфурола с З-аминооксазолидоном-2:
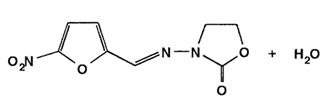
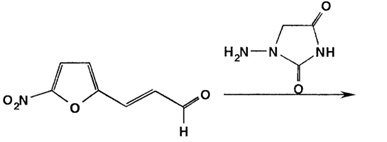
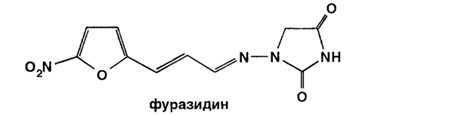
При синтезе фуразидина, у которого иминная группа отделена от нитрофуранового фрагмента этиленовым радикалом, 5-нитрофурфурол вначале конденсируют с ацеталъдегидом, а затем сочетают с l-аминогидантоином:
Таким образом, основу химической структуры лекарственных средств, производных фурана, составляет пятичленный кислородсодержащий гетероцикл. В медицинской практике используют лекарственные средства - производные 5-нитрофурфурола (фурфураля, 2-фуранкарбальдегида).
Общая формула лекарственных средств – производных фурана следующая:
Лекарственные препараты – производные 5-нитрофурфурола – антибактериальные средства широкого спектра действия в отношении грамположительных и грамотрицательных бактерий, некоторых крупных вирусов, трихомонад, лямблий. В зависимости от характера заместителя наблюдаются некоторые различия в спектре их антибактериального действия. Например, фурацилин влияет на грамотрицательные и грамположительные бактерии. Фуразолидон наиболее эффективен в отношении грамотрицательных бактерий, а также трихомонад и лямблий. Фурадонин и фурагин наиболее эффективны при инфекциях мочевых путей. Особенности действия препаратов определяют показания к применению и способы использования отдельных препаратов.
В основе механизма антибактериальной активности лекарственных средств – производных фурана лежит нарушение синтеза ДНК и белка клеток микроорганизмов. При этом –NО2-rpyппa восстанавливается до аминогруппы –NH2.
Физико-химические свойства лекарственных
средств – производных 5-нитрофурана
Производные нитрофурана сходны по физическим свойствам. Это желтые с зеленоватым оттенком кристаллические вещества, без запаха. Они очень мало растворимы или практически нерастворимы в воде и этаноле (нитрофуран очень мало и медленно растворим), мало или умеренно растворимы в диметилформамиде, мало или очень мало в ацетоне.
Ввиду наличия не только нитро-, но и имидной группы нитрофурал проявляет в растворах кислотные свойства и лучше других растворяется в щелочах. В кипящей воде нитрофурал растворим в соотношении 1:5000.
Фуразидин выпускают также в виде растворимой в воде калиевой соли (табл. 1).
Таблица 1. Физико-химические свойства
лекарственных средств – производных 5-нитрофурана
|
Наименование (русское, английское, латинское). Химическая формула. Молекулярная масса. Применение в разных странах |
Фармакологическая группа. Лекарственная форма. Условия хранения |
Физико-химические свойства |
|
Нитрофурал Nitrofural Nitrofuralum
(Фурацилин, Furacilinum)
2-[5-Нитро-2-фуранил) метилен] гндра-зинкарбоксамид
C6H6N404 198,14 ГФ, РЛС, ЕФ |
Антибактериальное средство. Применяют для лечения и предупреждения гнойно-воспалительных процессов и внутрь для лечения бактериальной дизентерии.
Порошок, таблетки по 0,1 г для приема внутрь, по 0,2 г с NaCl для наружного применения, 0,2 % мазь, в дозе 0,02-0,022 г входит в состав фурапласта, клефурина (полимерные жидкости), лифузоль (0,004-0,008 г) (аэрозоль для наружного применения).
Хранение: по списку Б в хорошо укупоренных банках темного стекла в прохладном, защищенном от света месте, таблетки – в защищенном от света месте. |
Желтый или коричнево-желтый мелкокристаллический порошок без запаха.
Температура плавления 230-236 0С.
Очень мало растворим в воде, мало в спирте, растворим в щелочах.
Фотолабилен. |
|
Нитрофурантоин Nitrofurantoin Nitrofurantoinum
(Фурадонин, Furadoninum)
1 - [[(5-Нитро-2-фуранил)-метилен] амино]-2,4-имидазолидиндион (и в виде натриевой соли)
C8H6N405 238,10 ГФ, РЛС, ЕФ, USP, МФ |
Антибактериальное средство. Применяют для лечения пиелита, пиелонефрита, цистита, уретрита, для предупреждения инфекций при урологических операциях, цистоскопии, катеризации.
Таблетки по 0,05 г и таблетки, растворимые в кишечнике, по 0,1 г в оболочке. Хранение: по списку Б в сухом, защищенном от света месте. |
Желтый или оранжево-желтый мелкокристаллический порошок без запаха, горький на вкус. Температура плавления 258-263 °С (плавится с разложением) Практически нерастворим в воде и спирте. Фотолабилен. |
|
Фуразолидон Furazolidone Furazolidonum
3- [[(5-Нитро-2-фуранил)метилен]-амино] – 2-оксазолидинон
C8H7N305 225,16 ГФ, РЛС
|
Антибактериальное средство. Применяют для лечения дизентерии, паратифа, пищевых токсикоинфекций, трихомонадных кольпитов и уретритов, лямблиоза.
Таблетки по 0,05 г для приема внутрь.
Хранение: по списку Б в защищенном от свете месте. |
Желтый или зеленовато-желтый порошок без запаха, слабогорький на вкус.
Температура плавления 253-258 °С (с разложением).
Практически нерастворим в воде, очень мало в спирте.
Фотолабилен. |
|
Фуразидин Furazidin Furazidinum
(Фурагин, Furaginum)
1-[[3-(5-Нитро-2-фуранил)-2-пропени-лиден] амино]-2,4-имидозолидиндион
C10H8N4O5 264,12 ГФ, РЛС |
Антибактериальное средство. Применяют при остром и хроническом пилонефрите, циститах, уретритах, при инфекции после операционных вмешательств мочеполовой системы. Используют внутрь и наружно. Внутрь назначают для лечения инфекционных заболеваний мочевых путей. Наружно для промывания и спринцевания в хирургической и акушерско-гинекологической практике, для лечения гнойных ран, ожогов, промывания свищей. В офтальмологии при конъюнктивитах, кератитах, послеоперационный период. Фурагин растворимый позволяет проводить внутривенное введение.
Порошок, таблетки по 0,05 г.
Хранение: по списку Б в сухом защищенном от свете месте.
|
Желтый или оранжево-желтый мелкокристаллический порошок без запаха, горький на вкус.
Практически нерастворим в воде и спирте.
Фотолабилен.
|
Методы фармацевтического анализа лекарственных
средств – производных 5-нитрофурана
В основе определения подлинности, испытаний на чистоту и количественном определении лекарственных средств рассматриваемого класса лежат реакции, в которых эти вещества проявляют кислотные свойства, подвергаются гидролитическому расщеплению, взаимодействуют с окислителями.
Все лекарственные вещества данного класса можно рассматривать как слабые кислоты. При этом кислотные свойства усиливаются за счет электроноакцепторной способности нитрогруппы и карбонильного кислорода. Так, фурацилин и фурадонин относятся к NH-кислотам. Как кислоты производные фурана взаимодействуют с органическими и неорганическими основаниями.
Реакции с разбавленными щелочами приводят к изменению окраски. Например, взаимодействие с разбавленной щелочью фурацилина приводит к образованию соли оранжево-красного цвета.
Используемые для испытаний производных 5-нитрофурана химические реакции основаны на их гидролитическом расщеплении, окислительно-восстановительных, кислотно-основных свойствах, образовании ацисолей (нитрогруппа):
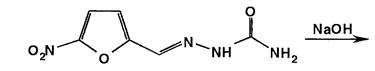
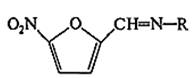
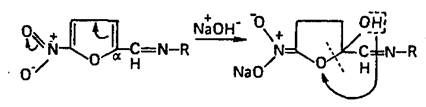
Подлинность производных 5-нитрофурана устанавливают по цветной реакции с водным раствором гидроксида натрия. Структура образующихся продуктов находится в зависимости от условий проведения реакции, особенностей химического строения производных 5-нитрофурана, температуры, растворителя и концентрации реактива.
Нитрофурал при использовании разбавленных растворов щелочей образует ацисоль, окрашенную в оранжево-красный цвет.
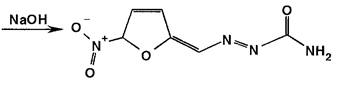
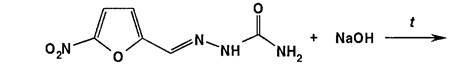
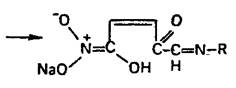
При нагревании нитрофурала в растворах гидроксидов щелочных металлов происходит разрыв фуранового цикла и образуются карбонат натрия, гидразин и аммиак. Последний обнаруживают по изменению окраски влажной красной лакмусовой бумаги:
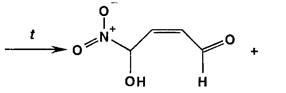
![]()
Фуразидин после нагревания (2 мин.) с 30%-ным раствором гидроксида натрия приобретает коричневое окрашивание. Нитрофурантоин в разбавленных растворах щелочей при комнатной температуре образует в результате таутомерных превращений гидантоина ацисоль, окрашенную в темно-коричневый цвет:
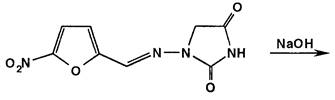
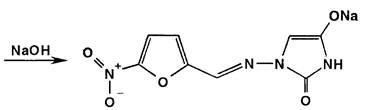
Раствор фуразолидона в тех же условиях, но при нагревании приобретает бурое окрашивание за счет разрыва лактонного цикла и образования ацисоли:
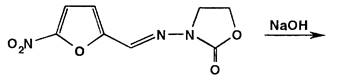
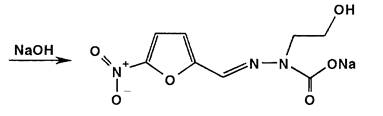
Эта реакция может быть использована для отличия нитрофурала от нитрофурантоина и фуразолидона.
Фуразолидон и нитрофурантоин можно отличить друг от друга по различной окраске продуктов взаимодействия с едкими щелочами в среде неводных растворителей основного характера, например диметилформамида.
В качестве реактива используют водно-спиртовый раствор гидроксида калия. Нитрофурантоин при этом последовательно окрашивается в желтый, а затем в коричневато-желтый и светло-коричневый цвет. Фуразолидон приобретает красно-фиолетовое окрашивание, переходящее в темно-синее, а затем в фиолетовое или красно-фиолетовое.
Характерные цветные реакции, позволяющие отличать друг от друга производные 5-нитрофурана, дает спиртовый раствор гидроксида калия в сочетании с ацетоном: нитрофурал приобретает темно-красное окрашивание, нитрофурантоин – зеленовато-желтое, переходящее в бурое с выпадением бурого осадка, фуразолидон – постепенно появляющееся красное окрашивание, переходящее в бурое, фуразидин приобретает красное окрашивание с выпадением объемного красного осадка.
Нитрофурал, нитрофурантоин и фуразолидон идентифицируют с помощью общей реакции образования 2,4-динитрофенилгидразона (температура плавления 273°С). Он выпадает в осадок при кипячении раствора лекарственного вещества в диметилформамиде с насыщенным раствором 2,4-динитрофенилгидразина и 2 М раствора хлористоводородной кислоты.
Раствор нитрофурала в диметилформамиде после добавления свежеприготовленного 1% раствора нитропруссида натрия и 1 М раствора гидроксида натрия дает красное окрашивание. Нитрофурантоин в этих условиях приобретает желтое, а фуразолидон (через 5 мин.) – оливково-зеленое окрашивание.
Производные нитрофурана образуют в слабощелочной среде окрашенные нерастворимые комплексные соединения с солями серебра, меди, кобальта и других тяжелых металлов. При добавлении к раствору нитрофурантоина (в смеси диметилформамида и воды) 1%-ного раствора сульфата меди (II), нескольких капель пиридина и 3 мл хлороформа после встряхивания хлороформный слой приобретает зеленое окрашивание. Комплексные соединения нитрофурала и фуразолидона в этих условиях не извлекаются хлороформом.
Окислительно-восстановительные реакции (образования «серебряного зеркала», с реактивом Фелинга) могут быть выполнены после щелочного гидролиза, сопровождающегося образованием альдегидов.
При испытаниях на чистоту устанавливают в производных 5-нитрофурана допустимое содержание посторонних примесей (от 0,4 до 1%). Испытания выполняют методом тонкослойной хроматографии, используя готовые хроматографические пластинки типа Силуфол УФ-254 или Силикагель Г, различные системы растворителей для восходящей хроматографии. Проявителем служит фенилгидразина гидрохлорид или УФ-свет при длине волны 254 нм. Сравнивают со свидетелями количество, величину и окраску пятен на хроматограммах. В фуразидине определяют отсутствие легкообугливающихся (при 250°С) примесей.
Количественное определение проявляющего восстановительные свойства нитрофурала выполняют йодометрическим методом, основанным на окислении йодом в щелочной среде (для улучшения растворимости к навеске прибавляют хлорид натрия и смесь подогревают). Титрованный раствор йода в щелочной среде образует гипойодит:
I2 + 2 NaOH → NaI + NaIO + H2O
Гипойодит окисляет нитрофурал до 5-нитрофурфурола:
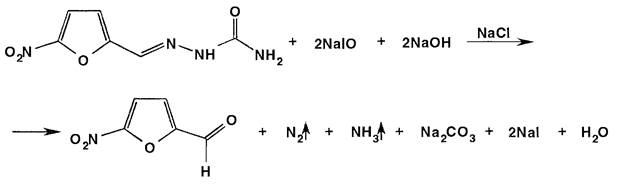
После окончания процесса окисления нитрофурала раствор подкисляют и титруют выделившийся избыток йода тиосульфатом натрия:
NaI + NaIO + H2SO4 → I2 + Na2SO4 + H2O
I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6
Нитрофурантоин (по ФС) и фуразолидон, проявляющие слабые основные свойства, количественно определяют методом неводного титрования в диметилформамиде. Титруют 0,1 М раствором метилата натрия (индикатор тимоловый синий).
Известен способ определения нитрофурала броматометрическим методом, основанным на окислении гидразиновой группы в присутствии концентрированных кислот при температуре 80-90°С:
Н2N – NH2 → N2 ↑ + 2 H2O
Фуразидин-калий количественно определяют ацидиметрически, титруя 0,01 М раствором хлороводородной кислоты (индикатор бромтимоловый синий).
Для установления подлинности и количественного определения нитрофурала используют УФ-спектры его 0,0006 % растворов в смеси диметилформамида с водой (1:50). Максимумы поглощения такого раствора в области 245-450 нм находятся при 260 и 375 нм, а минимум – при 306 нм. Максимумы второй полосы поглощения (365-375 нм) более специфичны для производных 5-нитрофурана, т. к. обусловлены наличием различных электронодонорных групп в положении 2 фуранового цикла. Количественное спектрофотометрическое определение выполняют при 375 нм и рассчитывают содержание с использованием стандартного образца нитрофурала.
Для испытания подлинности нитрофурантоина, фуразолидона и фуразидина используют УФ-спектры растворов в области 240-450 нм. Растворителем служит диметилформамид с водой или ацетатным буферным раствором. В этих условиях нитрофурантоин имеет максимумы поглощения при 266 и 367 нм; фуразолидон – максимумы при 260 и 367 нм и минимум при 302 нм; фуразидин – максимумы при 292 и 396 нм.
Количественное спектрофотометрическое определение фуразолидона выполняют при 367 нм (растворитель 0,5 % раствор диметилформамида в воде). Содержание рассчитывают по ГСО фуразолидона или по величине удельного показателя поглощения (750). Фуразидин количественно определяют при длине волны 396 нм (растворитель 0,6 % раствор диметилформамида в ацетатном буферном растворе). Расчеты выполняют по ГСО стандартного образца фуразидина.
Растворителем для УФ-спектрофотометрического определения может служить 50%-ный раствор серной кислоты, в котором нитрофурал, нитрофурантоин и фуразолидон имеют максимумы поглощения при 227 нм.
Количественное определение нитрофурала, нитрофурантоина и фуразолидона можно проводить фотоколориметрическим методом, основанным на использовании цветных реакций с едкой щелочью в различных растворителях.
Производные 5-нитрофурана хранят по списку Б в прохладном месте в хорошо укупоренной таре, предохраняющей от действия света и влаги.
Нитрофурал назначают наружно для лечения и предупреждения гнойно-воспалительных процессов (в виде 0,02 % водных, 0,066 % спиртовых растворов и 0,2 % мази) и внутрь (по 0,1 г) для лечения бактериальной дизентерии.
Нитрофурантоин назначают внутрь для лечения инфекционных заболеваний мочевых путей (по 0,1-0,15 г). Фуразолидон в тех же дозах менее токсичен и более активен. Назначают при смешанных инфекциях. Фуразидин применяют внутрь по 0,1-0,2 г и местно в виде глазных капель 1:13 000, для промывания ран, ожогов и др. Фуразидин калия применяют при тяжелых инфекционно-воспалительных процессах. Вводят в виде 1 % раствора внутривенно.
Общая характеристика и методы фармацевтического анализа
лекарственных средств – производных бензофурана
Бензофуран лежит в основе химической структуры двух лекарственных веществ, различных по фармакологическому действию, – амиодарона и гризеофульвина (табл. 2).
Таблица 2. Общая характеристика
лекарственных средств – производных бензофурана
|
Лекарственное средство |
Химическая структура |
Описание |
|
Amiodarone Amiodaronum Aмиодарон (Кордарон) |
[2-бутил-3-бензофуранил]-[4-(2-диэтиламиноэтокси)-3,5-дийодфенил]кетона гидрохлорид |
Белый или почти белый кристаллический порошок Температура плавления 159-163 °С. |
|
Graeofulvine Graeofulvinum Гризео- фульвин |
7-хлор-2',4,6-триметокси-6'-метилгризен-2'- дион-3,4' |
Белый или белый с кремоватым оттенком мелкодисперсный кристаллический порошок со слабым специфическим запахом. Температура плавления 218- 224 °С.
|
Амиодарон – синтетическое антиангинальное и антиаритмическое средство.
Гризеофульвин – антибиотик, продуцируемый различными видами плесневых грибов, в частности Penicillium nigricansgriseofulvum. При биосинтезе накапливается в мицелии и ферментативном растворе, откуда извлекается экстракцией хлороформом. Экстракт упаривают, остаток экстрагируют горячим бензолом и перекристаллизовывают из этанола. Он проявляет противогрибковое действие. Помимо бензофуранового ядра, в молекуле амиодарона имеется фенильный радикал с двумя атомами йода и две алифатические цепи (табл. 2).
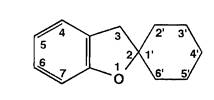
Основой химической структуры гризеофульвина является гетероциклическая система гризан, включающая 2,3-дигидробензофуран и конденсированный с ним (в положении 2) циклогексан:
Амиодарон и гризеофульвин – белые или с желтоватым (кремоватым) оттенком кристаллические вещества. Амиодарон очень мало растворим в воде, умеренно растворим в этаноле, легко растворим в метиленхлориде.
Гризеофульвин практически нерастворим в воде и эфире, мало растворим в этаноле, ацетоне, бутилацетате, легко растворим в диметилформамиде.
Для испытания подлинности амиодарона и гризеофульвина используют ИК-спектроскопию, УФ-спектрофотометрию, а также методы ТСХ и ВЭЖХ. Сравнивают ИК-спектры испытуемых веществ и стандартных образцов, снятых в дисках с бромидом калия. С теми же стандартными образцами сравнивают УФ-спектры поглощения гризеофульвина в области 230-300 нм. Его растворы в этаноле должны иметь максимумы поглощения при 231 и 291 нм.
Хроматограммы испытуемого и стандартного растворов амиодарона, полученные на пластинках силикагеля F254, не должны отличаться по расположению и интенсивности окраски основного пятна (в УФ-свете). Должны также совпадать времена удерживания амиодарона и его ГСО при выполнении анализа методом ВЭЖХ.
Для испытания подлинности используют цветные реакции. Раствор гризеофульвина в концентрированной серной кислоте под действием дихромата калия приобретает темно-красное окрашивание. Если поместить в пробирку амиодарон, прибавить дихромат калия и концентрированную серную кислоту, накрыть пробирку фильтровальной бумагой, смоченной раствором дифенилкарбазида в уксусной кислоте, то бумага окрашивается в фиолетово-красный цвет.
Подлинность гризеофульвина устанавливают по голубовато-сиреневому свечению нанесенного на фильтровальную бумагу его 1 % раствора в ацетоне, возникающему при облучении ртутно-кварцевой лампой.
При нагревании до кипения спиртового раствора гризеофульвина с 0,2 г бисульфита натрия и 2 мл раствора гидроксида натрия появляется лимонно-желтое окрашивание. Тот же раствор после добавления концентрированной хлороводородной кислоты и порошка магния приобретает желтое окрашивание, переходящее в желто-коричневое. Окрашенное соединение извлекается амиловым спиртом.
Амиодарон испытывают на наличие хлорид-иона.
Для испытания на чистоту амиодарона используют различные методы. Наличие примеси йодидов определяют фотоколориметрическим методом по интенсивности поглощения испытуемого и стандартного растворов при длине волны 420 нм после действия раствором йодата калия в кислой среде. Примеси родственных по структуре соединений (не более 0,5 %) и примесь (2-хлорэтил)-диэтиламина (не более 0,2 %) определяют методом тонкослойной хроматографии.
Остаточные растворители ацетон (не более 0,5 %), метиленхлорид (не более 0,01 %) определяют методом ГЖХ с плазменно-ионизационным детектором.
Методом ВЭЖХ на хроматографе с УФ-детектором устанавливают наличие в гризеофульвине специфических примесей с относительными временами удерживания 0,56-0,57; 0,87-0,88 и 1,09-1,10. Подвижная фаза состоит из воды, ацетонитрила и ледяной уксусной кислоты (49:45:1). Детектируют при длине волны 291 нм. Суммарное содержание примесей не должно превышать 2 %.
При испытании на чистоту порошка гризеофульвина требуется микроскопический контроль с помощью окулярмикрометра, т. к. его активность повышается с увеличением степени дисперсности и достигает оптимального значения при размере кристаллов не более 4 мкм. Проводится также испытание на микробиологическую чистоту.
Количественное определение амиодарона (по НТД) выполняют методом нейтрализации. Навеску растворяют в смеси этанола и 0,01 М раствора хлороводородной кислоты. Титруют с использованием потенциометра 0,1 М раствором натрия гидроксида. Объем титранта, пошедшего на титрование, устанавливают на потенциометрической кривой между двумя точками перегиба.
Количественное определение амиодарона и гризеофульвина можно выполнить методом ВЭЖХ.
При определении гризеофульвина используют подвижную фазу вода-ацетонитрил-тетрагидрофуран (60:35:5). Детектируют при длине волны 254 нм, сравнивая со стандартным раствором гризеофульвина в метаноле.
Можно определить содержание гризеофульвина спектрофото-метрическим методом (согласно требований Международной Фармакопеи) при длине волны 291 нм, используя в качестве растворителя этанол. Расчеты выполняют по величине удельного показателя поглощения.
Известен фотоколориметрический метод, основанный на использовании цветной реакции со стабилизированной солью диазония из 4-амино-2',5'-диметоксибензанилида. Описан люминесцентный способ определения гризеофульвина.
Хранят амиодарон и гризеофульвин по списку Б в сухом, защищенном от света месте при температуре не выше 25°С, в хорошо укупоренной таре. Применяют амиодарон внутрь при хронической ишемии сердца с синдромом стенокардии и нарушением сердечного ритма в виде таблеток по 0,2 г или вводят внутривенно 5 % раствор.
Гризеофульвин, являющийся фунгицидным средством, назначают внутрь в таблетках по 0,125 г или наружно в виде 2,5 % линимента (суспензии) для лечения больных дерматомикозами, вызванными патогенными грибами.
РАЗДЕЛ II. ПРАКТИЧЕСКАЯ ЧАСТЬ
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ – ПРОИЗВОДНЫХ 5-НИТРОФУРАНА
Государственный контроль за качеством лекарственных средств включает в себя мероприятия, направленные на соблюдение требований актов законодательства РФ, регламентирующих их обеспечение. Государственному контролю подлежат все лекарства, привозимые и изготавливаемые в РФ и ввозимые на территорию РФ.
Лекарственные средства являются особой продукцией, которая может нанести вред здоровью человека при нарушении правил разработки, испытания, производства, хранения, реализации, применения. Поэтому требуется введение жестко регламентированной системы контроля всех стадий продвижения лекарственных препаратов от их создания до потребления человеком.
Государственный контроль за качеством лекарственных средств в РФ регулируют следующие основные нормативные документы:
- Федеральный закон от 12 апреля 2010 г № 61-ФЗ «Об обращении лекарственных средств»;
- Федеральный закон от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании»;
- Закон РФ от 7 февраля 1992 г. № 2300-1 «О защите прав потребителей»;
- Приказ МЗ РФ от 26 октября 2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность»;
- Приказ МЗ РФ от 31.07.2020 г. № 780н «Об утверждении видов аптечных организаций»;
- Приказ Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. № 706н «Об утверждении Правил хранения лекарственных средств»;
- Приказ Федеральной сфере здравоохранения службы по надзору в сфере здравоохранения от 7 августа 2015 г. № 5539 «Об утверждении Порядка осуществления выборочного контроля качества лекарственных средств для медицинского применения»;
- Приказ Федеральной сфере здравоохранения службы по надзору в сфере здравоохранения от 10 марта 2022 г. № 1746 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств»;
- Постановление Правительства РФ от 30 июня 2004 г. № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения»;
- Постановление Правительства РФ от 7 июля 1999 г. № 766 «Об утверждении перечня продукции, подлежащей декларированию соответствия, порядка принятия декларации о соответствии и ее регистрации»;
- Постановление Правительства РФ от 1 декабря 2009 г. № 982 «Об утверждении единого перечня продукции, подлежащей обязательной сертификации, и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии»;
- Постановление Правительства РФ от 22 декабря 2011 г. № 1081 «О лицензировании фармацевтической деятельности»;
- Постановление Правительства РФ от 06.07.2012 г. № 686 «Об утверждении Положения о лицензировании производства лекарственных средств»;
- Постановление Правительства РФ от 15.09.2020 г. № 1447 «Об утверждении Правил уничтожения изъятых фальсифицированных лекарственных средств, недоброкачественных лекарственных средств и контрафактных лекарственных средств»;
- Постановление Главного государственного санитарного врача РФ от 24.12.2020 г. № 44 «Об утверждении санитарных правил СП 2.1.3678-20 «Санитарно-эпидемиологические требования к эксплуатации помещений, зданий, сооружений, оборудования и транспорта, а также условиям деятельности хозяйствующих субъектов, осуществляющих продажу товаров, выполнение работ или оказание услуг»;
- Письмо Департамента государственного контроля лекарственных средств и медицинской техники МЗ РФ от 5 ноября 2003 г. № 295-22/247 «О контроле субстанций»;
- ОФС, ФС, ФСП;
- Инструкции по изготовлению и контролю качества лекарств в условиях аптеки (МЗ РФ, областные центры контроля качества лекарств).
Внутриаптечный контроль качества – это комплекс мероприятий, направленных на своевременное предупреждение и выявление ошибок, неточностей, возникающих при изготовлении, оформлении и отпуске лекарств.
Система внутриаптечного контроля включает проведение предупредительных мероприятий и различных видов контроля, к которым относятся приёмочный, органолептический, письменный, опросный, физический, химический, контроль при отпуске.
Качество лекарственных средств, изготовляемых в аптеках, устанавливается по комплексу показателей. Уровень качества лекарственных средств определяется в соответствии с требованиями, регламентированными ГФ, действующими приказами и инструкциями.
Для оценки качества лекарственных средств применяется два термина: «Удовлетворяет» (годная продукция) или «Не удовлетворяет» (брак) требованиям ГФ, действующих приказов и инструкций.
Уровень качества, изготовленных лекарственных средств определяется органолептическими и измерительными методами.
Для выполнения качественного и количественного анализа препаратов в условиях аптеки были разработаны приемы экспресс-анализа. Задача экспресс-анализа: провести анализ, используя минимальное количество препарата, реактивов, времени при достаточной точности анализа. Методы экспресс-анализа отвечают следующим требованиям: точность, чувствительность, избирательность, быстрота выполнения, экономичность, возможность выполнения в условиях аптеки (например, применяемые реактивы не токсичны).
Качественный экспресс-анализ проводят на предметном или часовых стеклах, при этом расход анализируемого вещества минимален. Реакции, протекающие с выделением газообразных веществ, проводят с использованием реактивных бумажек. При анализе органических лекарственных средств используют групповые и специфические реакции.
Количественный экспресс-анализ предусматривает определение содержания ингредиентов титриметрическими и физико-химическими методами. Навеску берут с таким расчетом, чтобы на титрование расходовалось 1-5 мл титрованного раствора.
Расчет количественного содержания определяемых компонентов лекарственной формы проводят по формуле:
![]()
где С% – концентрация определяемого вещества, %;
Т – титр по определяемому веществу, г/мл;
V – объем титранта, пошедшего на титрование данного ингредиента, мл;
К – поправочный коэффициент титрованного раствора;
а – навеска анализируемого лекарственного вещества или лекарственной смеси, г.
Титр по определяемому веществу (или титриметрический фактор пересчета) – это масса анализируемого вещества (в г), взаимодействующая с
1 мл титрованного раствора. Титр рассчитывают по формуле:
![]()
где СN – молярная концентрация титранта, моль/л;
Мэкв. – молярная масса эквивалента определяемого вещества, г/моль.
При обратном титровании (или титровании по избытку) используют
два титрованных раствора. Тогда концентрацию ингредиентов в % (в жидких лекарственных формах, мазях, порошках) рассчитывают по формуле:
![]()
где V1 – объем первого титранта, взятого в избытке, мл;
К1 – коэффициент поправки на первый титрованный раствор;
V2 – объем второго титранта, затраченного на титрование избытка первого титрованного раствора, мл;
К2 – коэффициент поправки на второй титрованный раствор.
В экспресс-анализе иногда проводят контрольный (холостой) опыт при прямом и обратном способах титрования. Концентрацию определяемого вещества вычисляют с учетом контрольного опыта по формуле:
![]()
где Vоо – объем титрованного раствора, израсходованный на титрование определяемого вещества, мл;
Vко – объем титрованного раствора, израсходованный на титрование контрольного опыта, мл.
Практическое задание:
1. Установить подлинность лекарственных средств – производных 5-нитрофурана.
Объекты анализа: субстанции фурацилина, фурадонина, фуразолидона.
2. Осуществить фармакопейный анализ субстанции фурацилина согласно требований ГФ XIV.
3. Осуществить контроль качества лекарственных средств – производных 5-нитрофурана внутриаптечного изготовления.
Объекты анализа:
Пропись 1.
Раствор фурацилина 0,02 % - 100 мл (для обработки ран).
Пропись 2.
Фурацилина 0,02 г
Раствора натрия хлорида 0,9% - 100 мл (для полоскания горла).
4. Осуществить контроль качества лекарственных средств – производных 5-нитрофурана промышленного производства.
Объект анализа: таблетки фурацилина 0,02 г для наружного применения.
ПРАКТИЧЕСКОЕ ЗАДАНИЕ 1
Установление подлинности лекарственных средств –
производных 5-нитрофурана
Задание: установить подлинность лекарственных средств – производных 5-нитрофурана.
Объекты анализа: субстанции фурацилина, фурадонина, фуразолидона.
Общие реакции определения подлинности:
1. Около 0,005 г вещества растворяют в смеси 0,5 мл воды и 0,5 мл 10% раствора натрия гидроксида, в случае фуразолидона жидкость нагревают:
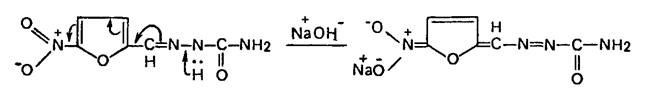
Наблюдают изменение окраски раствора:
фурацилин – оранжево-красное;
фурадонин – темно-красное;
фуразолидон – красно-бурое.
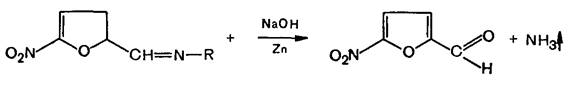
2. Около 0,01 г вещества растворяют в смеси 5 мл воды и 5 мл 10 % раствора натрия гидроксида, в случае фуразолидона жидкость нагревают. Обрабатывают растворы цинковой пылью при нагревании. Выделяется аммиак, который открывают по посинению красной лакмусовой бумаги:
3. 0,005–0,01 г вещества растворяют в 3 мл диметилформамида. К полученному раствору прибавляют 1-2 капли 1 М водно-спиртового раствора калия гидроксида.
Наблюдают изменение окраски:
фурадонин – желтое, переходящее в коричневато-желтое и светло-коричневое окрашивание;
фуразолидон – красно-фиолетовое окрашивание, переходящее в темно-синее, затем в фиолетовое.
4. 0,05 г препарата растворяют в 8 мл 0,1 % раствора натрия гидроксида (следят за тем, чтобы не было избытка щелочи), разливают в 3 пробирки: в первую добавляют 2-3 капли раствора меди сульфата (II). Отмечают окраску осадков:
фурацилин – осадок темно-красного цвета;
фурадонин – осадок болотного цвета;
фуразолидон – осадок зеленого цвета.
Делают заключение: субстанции удовлетворяют (не удовлетворяют) требованиям НТД по показателю «Определение подлинности».
ПРАКТИЧЕСКОЕ ЗАДАНИЕ 2
Фармакопейный анализ субстанции фурацилина
Задание: осуществить фармакопейный анализ субстанции фурацилина согласно требований ГФ XIV, исходя из имеющихся в лаборатории контроля качества реактивов и оборудования.
Фармакопейный анализ осуществляют согласно требований ФС.2.1.0148.18 Нитрофурал, введенной взамен ФС 42-2522-88, взамен ГФ X, ст. 295 (Приложение 1).
Furacilinum
Фурацилин
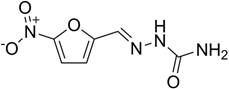
Описание: желтый или зеленовато-желтый мелкокристаллический порошок без запаха, горького вкуса. Очень мало растворим в воде, мало растворим в 95 % спирте, практически нерастворим в эфире, растворим в щелочах.
Заключение: субстанция удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Описание».
Определение подлинности: растворяют 0,01 г вещества в смеси 5 мл воды и 5 мл раствора гидроксида натрия. Появляется оранжево-красное окрашивание.
Полученный раствор нагревают до кипения и в пары вносят влажную красную лакмусовую бумагу. Обнаруживают выделяющийся при разложении вещества аммиак по посинению красной лакмусовой бумаги.
Заключение: субстанция удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Определение подлинности».
Чистота. Определение семикарбазида: 2 г вещества взбалтывают с 40 мл воды и фильтруют до получения прозрачного фильтрата. 10 мл фильтрата подогревают и вливают 2 мл реактива Фелинга, предварительно нагретого до кипения. Окраска раствора постепенно из желтой переходит в темно-зеленую; в течение часа не должен выпадать красный осадок закиси меди.
Заключение: субстанция удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Чистота».
Количественное определение: йодометрическое определение.
Около 0,1 г вещества (точная навеска) помещают в мерную колбу вместимостью 500 мл, прибавляют 4 г хлорида натрия, 300 мл воды и растворяют при подогревании до 70-80 ºС на водяной бане. Охлажденный раствор доводят водой до метки и перемешивают.
К 5 мл 0,01 н. раствора йода, помещенного в колбу вместимостью 50 мл, прибавляют 0,1 мл раствора гидроксида натрия и 5 мл испытуемого раствора. Через 1-2 минуты к раствору прибавляют 2 мл кислоты серной разведенной и выделившийся йод титруют из микробюретки 0,01 н. раствором тиосульфата натрия (индикатор – крахмал).
Параллельно проводят контрольный опыт.
1 мл 0,01 н. раствора йода соответствует 0,0004954 г фурацилина, которого должно быть не менее 97,5%.
Содержание фурацилина (С%) вычисляют по формуле:
![]()
где a – навеска фурацилина, г;
T – титр по определяемому веществу, г/мл;
K – поправочный коэффициент 0,01 н. раствора Na2S2O3;
Б – объем мерной колбы (объем разведения);
А – объем аликвоты (5 мл).
Пример расчета: допустим, что при количественном определении фурацилина (а = 0,1016 г в 500 мл воды) на анализ 5 мл полученного раствора затрачено 3,2 мл 0,01 н. раствора тиосульфата натрия.
На контрольный опыт затрачено 5,25 мл 0,01 н. раствора тиосульфата натрия.
Рассчитаем содержание действующего вещества (расчет представлен в табл. 3).
Таблица 3
Расчет содержания фурацилина в субстанции
|
Определяемое вещество |
Титрант |
Расчеты |
|
Фурацилин а = 0,1016 г 1:500 А = 5 мл
|
Na2S2O3 0,01 н. Vх1 = 3,2 мл Vх2 = 3,2 мл Vх ср = 3,2 мл Vк1 = 5,2 мл Vх2 = 5,3 мл Vк ср = 5,25 мл |
|
Заключение: субстанция удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Количественное определение».
Аналитический паспорт фармакопейного анализа субстанции оформить в соответствии с Приложением 2.
ПРАКТИЧЕСКОЕ ЗАДАНИЕ 3
Контроль качества лекарственных средств –
производных 5-нитрофурана внутриаптечного изготовления
Задание: осуществить контроль качества лекарственных средств – производных 5-нитрофурана внутриаптечного изготовления.
Объекты анализа:
Пропись 1.
Раствор фурацилина 0,02 % – 100 мл (для обработки ран).
Пропись 2.
Фурацилина 0,02 г
Раствора натрия хлорида 0,9 % – 100 мл (для полоскания горла).
Алгоритм внутриаптечного контроля качества индивидуальной лекарственной формы представлен в виде схемы (Приложение 3).
Пропись 1.
Раствор фурацилина 0,02 % – 100 мл (для обработки ран).
Описание: желтый или зеленовато-желтый раствор без запаха, горького вкуса. Смешивается с водой и 95 % спиртом, щелочами, практически не смешивается с эфиром.
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Описание».
Определение подлинности: к 0,5 мл раствора прибавляют 2-3 капли раствора натрия гидроксида. Появляется оранжево-красное окрашивание.
Полученный раствор нагревают до кипения и в пары вносят влажную красную лакмусовую бумагу. Обнаруживают выделяющийся при разложении вещества аммиак по посинению красной лакмусовой бумаги.
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Подлинность».
Количественное определение: помещают 2 мл 0,01 н. раствора йода в колбу с притертой пробкой, прибавляют 2 капли раствора натрия гидроксида (до обесцвечивания йода), 2 мл анализируемого раствора, перемешивают, закрывают колбу пробкой и оставляют на 2-6 мин. в темном месте.
Затем к раствору прибавляют 2 мл разведенной серной кислоты и выделившийся йод титруют 0,01 н. раствором натрия тиосульфата (индикатор – крахмал).
Параллельно проводят контрольный опыт.
1 мл 0,01 н. раствора йода соответствует 0,0004954 г фурацилина.
Пример расчета: допустим, что при количественном определении фурацилина на анализ 2 мл раствора затрачено 1,2 мл 0,01 н. раствора тиосульфата натрия.
На контрольный опыт затрачено 2,05 мл 0,01 н. раствора тиосульфата натрия.
Рассчитаем содержание действующего вещества (расчет представлен в табл. 4).
Таблица 4
Расчет содержания фурацилина в прописи 1
|
Определяемое вещество |
Титрант |
Расчеты |
|
Фурацилин а = 2 мл
|
Na2S2O3 0,01 н. Vх1 = 1,2 мл Vх2 = 1,2 мл Vх ср = 1,2 мл Vк1 = 2,1 мл Vх2 = 2,0 мл Vк ср = 2,05 мл |
|
0,02 – 100 %
х – 20 %
х = 0,004
[0,016 – 0,024]
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Количественное определение».
Вывод: лекарственная форма приготовлена удовлетворительно (неудовлетворительно).
Пропись 2.
Фурацилина 0,02 г
Раствора натрия хлорида 0,9% - 100 мл (для полоскания горла).
Описание: желтый или зеленовато-желтый раствор без запаха, горько-соленого вкуса. Смешивается с водой и 95 % спиртом, щелочами, практически не смешивается с эфиром.
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Описание».
Определение подлинности:
1. Фурацилин (см. пропись 1).
2. Натрия хлорид:
Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается в желтый цвет.
К 3-5 каплям раствора прибавляют по 2-3 капли разведенной азотной кислоты и раствора серебра нитрата. Образуется белый творожистый осадок, растворимый в растворе аммиака.
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Подлинность».
Количественное определение:
1. Фурацилин (см. Пропись 1).
2. Натрия хлорид: титруют 1 мл раствора 0,1 н. раствором серебра нитрата до оранжево-желтого окрашивания (индикатор – калия хромат).
1 мл 0,1 н. раствора серебра нитрата соответствует 0,005844 г натрия хлорида.
Пример расчета: допустим, что при количественном определении фурацилина на анализ 2 мл раствора затрачено 1,15 мл 0,01 н. раствора тиосульфата натрия. На контрольный опыт затрачено 2,1 мл 0,01 н. раствора тиосульфата натрия.
Рассчитаем содержание действующего вещества – фурацилина (расчет представлен в табл. 5).
Таблица 5
Расчет содержания фурацилина в прописи 2
|
Определяемое вещество |
Титрант |
Расчеты |
|
Фурацилин а = 2 мл
|
Na2S2O3 0,01 н. Vх1 = 1,2 мл Vх2 = 1,1 мл Vх ср = 1,15 мл Vк1 = 2,1 мл Vх2 = 2,1 мл Vк ср = 2,1 мл |
|
Согласно Приказа Министерства здравоохранения РФ от 26 октября 2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность», допустимые отклонения в массе навески отдельных лекарственных веществ в жидких лекарственных формах при изготовлении массо-объемным способом по фурацилину составляют ± 20 %.
0,02 – 100 %
х – 20 %
х = 0,004
[0,016 – 0,024]
Допустим, что при количественном определении натрия хлорида на анализ 1 мл раствора затрачено 1,55 мл 0,01 н. раствора серебра нитрата. Рассчитаем содержание натрия хлорида (расчет представлен в табл. 6).
Таблица 6
Расчет содержания натрия хлорида в прописи 2
|
Определяемое вещество |
Титрант |
Расчеты |
|
Натрия хлорид а = 1 мл
|
AgNO3 0,01 н. V1 = 1,5 мл V2 = 1,6 мл Vср = 1,55 мл |
|
Согласно Приказа Министерства здравоохранения РФ от 26 октября 2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность», допустимые отклонения в массе навески отдельных лекарственных веществ в жидких лекарственных формах при изготовлении массо-объемным способом по натрия хлориду составляют ± 6 %.
0,9 – 100 %
х – 6 %
х = 0,054
[0,846 – 0,954]
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Количественное определение».
Вывод: лекарственная форма приготовлена удовлетворительно (неудовлетворительно).
Протокол результатов анализа индивидуальной лекарственной формы должен содержать следующую информацию:
1. Рецепт.
2. Виды внутриаптечного контроля качества лекарственной формы: обязательные и выборочные.
3. Результаты органолептического контроля.
Необходимо:
3.1. Сделать описание лекарственной формы, ее физических свойств.
3.2. Сделать заключение об удовлетворительности (неудовлетворительности) лекарственной формы требованиям НТД.
4. Результаты определения подлинности.
Необходимо:
4.1. Указать названия компонентов на русском и латинском языках, структурные формулы лекарственных средств, входящих в состав лекарственной формы.
4.2. Описать методики и уравнения химических реакций.
4.3. Указать внешний эффект реакций.
4.4. Сделать заключение об удовлетворительности (неудовлетворительности) лекарственной формы требованиям НТД.
5. Результаты количественного определения.
Необходимо:
5.1. Описать метод и способ анализа, дать обоснование и описание методики.
5.2. Произвести расчет теоретического объема титрованного раствора, который пойдет на титрование каждого компонента лекарственной формы (Vтеор), Сделать заключение об удовлетворительности (неудовлетворительности) требованиям экспресс-анализа. В случае разведения в расчетах указать объем разведения и объем аликвоты, взятой из разведения на анализ.
5.3. Произвести расчет количественного содержания определяемых компонентов лекарственной формы.
5.4. Произвести расчет допустимых отклонений.
5.5. Сделать заключение об удовлетворительности (неудовлетворительности) лекарственной формы требованиям НТД.
6. Сделать заключение о доброкачественности лекарственной формы и соответствии ее требованиям НТД. Оформить протокол анализа (Приложение 4). Зарегистрировать результаты контроля качества в журнале.
ПРАКТИЧЕСКОЕ ЗАДАНИЕ 4
Контроль качества лекарственных средств –
производных 5-нитрофурана промышленного производства
Задание: осуществить контроль качества лекарственных средств – производных 5-нитрофурана промышленного производства.
Объект анализа: таблетки фурацилина 0,02 г для наружного применения (производитель ОАО «Дальхимфарм»).
Система государственного контроля качества лекарственных средств промышленного производства включает в себя:
- оценку эффективности, безопасности и утверждение стандартов качества на лекарственные средства при регистрации;
- оценку качества впервые производимых и впервые ввозимых лекарственных средств при допуске в обращение;
- экспертизу качества лекарственных средств, находящихся в обращении (выборочно);
- мониторинг качества, эффективности и безопасности лекарственных средств, находящихся в обращении;
- инспекционный контроль.
Контроль качества лекарственных средств промышленного производства осуществляют территориальные Управления Росздравнадзора, испытательные лаборатории, единая информационная система, системы качества в организациях-производителях лекарственных средств, розничных и оптовых фармацевтических организациях.
Отдел контроля качества (ОКК) фармацевтического предприятия осуществляет различные типы фармацевтического контроля: входной контроль фармацевтических субстанций и вспомогательных веществ, межоперационный контроль в процессе производства и контроль качества готовой лекарственной продукции.
Согласно Приказа МЗ РФ от 26 октября 2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность», все поступающие лекарственные средства (независимо от источника их поступления) подвергаются приемочному контролю.
Приемочный контроль заключается в проверке поступающих лекарственных средств на соответствие требованиям по показателям: «Описание», «Упаковка», «Маркировка», а также в проверке правильности оформления сопроводительных документов, включая документы, подтверждающие качество лекарственных средств.
В контроль по показателю «Описание» включается проверка внешнего вида, агрегатного состояния, цвета, запаха лекарственного средства. В случае возникновения сомнений в качестве лекарственных средств образцы направляются в аккредитованную испытательную лабораторию (центр) для проведения дополнительных испытаний. Такие лекарственные средства с обозначением «Забраковано при приемочном контроле» хранятся в карантинной зоне помещения хранения изолированно от других лекарственных средств.
При проверке по показателю «Упаковка» особое внимание обращается на ее целостность и соответствие физико-химическим свойствам лекарственных средств.
При контроле по показателю «Маркировка» проверяется соответствие маркировки первичной, вторичной упаковки лекарственного средства требованиям документа в области контроля качества, наличие листовки-вкладыша на русском языке в упаковке (или отдельно в пачке на все количество готовых лекарственных препаратов).
Таблетки фурацилина 0,02 г для наружного применения
Производитель ОАО «Дальхимфарм»
Состав на одну таблетку:
Фурацилина 0,02 г
Натрия хлорида 0,8 г
Описание: таблетки желтого или зеленовато-желтого цвета без запаха, горько-соленого вкуса. Мало растворяются в воде и 95 % спирте, растворе щелочи, практически не растворим в эфире.
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Описание».
Определение подлинности:
1. Фурацилин (см. пропись 1)
2. Натрия хлорид (см. пропись 2)
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Подлинность».
Количественное определение: для определения содержания лекарственных веществ в таблетках берут навеску растертых таблеток (не менее 20 штук). Отклонения в содержании лекарственных веществ должны составлять при дозировке лекарственных веществ:
- до 0,001 г ± 15 %;
- от 0,001 г до 0,01 г ± 10 %;
- от 0,01 г до 0,1 г ± 7,5 %;
- от 0,1 г и более ± 5 % (если нет других указаний в частных статьях ГФ).
1. Фурацилин.
Около 0,8 г (точная навеска) порошка растертых таблеток помещают в мерную колбу емкостью 100 мл, прибавляют 70 мл воды, растворяют при 70-80 0С на водяной бане до получения прозрачного раствора. Охлажденный раствор доводят водой до метки, хорошо перемешивают. Помещают 5 мл 0,01 н. раствора йода в колбу с притертой пробкой, прибавляют 2 капли раствора натрия гидроксида (до обесцвечивания йода), 5 мл анализируемого раствора, перемешивают, закрывают колбу пробкой и оставляют на 2-6 минут в темном месте. Затем к раствору прибавляют 2 мл разведенной серной кислоты и выделившийся йод титруют 0,01 н. раствором натрия тиосульфата (индикатор – крахмал).
Параллельно проводят контрольный опыт.
Пример расчета: допустим, что при проведении фармацевтического анализа 0,8252 г порошка растертых таблеток растворили в воде в мерной колбе вместимостью 100 мл, взяли 5 мл полученного раствора и 5,00 мл раствора йода 0,01 н. c К 1,00. При титровании израсходовалось 3,05 мл раствора натрия тиосульфата 0,01 н. с К 1,0000; на контрольный опыт – 4,95 мл. Средняя масса таблеток составляет 0,813 г.
Согласно ФС содержание фурацилина в одной таблетке должно быть от 0,018 до 0,022 г.
Рассчитаем содержание действующего вещества (расчет представлен в табл. 7).
Таблица 7
Расчет содержания фурацилина в таблетках
|
Определяемое вещество |
Титрант |
Расчеты |
|
Фурацилин а = 0,8252 г
|
Na2S2O3 0,01 н. Vх1 = 3,1 мл Vх2 = 3,0 мл Vх ср = 3,05 мл Vк1 = 4,9 мл Vх2 = 5,0 мл Vк ср = 4,95 мл |
|
2. Натрия хлорид.
Одну таблетку (точная навеска) растворяют в воде в мерной колбе емкостью 100 мл, доводят объем раствора водой до метки. 1 мл полученного раствора титруют при сильном взбалтывании 0,01 н. раствором серебра нитрата до оранжево-желтого окрашивания (индикатор – хромат калия).
Пример расчета: при количественном определении натрия хлорида на анализ 0,821 г лекарственной формы затрачено 1,45 мл 0,01 н. раствора серебра нитрата.
Согласно ФС содержание натрия хлорида в одной таблетке должно быть от 0,76 до 0,84 г.
Рассчитаем содержание действующего вещества (расчет представлен в табл. 8).
Таблица 8
Расчет содержания натрия хлорида в таблетках
|
Определяемое вещество |
Титрант |
Расчеты |
|
Натрия хлорид а = 0,821 г
|
AgNO3 0,01 н. V1 = 1,4 мл V2 = 1,5 мл Vср = 1,45 мл |
|
Заключение: лекарственная форма удовлетворяет (не удовлетворяет) требованиям НТД по показателю «Количественное определение».
Вывод: лекарственная форма приготовлена удовлетворительно (неудовлетворительно).
Протокол результатов анализа лекарственного средства промышленного производства должен содержать следующую информацию:
1. Состав лекарственного средства.
2. Результаты проверки по показателям «Упаковка», «Маркировка».
3. Результаты органолептического контроля.
Необходимо:
3.1 Сделать описание лекарственной формы, ее физических свойств.
3.2 Сделать заключение об удовлетворительности (неудовлетворительности) лекарственной формы требованиям НТД.
4. Результаты определения подлинности.
Необходимо:
4.1 Указать названия активных компонентов на русском и латинском языках, структурные формулы лекарственных средств, входящих в состав лекарственной формы.
4.2 Описать методики и уравнения химических реакций.
4.3 Указать внешний эффект реакций.
4.4 Сделать заключение об удовлетворительности (неудовлетворительности) лекарственной формы требованиям НТД.
5. Результаты количественного определения.
Необходимо:
5.1 Описать метод и способ анализа, дать обоснование и описание методики.
5.2 Произвести расчет теоретического объема титрованного раствора, который пойдет на титрование каждого компонента лекарственной формы (Vтеор), Сделать заключение об удовлетворительности (неудовлетворительности) требованиям экспресс-анализа. В случае разведения в расчетах указать объем разведения и объем аликвоты, взятой из разведения на анализ.
5.3 Произвести расчет количественного содержания определяемых компонентов лекарственной формы.
5.4 Произвести расчет допустимых отклонений.
5.5 Сделать заключение об удовлетворительности (неудовлетворительности) лекарственной формы требованиям НТД.
6. Сделать заключение о доброкачественности лекарственной формы и соответствии ее требованиям НТД. Оформить протокол анализа (Приложение 5). Зарегистрировать результаты контроля качества в журнале.
ЗАДАНИЯ ДЛЯ САМОПОДГОТОВКИ И САМОКОНТРОЛЯ
1. Какова общая химическая структура производных 5-нитрофурана?
2. Напишите латинские названия и химические формулы лекарственных средств – производных 5-нитрофурана.
3. Какова общая схема получения лекарственных средств –производных 5-нитрофурана? Что является общим в их химической структуре и физических свойствах?
4. Напишите структурные формулы фурацилина, фурадонина, фуразолидона и укажите общие функциональные группы в их структуре.
5. С какими аминопроизводными конденсируют 5-нитрофурфурол при синтезе фурацилина, фурадонина, фуразолидона? Напишите уравнения реакций.
6. Какими качественными реакциями устанавливают подлинность фурацилина, фурадонина, фуразолидона, фурагина?
7. Какими качественными реакциями можно отличить фурацилин, фурадонин, фуразолидон, фурагин друг от друга?
8. В трех штангласах находятся субстанции лекарственных стредств: фурацилина, фуразолидона, фурагина. Можно ли по физическим свойствам отличить их друг от друга? Ответ обосновать.
9. На каких химических реакциях основан йодометрический метод количественного определения фурацилина?
10. С какой целью при количественном определении фурацилина йодометрическим способом параллельно проводят контрольный опыт?
11. Какой метод количественного определения применяют при определении фурагина и фуразолидона?
12. Решите задачи:
12.1. При количественном определении фурацилина (а = 0,1016 г в 500 мл воды) на анализ 5 мл полученного раствора затрачено 3,0 мл 0,01 М раствора тиосульфата натрия (на контрольный опыт затрачено 5,2 мл 0,01 М раствора тиосульфата натрия). Каково содержание (в %) фурацилина?
12.2. При количественном определение фурацилина получен результат, равный 98,1% . Какой объем титранта (0,1 н. раствора йода) израсходован на титрование 5 мл раствора, полученного путем растворения вещества массой 0,0981 г в 500 мл воды?
12.3. Препараты производные 5-нитрофурана продолжительное время хранили в склянках белого стекла и в месте, не защищенном от света. Какие изменения в препаратах произойдут? Ответ обосновать.
12.4. Рассчитайте объем раствора йода (0,1 н.) с К=1,0000, который свяжется, если 0,1000 г фурацилина растворили в воде в мерной колбе вместимостью 500 мл и на анализ взяли 5 мл полученного раствора.
12.5. Какой объем раствора натрия тиосульфата (0,1 н.) с К=1,0000 должен израсходоваться при количественном определение фурацилина (навеска 0,1000 г), если в реакцию взято 5,00 мл раствора йода (0,1 М) c К= 1,0000?
12.6. Сделайте заключение о качестве таблеток фурацилина 0,02 г для наружного применения по содержанию действующего вещества, если при проведении анализа 0,8252 г порошка растертых таблеток растворяют в воде в мерной колбе вместимостью 100 мл, берут 5 мл полученного раствора и 5,00 мл раствора йода (0,05 н.) c К 1,0000. При титровании израсходовалось 3,10 мл раствора натрия тиосульфата (0,01 н.) с К 1,0000; на контрольный опыт – 4,95 мл. Средняя масса таблеток составляет 0,831 г. Согласно ФС содержание фурацилина в одной таблетке должно быть от 0,018 до 0,022 г.
СПИСОК ЛИТЕРАТУРЫ
1. Фармацевтическая химия: учебное пособие/ под ред. А.П. Арзамасцева. – М.: ГЭОТАР-Мед, 2006. – 640 с.
2. Беликов В.Г. Фармацевтическая химия: учебник по фарм. химии для студ. фарм. вузов и фак.: в 2 ч./ В.Г. Беликов. – Пятигорск: ПГФА, 2003. – 713 c.
3. Сливкин А.И. Функциональный анализ органических лекарственных веществ/ А. И. Сливкин, В. П. Садчикова. – Воронеж: ВГУ, 2007. – 426 с.
4. Крыльский Д.В. Лекарственные вещества с гетероциклической структурой: учеб. пособие по фармацевтической химии/ Д.В. Крыльский, А. И. Сливкин. – Воронеж: ВГУ, 2007. – 234 с.
5. Сливкин А.И. Физико-химические и биологические методы оценки качества лекарственных средств/ А.И. Сливкин, В.Ф. Селеменев, Е.А. Суховерхова. – Воронеж: ВГУ, 1999. – 368 с.
6. Анализ лекарственных смесей: учебное пособие для студ. фарм. ин-тов и фарм. фак-тов мед. вузов/ А.П. Арзамасцев и др. – М.: Компания Спутник, 2000. – 275 c.
7. Руководство к лабораторным занятиям по фармацевтической химии: учебное пособие для студ. фарм. вузов и фак-тов/ Э.Н. Аксенова и др. – М.: Медицина, 2001. – 379 с.
8. Лабораторные работы по фармацевтической химии: учебное пособие/ В.Г. Беликов и др. – Пятигорск, 2003. – 341 с.
11. Сливкин А.И. Контроль качества экстемпоральных лекарственных форм: учеб. пособие/ А.И. Сливкин, Н.П. Садчикова. – Воронеж: ВГУ, 2003. – 260 с.
Приложение 1
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Нитрофурал ФС.2.1.0148.18
Нитрофурал Взамен ФС 42-2522-88;
Nitrofuralum взамен ГФ X, ст. 295
АТЬЯ
2-[(5-Нитрофуран-2-ил)метилиден]гидразинкарбоксамид
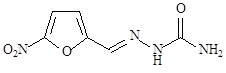
|
C6H6N4O4 |
М.м. 198,14 |
Cодержит не менее 97,0 % и не более 103,0 % нитрофурала C6H6N4O4 в пересчете на сухое вещество.
Описание. Жёлтый или жёлтый с зеленоватым или коричневатым оттенком мелкокристаллический порошок.
Растворимость. Мало растворим в 96 % спирте, очень мало растворим в воде.
Подлинность. 1. ИК-спектр. Инфракрасный спектр субстанции, снятый в диске с калия бромидом, в области от 4000 до 400 см-1 по положению полос поглощения должен соответствовать спектру стандартного образца нитрофурала.
2. УФ-спектр. Ультрафиолетовый спектр поглощения раствора субстанции, приготовленного для количественного определения, в области длин волн от 245 до 450 нм должен соответствовать спектру аналогичного раствора стандартного образца и иметь максимумы при 260 нм и 375 нм, а также минимум при 306 нм. Отношение оптических плотностей А375/А260 должно составлять от 1,15 до 1,30.
3. Качественная реакция. 10 мг субстанции растворяют в смеси 5 мл воды и 5 мл 10 % раствора натрия гидроксида; должно появиться оранжево-красное окрашивание. При нагревании полученного раствора выделяется аммиак, обнаруживаемый по запаху или по посинению влажной красной лакмусовой бумаги, внесенной в пары кипящей жидкости.
pH. От 5,0 до 7,5 (ОФС «Ионометрия», метод 3). 0,5 г субстанции встряхивают с 50 мл воды, свободной от диоксида углерода, и фильтруют, отбрасывая первые 10 мл фильтрата.
Родственные примеси. Определение проводят методом ВЭЖХ.
Подвижная фаза (ПФ). Ацетонитрил – вода 40:60.
Испытуемый раствор. Около 0,1 г (точная навеска) субстанции помещают в мерную колбу вместимостью 100 мл, растворяют в ПФ и доводят объем раствора ПФ до метки.
Раствор сравнения А. 10 мг стандартного образца примеси В помещают в мерную колбу вместимостью 20 мл, растворяют в ПФ и доводят ПФ до метки. 1 мл полученного раствора помещают в мерную колбу вместимостью 100 мл и доводят объём ПФ до метки.
Раствор сравнения Б. 10 мг испытуемой субстанции и 10 мг нитрофурантоина помещают в мерную колбу вместимостью 100 мл, растворяют в ПФ и доводят объём раствора ПФ до метки. 5,0 мл полученного раствора помещают в мерную колбу вместимостью 100 мл и доводят объём ПФ до метки.
Раствор сравнения В. Содержимое флакона со стандартным образцом нитрофурала для идентификации пиков, содержащего примеси А и В, растворяют с помощью ультразвука в 1,0 мл ПФ.
Примечание.
Примесь А: 1,2-Бис[(5-нитрофуран-2-ил)метилиден]гидразин; CAS 112537-96-9;
примесь В: [(5-Нитрофуран-2-ил)метилен]диацетат; CAS 92-55-7.
Хроматографические условия
|
Колонка |
25 × 0,46 см, силикагель октадецилсилильный для хроматографии (С18), 15 мкм; |
|
Температура колонки |
25 °С; |
|
Скорость потока |
1,0 мл/мин; |
|
Детектор |
спектрофотометрический, 310 нм; |
|
Объем пробы |
20 мкл; |
|
Время хроматографирования |
10-кратное от времени удерживания основного пика. |
Хроматографируют испытуемый раствор и растворы сравнения А, Б и В.
Пригодность хроматографической системы определяют в соответствии с ОФС «Хроматография» со следующим уточнением: на хроматограмме раствора сравнения Б разрешение (R) между пиками нитрофурала и нитрофурантоина должно быть не менее 2,0.
Идентификация примесей. Для идентификации пиков примесей А и В используется хроматограмма раствора сравнения В.
Относительные времена удерживания соединений. Нитрофурал – 1 (около 4 мин); нитрофурантоин – около 1,2; примесь А – около 7,6; примесь В – около 4,0.
Допустимое содержание примесей. На хроматограмме испытуемого раствора:
- площадь пика примеси А должна быть не более площади основного пика на хроматограмме раствора сравнения А (не более 0,5 %);
- площадь пика примеси В должна быть не более площади основного пика на хроматограмме раствора сравнения А (не более 0,5 %);
- площадь пика любой другой единичной примеси должна быть не более 0,2 площади основного пика на хроматограмме раствора сравнения А (не более 0,1 %);
- суммарная площадь пиков всех примесей должна быть не более двукратной площади основного пика на хроматограмме раствора сравнения А (не более 1,0 %).
Не учитывают пики, площадь которых менее 0,1 площади основного пика на хроматограмме раствора сравнения А (менее 0,05 %).
Потеря в массе при высушивании. Не более 0,5% (ОФС «Потеря в массе при высушивании», способ 1). Для определения используют около 1,0 г (точная навеска) субстанции.
Хлориды. Не более 0,004 % (ОФС «Хлориды»). 2 г субстанции взбалтывают с 40 мл воды и фильтруют до получения прозрачного фильтрата. Для определения используют 10 мл фильтрата.
Сульфаты. Не более 0,02 % (ОФС «Сульфаты», метод 1). Для определения используют 10 мл фильтрата, полученного в испытании «Хлориды».
Сульфатная зола. Не более 0,1 % (ОФС «Сульфатная зола»). Для определения используют около 1,0 г (точная навеска) субстанции и 2 мл концентрированной серной кислоты.
Тяжелые металлы. Не более 0,001 %. Определение проводят в соответствии с ОФС «Тяжелые металлы», метод 2, в зольном остатке, полученном после сжигания 1,0 субстанции, с использованием эталонного раствора 1.
Остаточные органические растворители. В соответствии с ОФС «Остаточные органические растворители».
Микробиологическая чистота. В соответствии с ОФС «Микробиологическая чистота»
Количественное определение. Определение проводят методом УФ-спектрофотометрии.
Испытуемый раствор и раствор сравнения защищают от света.
Испытуемый раствор. Около 75 мг (точная навеска) субстанции помещают в мерную колбу вместимостью 250 мл, растворяют в 30 мл диметилформамида и доводят объём раствора водой до метки. 5 мл полученного раствора помещают в мерную колбу вместимостью 250 мл и доводят объём раствора водой до метки.
Стандартный раствор. Около 75 мг (точная навеска) стандартного образца нитрофурала помещают в мерную колбу вместимостью 250 мл, растворяют в 30 мл диметилформамида и доводят объём раствора водой до метки. 5 мл полученного раствора помещают в мерную колбу вместимостью 250 мл и доводят объём раствора водой до метки.
Измеряют оптическую плотность испытуемого раствора и стандартного растворов на спектрофотометре в максимуме поглощения при 375 нм в кювете с толщиной слоя 10 мм.
Содержание нитрофурала C6H6N4O4
в субстанции в процентах (![]() ) в пересчете на сухое вещество вычисляют по формуле:
) в пересчете на сухое вещество вычисляют по формуле:
![]()
|
где |
A1 |
– |
оптическая плотность испытуемого раствора; |
|
|
A0 |
– |
оптическая плотность стандартного раствора; |
|
|
а1 |
– |
навеска субстанции, мг; |
|
|
а0 |
– |
навеска стандартного образца нитрофурала, мг; |
|
|
W |
– |
потеря в массе при высушивании субстанции, %; |
|
|
P |
– |
содержание основного вещества в стандартном образце нитрофурала, %. |
Хранение. В плотно закрытой упаковке в защищенном от света месте.
Приложение 2
АНАЛИТИЧЕСКИЙ ПАСПОРТ
ФАРМАКОПЕЙНОГО АНАЛИЗА СУБСТАНЦИИ
№ ______ от ______________________
|
Наименование: |
|
||
|
Серия: |
|
||
|
Испытания проведены по НД: |
|
||
|
МНН |
|
|
|
Химическое название |
|
|
|
Химическая формула |
|
|
|
М.м. |
|
|
|
Описание: |
||
|
Требование:
|
Результат испытания: |
|
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|
|
Определение подлинности: |
||
|
Реакция 1. |
||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|
|
Реакция 2. |
||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|
|
Реакция 3. |
||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|
|
Количественное определение: |
||
|
Методика, уравнения химических реакций:
|
Расчеты, результат испытания: |
|
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|
|
Условия и сроки хранения: |
||
|
|
||
|
Заключение: субстанция удовлетворяет/ не удовлетворяет требованиям НД. |
||
|
Анализ провел: _____________________________________ |
Дата: __________________ |
|
|
Начальник ОКК (преподаватель):________________________________ |
Подпись:____________________ |
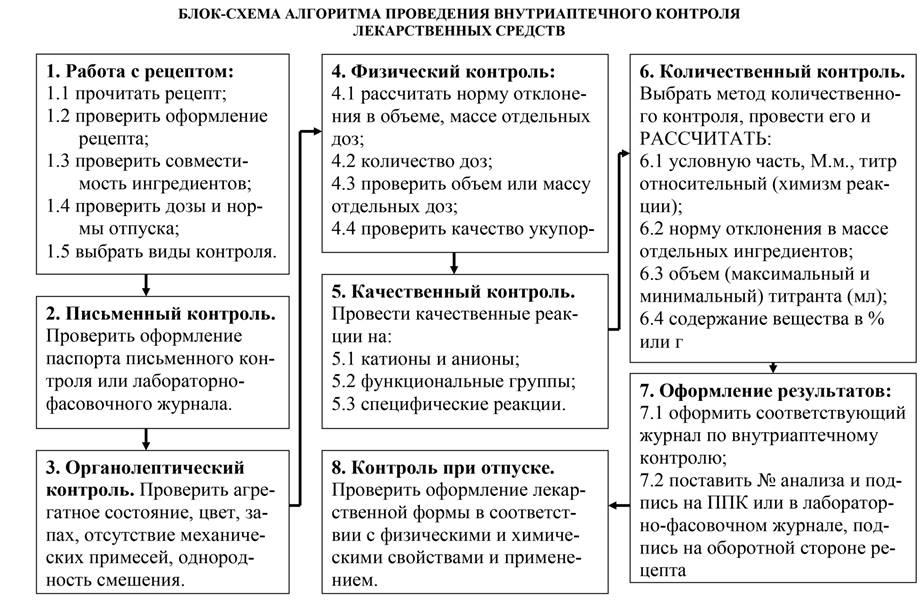
Приложение 4
ПРОТОКОЛ АНАЛИЗА ЛЕКАРСТВЕННОЙ ФОРМЫ, ИЗГОТОВЛЕННОЙ ПО ИНДИВИДУАЛЬНОМУ РЕЦЕПТУ
№ ______ от ______________________
|
РЕЦЕПТ: |
|
|
|
Виды ВАК: |
|
|
|
Испытания проведены по НД: |
|
|
|
Упаковка: |
|||
|
Требование: |
Результат испытания: |
||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
||
|
Маркировка: |
|||
|
Требование: |
Результат испытания: |
||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
||
|
Описание: |
|||
|
Требование:
|
Результат испытания: |
||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
||
|
Определение подлинности: |
|||
|
Компонент 1 |
|||
|
Химическое название |
|
||
|
Химическая формула |
|
||
|
М.м. |
|
||
|
Компонент 2 |
|||
|
Химическое название |
|
||
|
Химическая формула |
|
||
|
М.м. |
|
||
|
Определение подлинности: |
|||
|
Компонет 1 |
|||
|
Реакция 1. |
|||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
||
|
Реакция 2. |
|||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
||
|
Компонент 2 |
|||
|
Реакция 1 |
|||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
||
|
Реакция 2 |
|||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
||
|
Количественное определение: |
|||
|
Компонент 1 |
|||
|
Методика, уравнения химических реакций:
|
Расчеты, результат испытания: |
||
|
Компонент 2 |
|||
|
Методика, уравнения химических реакций:
|
Расчеты, результат испытания: |
||
|
Условия и сроки хранения: |
|||
|
|
|||
|
Заключение: лекарственная форма удовлетворяет/ не удовлетворяет требованиям НД. |
|||
|
Анализ провел: _____________________________________ |
Дата: __________________ |
||
|
Провизор-аналитик (преподаватель):________________________________ |
Подпись:____________________ |
Приложение 5
ПРОТОКОЛ АНАЛИЗА ЛЕКАРСТВЕННОГО СРЕДСТВА
ПРОМЫШЛЕННОГО ПРОИЗВОДСТВА
№ ______ от ______________________
|
Наименование лекарственного препарата |
|
|||
|
МНН |
|
|||
|
Форма выпуска |
|
|||
|
НД |
|
|||
|
Химическое название |
|
|||
|
Химическая формула |
|
|||
|
М.м. |
|
|||
|
Упаковка: |
||||
|
Требование: |
Результат испытания: |
|||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|||
|
Маркировка: |
||||
|
Требование: |
Результат испытания: |
|||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|||
|
Описание: |
||||
|
Требование:
|
Результат испытания: |
|||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|||
|
Определение подлинности: |
||||
|
Компонент 1 |
||||
|
Химическое название |
|
|||
|
Химическая формула |
|
|||
|
М.м. |
|
|||
|
Компонент 2 |
||||
|
Химическое название |
|
|||
|
Химическая формула |
|
|||
|
М.м. |
|
|||
|
Определение подлинности: |
||||
|
Компонет 1 |
||||
|
Реакция 1. |
||||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|||
|
Реакция 2. |
||||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|||
|
Компонент 2 |
||||
|
Реакция 1 |
||||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|||
|
Реакция 2 |
||||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|||
|
Количественное определение: |
||||
|
Компонент 1 |
||||
|
Методика, уравнения химических реакций:
|
Расчеты, результат испытания: |
|||
|
Компонент 2 |
||||
|
Методика, уравнения химических реакций:
|
Расчеты, результат испытания: |
|||
|
Условия и сроки хранения: |
||||
|
|
||||
|
Заключение: лекарственное средство удовлетворяет/ не удовлетворяет требованиям НД. |
||||
|
Анализ провел: _____________________________________ |
Дата: __________________ |
|||
|
Начальник ОКК (преподаватель):________________________________ |
Подпись:____________________ |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.