
Химия
Тема: Углеводороды
Цель: описывать и различать основные классы углеводородов, выдвигать гипотезы на основе знаний о составе, строении вещества и основных химических свойств.
Учебная информация.
Органической химией изначально называлась химия веществ, полученных из организмов растений и животных. С такими веществами человечество знакомо с глубокой древности. Сейчас органическую химию чаще всего называют химией соединений углерода.
Особенности органических соединений:
1. В состав всех органических веществ входят углерод и водород, поэтому большинство из них горючи и при горении обязательно образуют углекислый газ и воду.
2. Органические вещества построены более сложно, чем неорганические, и многие из них имеют огромную молекулярную массу, например те, благодаря которым происходят жизненные процессы: белки, жиры, углеводы, нуклеиновые кислоты и т. д.
3. Органические вещества можно расположить в ряды сходных по составу, строению и свойствам – гомологов.
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на гомологическую разность CH2.
4. Для органических веществ характерной является изомерия.
Изомерия – это явление существования разных веществ – изомеров с одинаковым качественным и количественным составом, то есть одинаковой молекулярной формулой.
Величайшим обобщением знаний о неорганических веществах является Периодический закон и Периодическая система элементов Д. И. Менделеева. Для органических веществ аналогом такого обобщения служит теория строения органических соединений А. М. Бутлерова:
1. Атомы в молекулах веществ соединены согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи.
2. Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.е. химическим строением вещества.
3. Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
Свойства вещества зависят от того, из каких атомов состоит его молекула. Молекула метана CH4 состоит из атомов углерода и водорода. Это вещество при обычных условиях – газ, который вступает в химические реакции с трудом. В состав молекул метилового спирта CH3OH, помимо атомов углерода и водорода, входит атом кислорода. Метиловый спирт в тех же условиях – это уже жидкость, которая способна реагировать с различными веществами, например с серной кислотой, металлическим натрием.
В то же время могут отличаться и свойства веществ с одинаковым качественным составом. Ацетилен C2H2 и бензол C6H6 имеют одинаковый качественный состав и простейшую формулу CH (на один атом углерода в их молекулах приходится один атом водорода), но отличаются по количественному составу, что отражают их молекулярные формулы.
Теория А. М. Бутлерова объяснила неясности и противоречия в знаниях об окружающем мире, творчески обобщила достижения в области химии и представила качественно новый подход к пониманию строения и свойств веществ.
Классификация органических веществ
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
|
Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
|
Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
|
Классификация органических веществ по составу |
||
|
Углеводороды |
Кислородсодержащие вещества |
Азотсодержащие вещества |
|
Состоят из атомов углерода и водорода |
Содержат также атомы кислорода |
Содержат также атомы азота |
Углеводороды
|
Углеводороды – это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода. |
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
|
Углеводороды |
|||||
|
Предельные (содержат только одинарные связи) |
Непредельные (содержат двойные или тройные связи между атомами углерода) |
||||
|
Алканы |
Циклоалканы |
Алкены |
Алкадиены |
Алкины |
Ароматические углеводороды |
|
Углеводороды с открытой (незамкнутой) углеродной цепью |
Атомы углерода соединены в замкнутый цикл |
Одна двойная связь |
Две двойные связи |
Одна тройная связь |
Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
|
CnH2n+2 |
CnH2n |
CnH2n |
CnH2n-2 |
CnH2n-2 |
CnH2n-6 |
|
Этан CH3-CH3 |
Циклобутан
|
Этилен CH2=CH2 |
Дивинил CH2=CН-СН=СH2 |
Ацетилен СН≡СН |
Бензол
|
|
Ациклические углеводороды |
|
|
С неразветвленной цепью |
С разветвленной углеродной цепью |
|
н-Бутан CH3-CH2-CH2-CH3 |
Изобутан
|
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
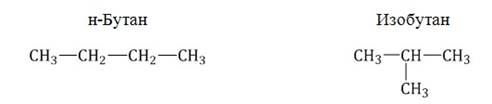
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле.
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
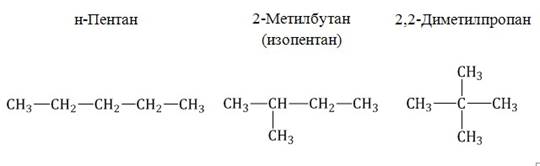
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Номенклатура органических соединений
Номенклатура органических веществ – это система правил, которые позволяют дать уникальное название каждому химическому соединению.
Перед изучением номенклатуры органических веществ обязательно рекомендую познакомиться с темой
|
Номенклатура органических соединений |
||
|
Тривиальная |
Систематическая |
Рациональная |
Систематическая номенклатура ИЮПАК
В настоящее время используется номенклатура ИЮПАК (IUPAC) — Международный союз теоретической и прикладной химии (International Union of Pure and Applied Chemistry).
Основа названия органических соединений в зависимости от числа атомов углерода:
|
Количество атомов С в цепи |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Корень |
Мет- |
Эт- |
Проп- |
Бут- |
Пент- |
Гекс- |
Гепт- |
Окт- |
Нон- |
Наличие двойных или тройных связей в молекулах органических соединений обозначают, добавляя в конце слова суффикс -ен или -ин:
|
Тип связей |
Одинарная связь (С–С) |
Двойная связь (С=С) |
Тройная связь (СΞС) |
|
Суффикс |
-ан |
-ен |
-ин |
Наличие функциональных групп в органической молекуле обозначают добавлением в название приставки или суффикса:
|
Функциональная группа |
Приставка |
Суффикс |
|
–СООН |
-карбокси |
|
|
–СООН |
— овая кислота |
|
|
–SO3H |
Сульфо- |
-сульфокислота |
|
–(С)Н=O |
Оксо- |
-аль |
|
–ОН |
Гидрокси- |
-ол |
|
–SН |
Мерканто- |
-тиол |
|
–NH2 |
Амино- |
-амин |
|
–NО2 |
Нитро- |
|
|
–OR |
Алкокси- |
|
|
–F, –Cl, –Br, –I, –Hal |
Фтор-, хлор-, бром-, йод- (галоген-) |
Для обозначения числа кратных связей и числа функциональных групп используют следующие числительные:
|
Количество кратных связей и функциональных групп |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Числительное |
Ди |
Три |
Тетра |
Пента |
Гекса |
Гепта |
Окта |
Название углеводородных радикалов:
|
Название |
Углеводородный радикал |
|
Метил- |
–CH3 |
|
Этил- |
–CH2CH3 |
|
Пропил- |
–CH2CH2CH3 |
|
Изопропил- |
–CH(CH3)CH3 |
|
Бутил- |
– CH2CH2CH2CH3
|
|
Изобутил- |
– CH2CH(CH3)CH3 |
|
Втор-бутил |
– CH(CH3)CH2CH3 |
|
Трет-бутил |
– C(CH3)3 |
Правила составления названий алканов
1. Выбирают главную углеродную цепь
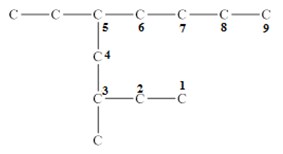
Главная цепь — это самая длинная и самая разветвленная непрерывная последовательность углеродных атомов. При этом неважно, как нарисованы на схеме углеродные атомы (вверх, вниз, влево, вправо). При этом углеводородные радикалы, которые не входят в главную цепь, являются в ней заместителями. Главная цепь должна быть самой длинной.
|
Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а |
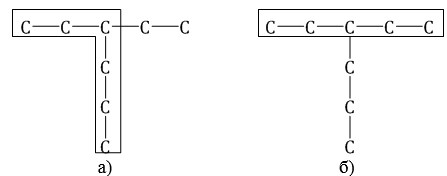
2. Главная цепь должна быть самой разветвленной.
|
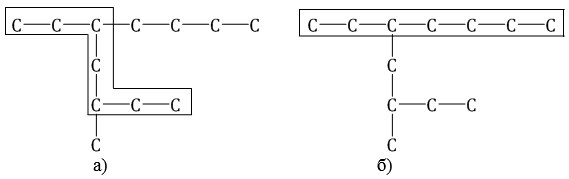
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от главной цепи на рисунке б – один: |
3. Нумеруют атомы углерода в главной цепи.
Нумерацию следует начинать с более близкого к старшей группе конца цепи.
При наличии двух и более заместителей цепь стараются пронумеровать так, чтобы заместителям принадлежали минимальные номера.
|
Например, правильная нумерация в главной углеродной цепи |
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов, ароматических углеводородов, циклоалканов.
|
Алканы– предельные углеводороды, поэтому они не могут вступать в реакции присоединения. Для предельных углеводородов характерны реакции:
|
|
|
Физические свойства: СН4-С4Н10 –газы, С5Н12-С15Н32-жидкости, высшие алканы - твѐрдые вещества |
|
|
Из синтез-газа (СО + Н2) получают смесь алканов: |
CO + 3H2 = CH4 + H2O |
|
Реакция Вюрца- Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода |
2СnН2n+2Сl+2NaàСn*Н2n*+2+ 2NaCl |
|
Гидролиз карбида алюминия |
Al4C3+ 12H2Oà3CH4+ 4Al(OH)3 |
|
Крекинг алканов с изначально большей длиной цепи Процесс, используемый в промышленности, протекает в интервале температур 450-500oC в присутствии катализатора и при температуре 500-700oC в отсутствие катализатора: |
C8H18=C4H10+C4H8 |
|
Гидрирование непредельных углеводородов алкенов: алкинов и алкадиенов: |
CnH2n + H2 = CnH2n+2 CnH2n-2 + 2H2 = CnH2n+2 |
|
Химические свойства |
|
|
Тип реакции |
Уравнение |
|
I. Реакции окисления. |
|
|
1. Горение: а) полное |
CH4 + 2O2 → CO2 + 2H2O 2С4Н10 + 13О2 → 8СО2 +10Н2О |
|
б) неполное |
2CH4 + 3O2 → 2CO + 4H2O |
|
2. Каталитическое окисление (различные катализаторы и t окисления) а) метан – до метанола, я или муравьиной кислоты |
2CH4 + O2 → 2CH3OН метанол CH4 + O2 → НCНO + H2O метаналь 2CH4 + 3O2 → 2НCOOН+ 2H2O муравьиная кислота |
|
б) гомологи метана окисляются с разрывом С-С цепи и образованием карбоновых кислот |
2C4H10 + 5O2 → 4СН3COOН+ 2H2O Уксусная кислота |
|
II. Замещение. |
|
|
1.Галогенирование (на свету или при t). Идѐт по свободнорадикальному механизму, начинается с разрыва связи в молекуле хлора. |
CH4 + Cl2 → CH3Cl + HCl
|
|
2.Нитрование (реакция Коновалова) |
С2Н6 + НNО3→ С2Н5NО2+ H2O |
|
III. Термические превращения алканов |
|
|
1. Дегидрирование гомологов метана Гомологи метана превращаются в алкены: |
С2Н6 → С2Н4 + Н2
|
|
2. Изомеризация (при нагревании и в присутствии хлорида алюминия) |
СН3-СН2-СН2-СН3→ СН3-СН-СН3 | СН3 |
|
3. Пиролиз (разложение на простые вещества): а) полное б) неполное |
1000о С СН4 → С + 2Н2
1500оС 2CH4 → С2Н2 + 3Н2 |
|
4. Разрушение С - С цепи (крекинг) (400-500 оС) Алкан → новый алкан + алкен |
С20Н42 → С10Н22 + С10Н20
|
|
IV. Конверсия метана при 800оС и в присутствии никелевого катализатора |
СН4 + Н2О → СО + 3Н2
|
|
V. Ароматизация алканов (С ≥ 6) при нагревании и действии катализатора |
С6Н14→ С6Н6 + 4Н2
|
|
VI. При о.у. не обесцвечивают бромную воду и раствор перманганата калия |
- |
|
VII. Реакции присоединения не характерны |
- |
|
|
|
|
Алкены |
|
|
Физические свойства: С2Н4-С4Н8 –газы, С5Н10-С16Н32- жидкости, высшие алкены - твѐрдые вещества. |
|
|
Дегидрогалогенирование галогеналканов |
СnН2n+1Cl+NaOH(спирт)àСnН2n+ NaCl+ H2O |
|
Дегидратация спиртов |
СnН2n+1OHàСnН2n+H2O |
|
|
|
|
Химические свойства |
|
|
Тип реакции |
Уравнение химической реакции |
|
I. Окисление: 1) Полное (горение) |
С2Н4 + 2О2 → СО2 + 2Н2О |
|
2) Неполное (разрывтолько π-связей) В нейтральной среде: окисление перманганатом калия сопровождается образованием диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам углерода, между которыми существовала двойная связь. Окисление этилена приводит к образованию двухатомного спирта – этиленгликоля: |
3 CH2 = CH2 + 2KMnO4 + 4H2O → 3 CH2 – CH2 + 2MnO2 + 2KOH | | OH OH Упрощѐнно: CH2 = CH2 + НОН + [O] → CH2(OH) – CH2(OH)
|
|
II. Присоединение |
|
|
1) Гидрирование при о.у.
|
CH2 = CH2 + Н2 → CH3 – CH3
|
|
2) Гидратация |
H2SO4 СН2 = СН2 + НОН → СН3 – СН2ОН |
|
Присоединение воды к несимметричному алкену происходит по правилу Марковникова: «Атом водорода присоединяется к наиболее гидрированному атому углерода, а гидроксогруппа к менее гидрированному атому углерода». |
CH3-CH=CH2 + НОН → СН3 – СН– СН3 | ОН |
|
3) Галогенирование |
CH2 = CH2 + Br2 → CH2Br – CH2Br |
|
4) Гидрогалогенирование Присоединение галогеноводорода к несимметричному алкену происходит по правилу Марковникова: «Атом водорода присоединяется к наиболее гидрированному атому углерода, а галогены к менее гидрированному атому углерода». |
CH2 = CH2 + HBr → CH3– CH2Br СН3 – CH = CH2 + HBr → CH3 – CHBr – CH3
|
|
III. Полимеризация -процесс образования полимера изнизкомолекулярных веществ, без выделения побочных продуктов |
n CH2 = CH2 → (– CH2 – CH2 –)n - полиэтилен n CH2 = CН → (– CH2 – CH –)n - полипропилен | | CH3 CH3
|
|
|
|
|
Алкадиены |
|
|
Виды диенов: 1) алкадиены с кумулированным расположением двойных связей СН2 = С = СН2; 2) с сопряжѐнными двойными связями СН2 = СН - СН= СН2; 3) с изолированными двойными связями СН2 = СН – СН2 – СН= СН2. |
|
|
Физические свойства: в обычных условиях пропадиен-1,2 и бутадиен-1,3 – газы; изопрен - летучая жидкость. Алкадиены с изолированными двойными связями - жидкости. Высшие диены -твѐрдые вещества. |
|
|
Способ Лебедева для бутадиена-1,3 |
2C2H5OHàCH2=CH-CH=CH2+2H2O+ H2 |
|
Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:
|
|
|
Химические свойства |
|
|
Тип реакции |
Уравнение химической реакции |
|
I. Реакции присоединения У кумулированных и изолированных диенов вначале взаимодействует одна связь, затем вторая. Особенностью сопряженных диенов является то, что двойные связи в их молекулах функционируют как единое целое и присоединение идет преимущественно по крайним положениям сопряженной системы (1,4 присоединение) с образованием новой двойной связи в центре системы. Параллельно, однако, идет второстепенная реакция - присоединение по одной из двойных связей (1,2 присоединение). |
|
|
1) галогенирование Обесцвечивают бромную воду: |
CH2 = CH – CH = CH2 + Br2 → CH2Br – CH = CH – CH2Br 1,4 –дибромбутен-2 |
|
2) гидрирование |
CH2 = CH – CH = CH2 + Н2 → CH3 – CH = CH – CH3 бутен-2 |
|
3) гидрогалогенирование |
CH2 = CH – CH = CH2 + НBr → CH2Br – CH = CH – CH3 1 –бромбутен-2 CH2 = CH – CH = CH2 + НBr → CH3 – CHBr – CH = CH2 3 –бромбутен-1 |
|
II. Реакция полимеризации (получают синтетическиекаучуки СК) |
t, p, кат nCH2 = CH – CH = CH2 → (- CH2 – C = CH – CH2- )n бутадиеновый СК t, p, кат nCH2 = C – CH = CH2 → | СН3
(- CH2 – C = CH – CH2- )n | СН3 изопреновый СК
|
|
III. Обесцвечивают KMnO4 |
|
|
Алкины Физические свойства: Ацетилен – газ, без запаха, малорастворим в Н2О, легче воздуха. Температуры кипения иплавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2 - С4Н6 – газы, С5Н8 - С16Н30 – жидкости, с С17Н32 – твердыевещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов. Алкины плохо растворимы в воде, лучше – в органических растворителях. |
|
|
Термический крекинг метана: |
2СН4 = С2H2 + 3H2 (Температура = 1500) |
|
Карбидный способ |
СаС2+ 2H2OàC2H2+ Ca(OH)2 |
|
Дегидрогалогенирование дигалогеналканов |
СnН2nCl2+2NaOH(спирт)àСnН2n-2 + 2NaCl+2 H2O |
|
Химические свойства алкинов |
|
|
Тип реакции |
Уравнение химической реакции |
|
I. Окисление: |
2 C2H2 + 5О2 → 4СО2 + 2Н2О |
|
1) Полное (горение) |
|
|
II. Присоединение (реакции могутпротекать в двестадии): |
|
|
1) Гидрирование |
Ni, t H C |
|
2) Гидратация Реакция Кучерова:
|
Н+, Hg2+ H C Гомологи ацетилена – в кетоны: Н+, Hg2+ HC (ацетон) |
|
3) Галогенирование
|
H C H CBr=CBr H+ Br2→ H CBr2 CBr2 H
|
|
4) Гидрогалогенирование
|
HC хлорэтен (винилхлорид) По правилу Марковникова – несимметричные алкины: СН3 - C CH + 2НCl → СН3 - СCl2 – СН3 |
|
III. Полимеризация Тримеризация: реакция Зелинского: |
акт. С, 500 С 3НC |
|
Димеризация: получение винилацетилена |
NH4Cl, CuCl, t 2НC |
|
IV. Реакция алкинов с аммиакатами серебра или одновалентной меди является качественной на наличие концевой тройной связи: |
HC диацетиленид серебра (желтый осадок)
|
|
|
|
|
Арены |
|
|
Физические свойства: Бензол и его ближайшие гомологи – бесцветные жидкие вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (вызывает заболевание крови – лейкемию). |
|
|
Тримеризация ацетилена |
3С2H2àC6H6 |
|
Химические свойства аренов на примере бензола |
|
|
Тип реакции |
Уравнение химической реакции |
|
I. Окисление: 1) Полное (горение) Неполное окисление не характерно. |
2C6H6 + 15О2 → 12СО2 + 6Н2О |
|
II. Реакции замещения - наиболее характерны, бензольное кольцо не разрушается (сходство с алканами): 1) галогенирование
|
FeCl3 С6H6 + чист.Cl2 → С6H5Cl + HCl хлорбензол FeBr3 С6H6 + чист.Br2 → С6H5Br + HBr бромбензол |
|
2) нитрование |
t, к.H2SO4 С6H6 + HNO3 → С6H5NO2 + H2O нитробензол |
|
3) алкилирование - получение гомологов вещества |
с алкенами t С6H6 + СН2=СH - СН3 → С6H5СН(СН3)2 изопропилбензол (кумол)
|
|
III.Реакции присоединения- менее характерны, протекают с трудом (в жѐстких условиях), т.к. происходит разрушение π-электронного облака (сходство с алкенами): 1) гидрирование |
t,Ni С6Н6 + 3Н2 → циклогексан |
|
2) присоединение Cl2 при освещении |
hυ С6H6 + 3Cl2 → C6H6Cl6 гексахлорциклогексан (гексахлоран) |
|
Бензол в отличие от непредельных углеводородов не присоединяет воду и галогеноводороды, а также не обесцвечивает раствор KMnO4 и бромную воду. |
|
Задание: сделайте конспект занятия, выучите определения и формулы органических соединений. Выполненное задание прикрепите в Элжур или отправьте на электронную почту: daniletskiy87@mail.ru
Основные источники:
· Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2017.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.