Химия 9 класс
Тема: "Угольная кислота и её соли. Круговорот углерода в природе".
Цели:
Образовательная:
закрепление знаний о средних и кислых солях на примере карбонатов и гидрокарбонатов, их взаимопревращениях. Изучение качественной реакции на карбонат – ион;
ознакомление с практическим применением карбонатов и гидрокарбонатов.
Развивающая:
развитие познавательной активности и самостоятельности учащихся;
формирование исследовательских навыков.
Воспитательная:
формирование валеологической и экологической грамотности учащихся.
Эпиграф к уроку : «…У школьного мела, у стен дворца и у стен пирамиды один источник, одна основа….»
Ход урока
1.Организационный момент.
Я рада встрече с вами. Сегодня мы продолжим изучение соединений углерода. Перед началом урока я пожелаю вам хорошего настроения и творческих успехов, надеюсь, что наша встреча пройдёт плодотворно.
2.Актуализация знаний
Фронтальный опрос:
- 1)Какой вид химической связи в молекуле углекислого газа?
- 2)Почему молекула углекислого газа неполярна?
- 3)Как получают углекислый газ в лаборатории?
- 4)Как получают углекислый газ в промышленности?
- 5)Опишите физические свойства углекислого газа.
- 6)Перечислите все известные вам названия оксида углерода (IV) (всего 4).
- 7)Охарактеризуйте химические свойства углекислого газа.
- 8)При помощи, какой реакции можно обнаружить углекислый газ?
- Обладает ли углекислый газ окислительно – восстановительными свойствами?
Предполагаемые ответы учеников:
- 1)Ковалентная неполярная связь (слабополярна);
- 2)В линейной молекуле СО2, например, каждая из связей
С–О полярна. Однако молекула СО2 в целом неполярна, так как дипольные моменты связей компенсируют друг друга. Дипольный момент молекулы углекислого газа m = 0.
Рис. Дипольный момент углекислого газа.
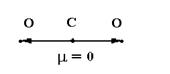
- 3)Получение углекислого газа в лаборатории СаСО3 + 2HCl = CaCl2 + H2O + СО2↑
- 4)Получение углекислого газа в промышленности обжигом известняка СаСО3 → СаО + СО2↑
-5) Углекислый газ СО2 – бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха, при обычных условиях в 1 объёме воды растворяется 1 объём углекислого газа. При давлении в 60 атмосфер CO2 превращается в бесцветную жидкость. При испарении жидкого СО2 образуется снегообразная масса, которую прессуют – «сухой лёд» - для хранения пищевых продуктов. Вы уже знаете, что твёрдый СО2 имеет молекулярную решётку, способен к возгонке.
-6) Диоксид углерода (углекислый газ, двуокись углерода, оксид углерода (IV), угольный ангидрид).
- 7)СО2 – кислотный оксид (реагирует со щелочами, основными оксидами и водой).
СО2 + NaOH = NaHCO3 СО2 + 2NaOH = Na2CO3 + H2O
СО2 + Ca(OH)2 = CaCO3↓ + H2O СО2 + CaO = CaCO3
СО2 + H2O = H2CO3
- 8)СО2 + Ca(OH)2 = CaCO3↓ + H2O
Выпадет белый творожистый осадок - CaCO3.
3. ( Мотивация целеполагание ).
Беседа
Зачитываю фрагмент:
В романе Г.Г. Хаггарда «Клеопатра» написано: «… она вынула из уха одну из 3-х огромных жемчужин и опустила жемчужину в уксусную кислоту? Наступило молчание, потрясённые гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется, вот от неё не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая, и выпила всё до последней капли».
Объяснить растворение жемчужины мы сможем в ходе урока, изучив свойства солей самой распространённой в природе кислоты: угольной.
4. Изучение нового материала
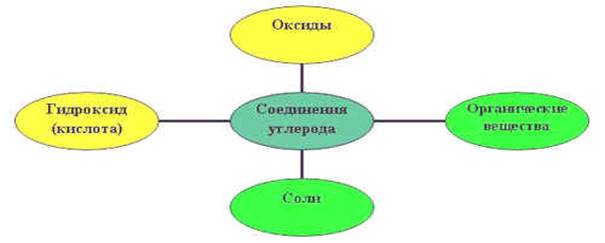
Учитель: 1. Какие соединения образует углерод?
Учащиеся составляют кластер: «Соединения углерода»
2.Как называется ряд, составленный из следующих формул веществ?
C → CO→ CO2→H2CO3→CaCO3
(Ответ учащихся: генетический ряд углерода)
У доски учащийся выполняет индивидуальное задание: записывает уравнения реакций переходов.
1)CO2 + C = 2CO
2)2CO + O2 = 2CO2
3)CO2 + H2O = H2CO3
4)H2CO3 + Ca(OH)2 = CaCO3↓ + 2H2O
3.Какие соединения углерода мы уже изучили? ( Ответ: оксиды углерода)
4. А какие соединения предстоит изучить? (Ответ: угольную кислоту и её соли)
«Открывание бутылки с газированной водой»
Учитель: Открывая бутылку лимонада, “Пепси-колы” или любого другого газированного напитка мы сталкиваемся с нашей незнакомкой. Это она, угольная кислота. Как часто предательски вырывается она из бутылки, разбрызгиваясь вокруг. Это происходит от того, что молекулы её крайне неустойчивы, а в бутылке она находится под большим давлением, когда мы открываем крышку , она сразу разлагается: H2CO3=H2O + CO2
Угольная кислота- это тот редкий случай вещества, формулу которого принято считать условной, т. е. такой молекулы не существует, однако возможно рассматривать не только свойства её соединений, но и собственные свойства этой кислоты.
Учитель: что вы будете наблюдать при длительном пропускании углекислого газа через дистиллированную воду, подкрашенную фиолетовым лакмусом?
1. образование белого осадка;
2. появление синей окраски раствора;
3. видимых изменений не происходит;
4. появление красноватой окраски раствора
Учащиеся предлагают варианты ответов и выбирают правильный.
Вывод: угольная кислота является слабой, что подтверждает розовая окраска лакмуса, а не красная, как в растворах сильных кислот.
Учащиеся объясняют наблюдаемые явления и записывают уравнение реакции получения угольной кислоты, определяют тему урока : «Угольная кислота и ее соли
Характеристика угольной кислоты составляется в ходе беседы с классом. Учащиеся классифицируют угольную кислоту по известным признакам, записывают уравнения диссоциации по ступеням.
Учитель: в ходе дальнейшей работы на уроке вам предстоит изучить:
- состав солей угольной кислоты, их названия
- свойства солей: гидролиз, взаимодействие с солями, с кислотами, взаимопревращение карбонатов и карбонатов, разложение их при нагревании
-качественную реакцию на карбонаты
- практическое значение карбонатов
-нахождение карбонатов в природе, их происхождение
Полученные знания и умения вам пригодятся в практической деятельности и повседневной жизни для:
- безопасного обращения с веществами и материалами
- критической оценки информации о веществах, используемых в быту.
Учитель:так как угольная кислота двухосновная, то ей состветствуют соли двух типов. Какие?
Соли
Средние Кислые
CaCO3 Ca(HCO3)2
Дайте названия этим солям
(Карбонат кальция ) (Гидрокарбонат кальция)
Что можно сказать о растворимости карбонатов? (работа с таблицей растворимости: растворимы только соли K+, Na+, NH4+ )
А гидрокарбонаты ? ( растворимы все)
Учитель: Особенностью солей угольной кислоты является их способность превращаться друг в друга. «Взаимопревращения карбонатов и гидрокарбонатов»-
Какой вывод можно сделать из наблюдаемых явлений?: (в избытке кислоты карбонаты превращаются в гидрокарбонаты, а при нагревании - наоборот).
Учитель: известно ли вам, что для устранения изжоги в желудке можно использовать 3%-ный раствор пищевой соды или таблетки гидрокарбоната натрия
Учитель: соли угольной кислоты, карбонаты и гидрокарбонаты в воде подвергаются гидролизу, обладают щелочной реакцией среды, поэтому могут быть использованы для нейтрализации кислотной среды.
Итак, мы переходим к следующему свойству солей угольной кислоты: взаимодействию их с кислотами:
Учитель : соли угольной кислоты реагируют с кислотами. Будучи одной из самых слабых кислот она легко вытесняется из солей более сильными кислотами : соляной, серной и др.
Как а практике можно использовать реакцию этерификации?
(Таким образом можно распознать соли угольной кислоты среди других солей. Это качественная реакция на карбонаты и гидрокарбонаты).
Учитель: действительно, основной компонент этих объектов живой и неживой природы- карбонат кальция. Не случайно в своей поэме о минералах Н.М.Федоровский написал:
По формуле, как не смотри,
Они не рознятся никак:
Все те же кальций це о три,
Как мрамор, так и известняк.
Учитель. Вам никогда не приходило задуматься о том, почему, желая дать какому-то произведению искусства оценку, говорят: «Это-жемчужина…». А далее уже называют вид искусства. Но почему жемчужина? А потому, что жемчуг всегда считался символом высочайшего проявления прекрасного. Так что же такое жемчуг
Учитель: В романе Г. Хаггарда «Клеопатра» читаем: «… она вынула из уха одну из 3-х огромных жемчужин и опустила жемчужину в …?. Наступило молчание, потрясённые гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется, Вот от неё не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая, и выпила всё до последней капли».
Я думаю, сейчас вы сможете ответить на вопрос: «В чём же растворила жемчужину Клеопатра?» (ответ: в кислоте) - В какой? Ведь она потом выпила полученный раствор (ответ: в уксусной).
Учитель предлагает учащимся вернуться к эпиграфу и закончить это высказывание.
Учитель: я думаю, вы уже поняли, что соли угольной кислоты широко распространены в природе и участвуют во многих химических процессах. А теперь я предлагаю вам объединиться в группы с тем, чтобы поработать с предложенными текстами, из которых вы узнаете о значении и применении карбонатов и гидрокарбонатов в повседневной и практической деятельности человека
5 .Закрепление
Упр.2,7,стр.128-129
6 . Рефлексия
---Я узнал сегодня много нового
---- Мне это пригодится в жизни
----На все вопросы, возникающие в ходе урока я получил(а) ответы
-----На уроке я работал добросовестно и цели урока достиг
7.Домашнее задание: п. 35, в.5,6,с.129
8. Итог урока( оценки)
ПРИЛОЖЕНИЕ 2
Сообщение учащегося о жемчуге
Жемчуг - твёрдое округлое
образование, извлекаемое из раковин некоторых моллюсков. Ценится как
драгоценный камень и используется для производства ювелирных изделий. У многих
народов Востока (и даже Запада) существует бесконечное число легенд,
объясняющих происхождение жемчужин из слез счастья или горя, слез богинь, слез
красавиц или дурнушек, из росы утренней зари и так далее, но ни одна из них не
указывает на истинного творца этого дивного сокровища - на невзрачного
слизняка, на моллюска... Жемчуг не является «камнем». Жемчуг – это продукт
жизнедеятельности моллюска. Жемчужина образуется внутри раковины моллюска в
результате попадания туда постороннего предмета (песчинки и др.). Вокруг
предмета-«затравки» происходит отложение перламутра, образующего тонкими
плёнками концентрические слои. Перламутр представляет собой органоминеральный
агрегат карбоната кальция (чаще всего в форме арагонита) и конхиолина (рогового
вещества). Обычно жемчуг имеет белый цвет, иногда кремовый или розовый;
встречаются также жёлтые, зелёные, чёрные и даже голубые жемчужины. Голубые
жемчужины очень редки, имеют высокую стоимость и привлекательность из-за редкого,
голубого, свинцово-серого оттенка.
Жемчужины были всегда любимыми украшениями у многих народов, чествовали их за
нежную красоту и оригинальную форму.
К сожалению, к нашему времени не сохранилась ни одна старинная жемчужина из-за своего непродолжительного века.
Это объясняется тем, что со временем органическое вещество, которое находится в них, высыхает, подвергается разложению. История знает много примеров больших жемчужин. Однако ни одна из них не дошла до наших дней: жемчужины не сохраняются больше 150—200 лет (исключение составляют случаи, когда нет доступа воздуха; при раскопках находили жемчужины в слоях 2000-летней давности). Наиболее старая жемчужина, чья история может быть прослежена, — «Перегрина», принадлежавшая Элизабет Тейлор.
Перегрина - довольно крупная жемчужина грушевидной формы в 50,95 карата (10,19 грамма). Она имеет яркий молочный цвет. Перегрина, что в переводе с испанского означает «путешественница» или «паломница», действительно проделала довольно долгий путь, прежде чем попасть в коллекцию голливудской актрисы. Первые упоминания о Перегрине относятся к XVI веку - жемчужина стала свадебным подарком испанского короля Филипа II его второй супруге, королеве Англии Марии I Кровавой. На нескольких портретах Мария изображена с этой жемчужиной.
ПРИЛОЖЕНИЕ 2
Сообщение учащегося об образовании сталактитов и сталагмитов.
В земной коре могут быть большие залежи известняка. Под
действием воды и углекислого газа нерастворимые карбонаты превращаются в
растворимые гидрокарбонаты, которые вымываются водой. В результате в земной
коре образуются пустоты (карсты). Вот такие пустоты и называют карстовыми
пещерами. Мраморная пещера — одна из красивейших пещер Крыма, которая находится
в семи километрах от Алушты на одном из плато Чатырдага на высоте 1000
метров над уровнем моря. Мраморная пещера
создавалась в течение сотен тысяч лет и образована из мраморированного
известняка. Это настоящий подземный природный музей, в котором можно увидеть
восхитительные по своей красоте каменные водопады, каскады небольших озер,
натечные занавеси, россыпи пещерного жемчуга. По богатству сталагмитового и
сталактитового убранства, а также благоустройству и обслуживанию экскурсантов
она входит в число пяти самых известных пещер Европы. Откуда же появилось это
чудо природы? Всё это создано из соединений кальция, а точнее из карбоната и
гидрокарбоната кальция. Образование сталактитов и сталагмитов в пещерах можно
объяснить так. Дождевая вода, просачиваясь через свод известняковой пещеры,
растворяет в себе содержащийся в горной породе известняк. Разумеется, вода не
стекает со свода пещеры ручьём, а очень медленно капает, настолько медленно,
что часть её успевает испариться, а растворённый в ней известняк снова
кристаллизуется в виде свисающих с потолка каменных «сосулек». Так образуются
сталактиты.
Упавшие вниз капли известковой воды тоже испаряются, а растворённый в них
известняк остаётся в месте падения капель, образуя вертикальные конусообразные
наросты – сталагмиты.
Самой длинной считается Мамонтова пещера в штате Кентукки в США. Общая длина подземных коридоров составляет почти 600 км. Пещера Крубера-Воронья — глубочайшая в настоящий момент пещера мира (глубина более 2000 м), она расположена в горном массиве Арабика в Абхазии.
Образование карст в районах жилых или промышленных построек может привести к тому, что под землю проваливаются жилые дома, промышленные здания, другие постройки.
Когда холодный раствор гидрокарбоната кальция с током воды оказывается на поверхности земли, то он нагревается под солнечными лучами и разлагается на карбонат кальция, углекислый газ и воду. Таким образом, карбонат кальция вновь осаждается, только в другом месте.
ПРИЛОЖЕНИЕ 3
Текст для группы 1
Карбонаты в виде известняков используют при строительстве. При обжиге известняка образуется оксид кальция, или негашёная известь: СаС03 = СаО + С02.
При добавлении к оксиду кальция воды образуется гашёная известь: СаО + Н20 = Са(ОН)2.
Гашёную известь используют при строительстве для побелки, штукатурки, при этом для прочности добавляют песок. Гидроксид кальция, реагируя с углекислым газом воздуха, превращается в карбонат кальция и постепенно твердеет.
Многие памятники скульптуры и архитектуры сделаны из известняка и мрамора. Вы, наверное, знаете, что за последние десятилетия они начали сильнее разрушаться, чем за всё предыдущее время. Это происходит под воздействием кислотных дождей. Кислоты получаются при взаимодействии в атмосфере оксидов азота и серы, образующихся при сжигании различных видов топлива, с водой. Под воздействием этих кислот из памятников культуры вымываются карбонаты: СаС03 + H2S04 = CaS04 + С02 + Н20.
В последнее время для их защиты используют покрытия из высокомолекулярных соединений — силиконов.
Текст для группы 2
Вода в природе бывает мягкая и жёсткая. Жёсткой называют воду, содержащую различные соли. Различают временную и постоянную жёсткость.
Временная жёсткость обусловлена присутствием растворимых гидрокарбонатов кальция и магния — Са(НС03)2 и Mg(HC03)2. Данные соли разрушаются при кипячении, поэтому такую жёсткость и называют временной.
Постоянная жёсткость обусловлена присутствием других солей, например сульфатов (CaS04) и хлоридов (СаС12).
Использование в быту воды с повышенной жёсткостью приводит к дополнительным материальным и энергетическим затратам. Например, при кипячении такой воды на стенках посуды образуется постепенно толстый слой накипи, образованной нерастворимыми карбонатами кальция и магния:
Са(НС03)2 = СаС03 + Н20 + С02.
Чем больше слой накипи, тем дольше закипает чайник
При стирке в жёсткой воде расходуется больше стиральных средств, в частности мыла. При этом часть мыла тратится на связывание ионов кальция и магния, в результате этого образуются нерастворимые соединения кальция и магния, которые выпадают в осадок.
В настоящее время для стирки используют синтетические моющие средства, эффективность которых мало зависит от жёсткости воды. Однако синтетические моющие средства медленно разрушаются в природной среде и вызывают загрязнение водоёмов.
Смягчить воду можно химическим путём. Для этого в жёсткую воду добавляют соду Na2C03 или известковую воду Са(ОН)2, при этом карбонат кальция выпадает в осадок. Временную жёсткость устраняют также кипячением.
Как влияет жёсткая вода на организм человека? Хотя ионы кальция и магния играют важную роль в водно-солевом балансе организма, их избыток может привести к нарушению обмена веществ и развитию заболеваний, например почечно-каменной болезни.
Наши прабабушки старались умывать лицо, мыть волосы талой или дождевой водой, которая содержит очень малое количество солей. Такая вода не сушит кожу, и волосы после мытья мягкие и блестящие. Обратите внимание, что в составе кремов присутствует умягчённая вода, а шампуни, пены для ванн обязательно содержат смягчители воды.
Овощи, мясо, сваренные в мягкой воде, гораздо вкуснее и сочнее. Жёсткую воду не рекомендуют использовать для приготовления пищи, так как она снижает вкусовые качества блюд.
Текст для группы 3.
Карбонаты применяют в производстве стекла. Сырьём для получения обычного стекла служат чистый кварцевый песок, сода и известняк. Эти вещества тщательно перемешивают и подвергают сильному нагреванию (до 1500 °С). При этом протекают реакции:
Na2C03 + Si02 = Na2Si03 + C02↑;
CaC03 + Si02 = CaSi03 + C02↑.
Расплавленное стекло охлаждается постепенно, и ему можно придать различную форму.
Известняк и глина, содержащая оксид кремния, служат основным сырьём для производства цемента. Эти вещества тщательно перемешивают и обжигают смесь в наклонных цилиндрических печах, длина которых достигает 200 м, а диаметр составляет около 5 м. В процессе обжига печь медленно вращается, исходные материалы постепенно движутся, при этом между глиной и известняком происходят сложные реакции. Образовавшиеся вещества спекаются в куски, после охлаждения их размалывают до тонкого порошка. Цемент широко используют в строительстве как связующий материал.
Гидрокарбонаты аммония и натрия применяют в кондитерском деле, они легко разлагаются при нагревании, образуя газы, разрыхляющие тесто и делающие его пышным:
NH4HC03 = NH3 + Н20 + С02; 2NaHC03 = Na2C03 + Н20 + С02.
Карбонат натрия, или соду, используют в огнетушителях. Огнетушитель представляет собой стальной баллон, заполненный раствором соды. Сверху помещена ампула с серной кислотой. Когда огнетушитель приводят в действие, ампула разбивается, серная кислота реагирует с карбонатом натрия, начинает выделяться углекислый газ и образуется пена. Пена прекращает доступ кислорода к горящему предмету, и таким образом происходит тушение пожара.
Текст для группы 4
В нашей стране значительные площади занимают кислые почвы. Наличие в кислых почвах большого количества ионов водорода резко ухудшает плодородие земли. Для нейтрализации кислотности и повышения плодородия проводят известкование кислых почв, т. е. вносят в почву известняк СаС03 и доломит СаС03 • MgC03 в измельчённом виде.
Известкование известно человеку давно. Земледельцы Галлии и Британских островов использовали известняк и мел на полях, лугах и пастбищах около 2000 лет назад.
К карбонатам относится также минерал малахит (СuОН)2С03. Его используют как декоративный и поделочный камень. Красоту малахиту придают ярко-зелёный цвет, затейливый узор, нередко создающий загадочную картину. В Зимнем дворце, расположенном в Санкт-Петербурге, имеется малахитовый зал. Из малахита также получают зелёную краску.
© ООО «Знанио»
С вами с 2009 года.
![]()


