
"Азот и его соединения". Урок - обобщение
Предмет: химия
Класс: 9
Тип урока: урок – обобщение
Цели:
Образовательные: Создание условий для обобщения и закрепления изученного материала по теме, отработки полученных умений записывать уравнения химических реакций;
Воспитательные: Создание условий для формирования умения работать в коллективе, воспитания взаимопомощи, положительного отношения к изучению химии, умений проводить взаимооценку;
Развивающие: Развитие познавательного опыта школьников.
Задачи:
Организовать продуктивную работу детей в группах с помощью заданий и вопросов по изученной теме;
Создать ситуацию успеха и взаимоподдержки детей через организацию работы в группах;
Поддерживать интерес с помощью разнообразных и интересных вопросов по теме обобщения;
Организовать взаимопроверку и оценку результатов работы.
Урок-презентация проводится с использованием мультимедийного проектора. Переходя от слайда к слайду, ученики вспоминают изученный ранее материал и используют свои знания для выполнения упражнений и ответов на поставленные вопрос.
Оборудование и материалы: проектор, компьютер, презентация, листы ответов и ключи для взаимопроверки. Для организации и проведения урока учитель делает презентацию с вопросами и ответами. К каждому слайду подобираются картинки с информацией по вопросу, которые могут быть использованы в качестве подсказок.
Элементы и атомы
В менделеевский взятые круг,
Сделали химию самой богатой
И самой творческой из наук.
Г. Санников
Ход урока
1 .Вступительное слово учителя.
По выражению М. Монтеля «Очень полезно оттачивать и шлифовать свой ум об умы других». Нам сегодня предстоит нелегкий труд по оттачиванию ума. Ведь ум, по словам Аристотеля, заключается не только в знании, но и в умении прилагать знания на деле. Вы готовы вместе со мной отправиться в путешествие за знаниями для того, чтобы научиться применять их на деле?
2. Актуализация знаний (проблемная беседа).

Пять знаменитых химиков XVIII в. дали некоему неметаллу, который в виде простого вещества представляет собой газ и состоит из двухатомных молекул, пять разных имен.
В 1772 году шотландский химик, ботаник и врач Даниел Резерфорд назвал его «ядовитым воздухом».
В 1772 году английский химик Джозеф Пристли - «дефлогестированным воздухом».
В 1773 году шведский химик-аптекарь Карл Шееле - «испорченным воздухом».
В 1774 году английский химик Генри Кавендиш - «удушливым воздухом».
В 1776 году французский химик Антуан Лавуазье - «безжизненным воздухом».
Ответ: об азоте
Американский биохимик Майкл Камен дал следующее определение: «Азот - это вечный источник танталовых мук человека, это вечное терзание голода среди океана изобилия. Как это вы понимаете?
Итак, тема сегодняшнего урока «Азот и его соединения», урок-обобщение.
3.Работа с карточками. Учащиеся отвечают на вопрос , начиная со второго. При этом учитель демонстрирует вопросы из презентации.
2.Что означает слово “азот”?
3.положение азота в Периодической системе
4.степени окисления атома азота
5.особенности химической связи в молекуле азота.
6.Дайте названия и характеристику всем известным оксидам азота
7.физические свойства азота как простого вещества
8.Назовите одним словом все перечисленные соединения азота:
9.Напишите формулу пекарского порошка.
10.Напишите цепочку превращений, в результате которых из воздуха и воды можно получить
селитру.
11.Какие соединения азота используются как удобрения?
12.Назовите наиболее известные природные неорганические соединения азота
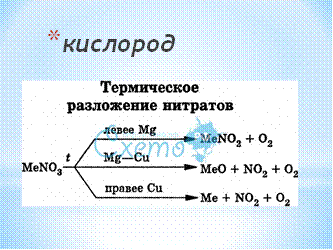
13.Какой газ всегда образуется при термическом разложении нитратов?
14.Какой газ образуется при сжигании азота при температуре электрической дуги
15..Какое водородное соединение образует азот?
16.Какие оптимальные условия поддерживаются в процессе промышленного синтеза аммиака
17.Какая соль имеет тривиальное название «нашатырь»
18.В чем особенности вики и люпина?
д20.Что же произошло дальше? Какую роль выполняли телохранители? Напишите уравнение реакции.
19. Напишите уравнение реакции получения азотной кислоты в промышленности.
21.Крепкая водка пожирает луну, выпуская «лисий хвост». Сгущение полученной жидкости порождает адский камень, который чернит ткань, бумагу и руки. Чтобы луна опять взошла, прокаливай адский камень”.
4. Проверка работы учащихся.
Обмениваются тетрадями и проверяют по презентации учителя







Знаете ли вы, что NO образуется также при грозовом разряде в атмосфере. Статистика утверждает, что в атмосфере нашей планеты ежегодно вспыхивают три с лишним миллиарда молний. Мощность отдельных разрядов достигает 200 млн. киловатт, а воздух разогревается при этом (локально) до 20000 К, хотя разряд молнии длится десятитысячную долю секунды. При такой чудовищной температуре молекулы азота и кислорода разрываются на атомы, которые активно и легко соединяются друг с другом, образуя молекулы оксида азота (II). Молекулы NO быстро окисляются на воздухе до более стабильных молекул оксида азота (IV). Этот атмосферный процесс во многом помогает решать проблему связывания свободного азота.






Учитель:Знаете ли вы, что «Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота на химических предприятиях (иногда — из выхлопных
труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится
бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.
Газ с резким запахом, хорошо растворим в воде.
Российский химик Иван Каблуков славился своими чудачествами. Например, он подписывался не иначе как «Каблук Иван». В 1882-1888 г.г. он преподавал на Высших женских курсах в Москве, а с 1884г. - в Московском университете. Однажды он показал своим студентам удивительный опыт с четырьмя газометрами, наполненными ртутью, где хранились четыре газа – два бесцветных, а два другие – красно-бурого цвета. Каблуков пропускал поочередно эти газы над раскаленной медной стружкой и показывал, что вне зависимости от состава исходного газа получаются одни и те же продукты: оксид меди (I) Cu2O и азот N2. Студенты терялись в догадках – как такое стало возможно?
Помогите найти объяснение опытам Каблукова.
(Газометры были наполнены оксидами азота состава N2O (бесцветный), NO (бесцветный), NO2 (бурый), N2O3 (при комнатной температуре на 90% разлагается на NO и NO2, поэтому тоже приобретает бурый цвет). Все эти газы реагируют с медью, превращая ее в Cu2O).

N2 O + 2Сu = Cu2O + N2 ;
2NO + 4Сu = 2Cu2O + N2;
2N O2 + 8Сu =4Cu2O + N2;
N2 O3 + 6Сu = 3Cu2O + N2.
5. Ответ на вопрос, (про танталовы муки) заданный в начале урока, даёт ученик специально подготовившийся.
Жил в те времена во Фригии царь Тантал, сын Зевса и земной женщины Плуто. Боги любили Тантала и наградили его всем, что только может пожелать человек: и силой, и богатством, и здоровьем. По его плодородным землям текла златоносная река Пактола, и Тантал мог пригоршнями черпать золото, когда только хотел. Круглый год зрели в его садах сочные сладкие фрукты, многочисленные стада паслись на зеленых лугах.. Так бы и жил Тантал в счастье и довольстве всюсвоюжизнь, если бы не обуяла его гордыня.
Как ни любил Зевс своего сына, последнее его преступление переполнило чашу терпения великого громовержца. Сбросил он его в царство мертвых, и там до сих пор несет Тантал ужасную кару за свои злодеяния. Он вечно хочет пить – и не может напиться, хочет есть – и не может этого сделать. Стоит Тантал в прозрачной прохладной воде. Она достигает ему до самого подбородка, но стоит ему наклониться, как вода тотчас же исчезает. Свисают над Танталом ветки, полные душистых ароматных плодов, но как только он протягивает руку за ними, порыв ветра отклоняет ветки, и он никогда не может достать ни одного плода. Не только голод и жажда терзают своенравного Тантала, но и вечный страх, потому что там, где он стоит, нависает над его головой огромная скала.
6.Каждое задание оценивают в баллах согласно таблице
Если ученик набрал 30 – 36 баллов ставится оценка «5»,
20 – 29 баллов ставится оценка «4»,
11 – 19 баллов ставится оценка «3»,
0 – 10 баллов ставится оценка «2».
Приложение 2
|
КЛЮЧИ |
||
|
№ вопроса |
ОТВЕТ |
Баллы |
|
1 |
Азот |
1 |
|
2 |
«Безжизненный». Азот является обязательным компонентом белков и нуклеиновых кислот, значит, без него нет жизни. |
1 |
|
3 |
№ 7, 2 период, 5 А группа |
1 |
|
4 |
+5, +4, +3, +2, +1, 0, -3 |
3 |
|
5 |
Ковалентная неполярная, кратная, тройная, очень прочная |
1 |
|
6 |
Бесцветный газ, без вкуса и запаха, в воде растворим хуже кислорода. Химически инертен (малоактивен) |
1 |
|
7 |
N2O – оксид азота (1), «веселящий газ» - средство для наркоза, несолеобразующий оксид, не взаимодействует с водой, растворами кислот и щелочей, кислородом; NO – оксид азота (2), безразличный оксид, не взаимодействует с водой, растворами кислот и щелочей, но быстро окисляется при обычных условиях до NO2; N2O3 – оксид азота (3), реагирует со щелочами, с водой дает HNO2; NO2 – оксид азота (4), «бурый газ», «лисий хвост», кислотный оксид, взаимодействует с водой и растворами щелочей; N2O5 – окcид азота (5), кислотный оксид, самопроизвольно разлагается на NO2 и O2, с водой образует HNO3. |
5 |
|
8 |
Селитры (нитраты) |
1 |
|
9 |
NH4HCO3 |
1 |
|
10 |
N2 → NO → NO2 → HNO3 |
3 |
|
11 |
Нитрат аммония, нитрат натрия, нитрат калия, сульфат аммония, нитрат кальция, жидкий безводный аммиак, аммиачная вода |
1 |
|
12 |
Чилийская селитра (нитрат натрия) |
1 |
|
13 |
Кислород |
1 |
|
14 |
NO |
1 |
|
15 |
Аммиак NH3 |
1 |
|
16 |
Давление 30 - 200 атм, температура 450 – 500 оС , катализатор – порошкообразное железо с примесью оксидов алюминия и калия, циркуляционный процесс |
3 |
|
17 |
Хлорид аммония |
1 |
|
18 |
Эти растения относятся к семейству бобовых (мотыльковых), на корнях которых развиваются клубеньковые бактерии, способные связывать атмосферный азот, переводя его в соединения, доступные для растений. Урожайность злаков, посеянных после бобовых, значительно увеличивается. |
1 |
|
19 |
4NO2 + O2 + 2H2O = 4HNO3 |
1 |
|
20 |
4NH3 + 5O2 |
2 |
|
21 |
Крепкая водка – азотная кислота – растворяет луну – серебро, выпуская «лисий хвост» - газ бурого цвета – оксид азота (IV): 2HNO3(конц.) + Ag = AgNO3 +NO2 + H2O. Адский камень – нитрат серебра – при нагревании разлагается с образованием серебра – луна взошла: 2AgNO3 |
5 |
7. Проверочная работа
Вариант 2
Часть А.
1.Валентность азота в молекулах аммиака и азотной кислоты равна:
А. I Б. II В. III Г. IV
2.Газ без цвета, с характерным резким запахом, почти в 2раза легче воздуха:
А. аммиак Б. азотная кислота В. азот Г. нитрат калия
3.В каком из перечисленных соединений степень окисления азота равна +5:
А. N2O3 Б. NH3 В. HNO3 Г. Mg3N2
4.Нитраты щелочных металлов, кальция и аммония-это:
А. нитриды Б. селитры В. сульфиды Г. сульфаты
5.Выделение оксида азота (IV) бурого цвета при взаимодействии соли с медью и серной кислотой - качественная реакция на:
А. Сульфат-ионы Б. Нитрат-ионы В. Ионы аммония Г. Хлорид-ионы
Часть В.
6.. Установите соответствие между названием вещества и его формулой
Название: Формула:
А. аммиак 1. NO2
Б. азотная кислота 2.HNO3
В. оксид азота (IV) 3.NH4Cl
Г. нитрат калия 4. NO
Д. хлорид аммония 5. NH3
6. NaNO3
Часть С.
7.Закончите молекулярное уравнение и назовите продукты реакции:
1) NH4Cl + Ca(OH)2 →H2O+…+…
2) HNO3разб+…→Zn(NO3)2 +…+ H2O
3) KNO3 →…+ …
Вариант 1
Часть А.
1.Связь в молекуле азота осуществляется посредством общих электронных пар в количестве:
А. 1 Б. 2 В. 3 Г. 4
2.Газ без цвета и запаха, немного легче воздуха
А. аммиак Б. азотная кислота В. азот Г. нитрат калия
3.В каком из перечисленных соединений степень окисления азота равна +3:
А. N2O3 Б. NH3 В. HNO3 Г. NH4Br
4.Бесцветная дымящаяся жидкость с резким раздражающим запахом:
А. аммиак Б. азотная кислота В. азот Г. серная кислота
5.Выделение аммиака при взаимодействии соли с щелочью- качественная реакция на:
А. Сульфат-ионы Б. Нитрат-ионы В. Ионы аммония Г. Хлорид-ионы
Часть В.
6. Установите соответствие между названием вещества и его формулой
Название: Формула:
А. азот 1. HNO3
Б. аммиак 2. NH4HSO4
В. азотная кислота 3. (NH4)2SO4
Г. гидросульфат аммония 4. NH3
Д. нитрат натрия 5.N2
6. NaNO3
Часть С.
7.Закончите молекулярное уравнение и назовите продукты реакции:
1) HNO3 →H2O+…+…
2) HNO3конц +…=Zn(NO3)2 +…+ H2O
3) N2 +H2 =
8.Заключительный этап.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.