
Урок по физике (11 класс)
Тема: Планетарная модель атома
Цели: раскрыть последовательность развития учения о строении атома. Рассмотреть опыт, подтверждающий сложность строения атома (опыт Резерфорда).
Задачи урока:
сформировать у обучающихся интерес по теме: Планетарная модель атома;
продолжить формирование познавательного интереса;
активизация мыслительной деятельности, формирование мышления; развитие умений сравнивать, выявлять закономерности, обобщать.
Тип урока: урок усвоения новых знаний.
Оборудование: компьютеры, подключенные к Интернету, учебники, карточки-задания.
План
1. Изучение нового материала
Проработка теоретического материала
2. Закрепление нового материала
3. Подведение итогов урока
4. Рефлексия
5. Домашнее задание
1. Изучение нового материала
Просмотреть видео: https://youtu.be/ckkkXcvFp1o
1. Развитие взглядов на строение атома.
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом - электроны и они являются частью атомов.
По мысли Томсона, положительный заряд занимает весь объём атома и распределён он в этом сферическом объёме равномерно. У более сложных атомов в положительно заряжённом шаре есть несколько электронов, так что атом подобен кексу, в котором роль изюма играют электроны. Распространённый термин этой модели - «Пудинг с изюмом» или «Булочка с изюмом».
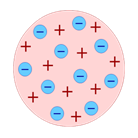

Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10-31кг;
![]() - отношение заряда электрона к его массе.
- отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.
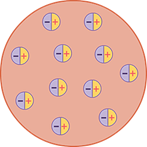
В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.
Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.

30.08.1871 г. – 19.10.1937 г.
Эрнест Резерфорд
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
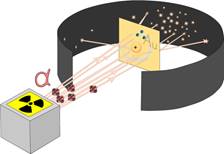
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:
|
Угол отклонения α-частиц φ, ° |
15 |
60 |
105 |
150 |
180 |
|
Число частиц N |
132000 |
477 |
70 |
33 |
1-3 |
Отсюда можно сделать вывод: такое поведение α-частиц возможно только в том случае, если они упруго взаимодействуют с массивным положительно заряжённым телом малых по сравнению с атомом размеров.
Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц, он сам не верил в положительный результат. Он сравнил такой эффект с 15-дюймовым снарядом, как если бы его выстрелили в кусок тонкой бумаги, а снаряд возвратился бы и нанёс обратный удар.
Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к мысли о существовании атомного ядра.
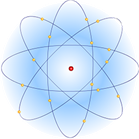
Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10-12-10-13 см (у разных ядер диаметры различны). Размер же самого атома 10-8 см, то есть от 10 до 100 тысяч раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра.
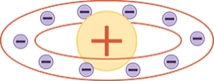
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д. И. Менделеева.
Электроны движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
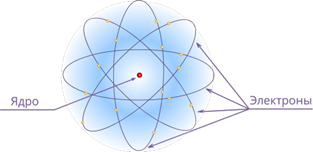
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
Закон Кулона:
![]()
qα — заряд α-частицы;
q — положительный заряд атома;
r — его радиус;
![]() — коэффициент пропорциональности.
— коэффициент пропорциональности.
Ядро атома водорода имеет положительный заряд, который по модулю равен заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Размер атома водорода — это радиус орбиты его электрона
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением. Ускоренно движущийся заряд должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны
Резерфорд создал планетарную модель атома: электроны обращаются вокруг ядра, подобно тому, как планеты обращаются вокруг Солнца. Эта модель проста, обоснована экспериментально, но не позволяет объяснить устойчивость атома.
2. Закрепление нового материала
Ответить на вопросы:
1. Какой ученый первым изучил состав атома?
2. В чем заключается суть планетарной модели атома?
3. Какая модель строения атома была предложена Резерфордом
Рефлексия:
Я на уроке
1. работал 1. понял материал
2. отдыхал 2. узнал больше,
чем знал
3.помогал другим 3. не понял
Домашнее задание: Учить § 74, написать конспект,
Информационные источники (основные учебники по предмету)
1. Мякишев Г.Я. Физика. 11класс. Учеб. для общеобразоват. организаций: базовый уровень / Г.Я. Мякишев, Б.Б. Буховцев, В.М. Чаругин; под ред. Н.А. Парфентьевой – М.: Просвещение, 2016. – 432 с.: ил. – (Классический курс).
2. https://cknow.ru/knowbase/336-521-planetarnaya-model-atoma.html
3. https://resh.edu.ru/subject/lesson/3910/conspect/48346/
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.