Ссылка: библиотека цок № https://m.edsoo.ru/ff0d4dd0
Предмет: химия
Класс: 8
Тема: Водород — элемент и простое вещество. Нахождение в природе
Цели:
Контролируемые элементы содержания
Получение кислорода, водорода, аммиака и углекислого газа, изучение их свойств. Качественные реакции на газообразные вещества.
Контролируемые умения
Овладение основами химической грамотности: способностью анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни; умением анализировать и планировать экологически безопасное поведение в целях сохранения здоровья и окружающей среды.
Проверяемые элементы содержания
Водород – элемент и простое вещество. Нахождение в природе, физические и химические свойства (на примере взаимодействия с неметаллами и оксидами металлов), применение, способы получения. Понятие о кислотах.
Предметные умения
Следовать правилам пользования химической посудой и лабораторным оборудованием, а также правилам обращения с веществами в соответствии с инструкциями по выполнению лабораторных химических опытов по получению и собиранию газообразных веществ (водорода и кислорода), приготовлению растворов с определённоймассовой долей растворённого вещества.
Личностные результаты
Овладение основными навыками исследовательской деятельности, установка на осмысление опыта, наблюдений, поступков и стремление совершенствовать пути достижения индивидуального и коллективного благополучия
Функциональная грамотность
Овладение основными навыками исследовательской деятельности, установка на осмысление опыта, наблюдений, поступков и стремление совершенствовать пути достижения индивидуального и коллективного благополучия
Тип урока: Урок освоения новых знаний и умений
На уроке предусмотрено использование следующих типов электронных образовательных материалов: «Видеолекция», «Диагностическая работа», «Интерактивная хрестоматия первоисточников», «Кейсы по работе с информацией», «Чек-лист».
Ключевые слова: ХИМИЧЕСКИЙ ЭЛЕМЕНТ. ПРОСТОЕ ВЕЩЕСТВО. КИСЛОТЫ
ХИМИЧЕСКИЕ СВОЙСТВА. ФИЗИЧЕСКИЕ СВОЙСТВА. ВОДОРОД.
Базовые понятия, единые для школьного образования: АЛГОРИТМ. ИНФОРМАЦИЯ. ОБЪЕКТ. СИСТЕМА. ФОРМУЛА
Этапы урока:
I.Вхождение в тему урока и создание условий для осознанного восприятия нового материала
1) Актуализация опорных знаний
Составление характеристики водорода как простого вещества организуйте как индивидуальную работу. После проверки выполненной работы обратите внимание учеников, что для характеристики водорода как простого вещества имеющийся запас знаний оказывается недостаточным и поэтому возникает необходимость в изучении свойств водорода.
Характеристика водорода как химического элемента и как простого вещества
Видеолекция

2) Целеполагание
Включите видеоролик “Как и почему горит Солнце”. По окончании его просмотра организуйте небольшую беседу о химическом составе Солнца. Подведите учеников к тому, что водород самый распространённый элемент Солнца.
ВОДОРОД И ВСЕЛЕННАЯ
Видеолекция

II. Освоение нового материала.
1) Осуществление учебных действий по освоению нового материала
Организуйте просмотр видеоэкспериментов по изучению способов получения водорода и изучению его химических свойств. Обратите внимание учащихся на технику безопасности при работе с водородом. Следует привлечь внимание учеников на положение пробирки, в которую собирают водород, на вещество, которое образуется при сгорании водорода. Проверьте правильность составления уравнений химических реакций.
Если ученик допускает ошибки и затрудняется при ответе на вопросы, порекомендуйте повторно посмотреть видеоролики.
Изучение способов получения водорода и его химических свойств необходимо организовать со ссылкой на видеоэксперимент. При изучении областей применения водорода следует провести связь между свойством водорода и отраслью, где эта химическая реакция находит своё применение. Обратите внимание на правильность составления уравнений химических реакций и определение типа химической реакции.
История открытия водорода
Кейсы по работе с информацией
История открытия водорода
Изучите историю открытия водорода.
Великий алхимик и лекарь Средневековья Теофраст Парацельс, надеясь отыскать «философский камень», проводил химические эксперименты. Он погружал железо в серную кислоту и заметил, что в ходе реакции выделяются пузырьки бесцветного “воздуха”. Алхимик получил неизвестный горючий газ, но отделить этот газ от воздуха Парацельсу так и не удалось.
Английский физик и химик Роберт Бойль в 1666 году подробно описал результаты эксперимента, происходящие при взаимодействии железных опилок с разбавленными кислотами.
В 1745 году наш русский учёный М. В. Ломоносов писал, что при растворении неблагородных металлов в спиртовых кислотах выделяется газ “флогистон”.
Первооткрывателем водорода считается английский учёный Генри Кавендиш. Он расширил число способов получения водорода. Для эксперимента были использованы не только железо и серная кислота, но цинк, олово, соляная кислота и вода. В 1766 году учёный выделил его в чистом виде и назвал “горючим воздухом”. Кавендиш установил, что этот газ отличается от углекислого газа тем, что не растворяется в воде и не вступает во взаимодействие со щелочами. Он также установил, что “горючий газ” легче воздуха, не поддерживает дыхание животных и горение. Но было непонятно, откуда берётся “горючий газ” – из кислоты или из металла?
В 1785 году французский химик Антуан Лавуазье получил водород путём пропускания паров воды через раскалённое железо. Учёный при сжигании “горючего воздуха” обнаружил в продуктах горения капли воды. Лавуазье взорвал 500 тыс. гран ( 1 гран – 0,06 г) “горючего воздуха” и получил 135 гран воды. Он дал этому газу название «Hydrogenium» – “рождающий воду”, он же «водород».
Вопросы:
1. Кто открыл водород?
2. Как был открыт водород?
3. Составьте два уравнения реакции получения водорода
4. Почему водород получил такое название?
5. Составьте хронологическую последовательность открытия водорода.
РАСПРОСТРАНЕННОСТЬ ВОДОРОДА
Видеолекция

СВОЙСТВА И ОБЛАСТИ ПРИМЕНЕНИЯ ВОДОРОДА
Видеолекция
Способ получения водорода в лаборатории и изучение его свойств
Интерактивная хрестоматия первоисточников
Способ получения водорода в лаборатории и изучение его свойств
Как можно получить и собрать водород в лаборатории? Какими свойствами обладает водород?
1. Внимательно посмотрите получение водорода в лаборатории: https://www.youtube.com/watch?v=ZIycUN5hmLc.
Цель: Демонстрация химического эксперимента с комментарием.
2. Составьте соответствующее уравнение химической реакции в тетради: Zn + HCl
Цель: Демонстрация химического эксперимента взаимодействия цинка с соляной кислотой.
3. Внимательно посмотрите проверку водорода на чистоту: https://www.youtube.com/watch?v=ZIycUN5hmLc.
Цель: Демонстрация химического эксперимента взаимодействия цинка с соляной кислотой.
4. Внимательно посмотрите взаимодействие водорода с оксидом меди: https://www.youtube.com/watch?v=ZIycUN5hmLc.
Цель: Демонстрация химического эксперимента взаимодействия водорода с оксидом меди с комментарием.
5. Уравнение химической реакции: H2 + CuO
Цель: уравнение химической реакции взаимодействия водорода с оксидом меди.
2) Проверка первичного усвоения
Организуйте индивидуальную работу по выполнению заданий. Проанализируйте выполненные работы. Если ученик затрудняется в определении формул кислот и в составлении уравнений химических реакций, следует рекомендовать обратиться к модулю 2.1 и выполнить задания аналогичного типа.
задания с развернутым ответом
Диагностическая работа


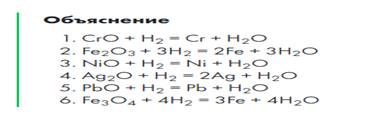
III. Применение изученного материала.
1) Применение знаний, в том числе в новых ситуациях
Порекомендуйте ученикам проанализировать текст задания. Дайте возможность порассуждать. В случае затруднения направляйте мыслительную деятельность с помощью наводящих вопросов.
Применение знаний
Диагностическая работа




2) Выполнение межпредметных заданий и заданий из реальной жизни
Организуйте процесс обсуждения устройства дирижабля. Почему судно могло подняться вверх? Могли ли на движение судна влиять порывы ветра? Почему на судно было запрещено вносить спички? Что могло вызвать взрыв дирижабля?
Межпредметные знания
Диагностическая работа


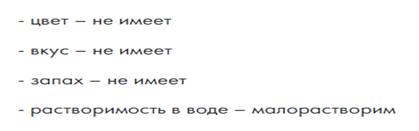
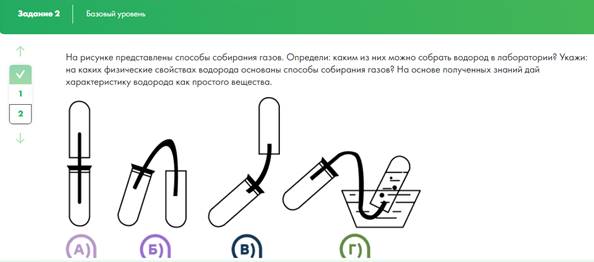
3)Выполнение заданий в формате ГИА (ОГЭ, ЕГЭ)
Необходимо предложить учащимся из представленного списка выбрать верные высказывания, характеризующие свойства водорода как простого вещества и как химического элемента. Обратите внимание учащихся на то, что между этими понятиями существует принципиальная разница. Если речь идёт о водороде как химическом элементе, то подразумевают атомы водорода или знак химического элемента, его характеристику по положению в Периодической системе химических элементов. Стоит принять к сведению, что атомы, наряду с другими элементами, входят в состав сложных веществ. Если речь идёт о водороде как простом веществе, то следует помнить, что оно обладает определёнными свойствами, способно вступать в химические реакции, и его можно получать и использовать в различных областях промышленности.
Выполнение заданий в формате ГИА (ОГЭ, ЕГЭ)
Диагностическая работа

4) Систематизация знаний и умений
Организуйте индивидуальное выполнение задания. Проанализируйте, как ученики справляются с заданием подобного типа.
Систематизация знаний и умений
Диагностическая работа


IV. Подведение итогов, домашнее задание
1) Самооценивание, рефлексия
Организуйте в классе процесс рефлексии по достигнутым либо недостигнутым образовательным результатам. По окончании работы ученики должны заполнить свой чек-лист и оценить полученные результаты.
Рефлексия
Чек-лист


2) Домашнее задание
Проведите последующий разбор домашнего задания.
Домашнее задание
Диагностическая работа


© ООО «Знанио»
С вами с 2009 года.
![]()


