
than accumulate during amplification and further detect the presence or absence of Yersinis enterocolitica in the test samples
The work was carried out within the framework of state grant funding of scientific projects of the Ministry of Education and Science of the Republic of Kazakhstan "Development of a realtime polymerase chain reaction (PCR) test system for identifying strains of Yersinia enterocolitica and strains of Yersinia pseudotuberculosis" (State Registration No.
0115PK01588).
Keywords: yersiniosis, Yersinia enterocolitica, мilk, meat.
Ромаданова Н.В., Серадж Н.А., Нурманов М.М., Карашолакова Л.Н.
РГП «Институт биологии и биотехнологии растений» КН МОН РК, Алматы
Казахский национальный аграрный университет, Алматы
Казахский национальный университет имени аль-Фараби, Алматы
ВВЕДЕНИЕ В КУЛЬТУРУ IN VITRO ДИКОРАСТУЩЕЙ ЯБЛОНИ MALUS SIEVERSII
В статье приведены результаты введения в культуру in vitro дикорастущих форм яблони Malus sieversii (Ledeb.) M. Roem. Отработаны методики проращивания семян, стерилизации полученных проростков, проверки на наличие эндофитной инфекции на специализированной питательной среде 523, биотехнологии массового микроклонального размножения. Отработанная методика позволяет получать высокий коэффициент размножения растений; возможность получать саженцы класса супер-элита круглый год независимо от сезона. В результате сокращается селекционный процесс за счет отбора форм по нужным признакам непосредственно в культуре in vitro. Использование асептических оздоровленных растений in vitro от вирусной, бактериальной и микоплазменной инфекции в международном обмене гермоплазмой облегчает процедуру прохождения карантинного контроля.
Ключевые слова: семена яблони, дикорастущие формы, культура in vitro.
Основным условием генетического улучшения плодовых культур является наличие и сохранение генофонда культурных и дикорастущих форм растений, обладающих хозяйственно ценными признаками. Яблоня – одна из важнейших плодовых культур. Казахстан является одним из центров ее происхождения [1]. Дикорастущие формы яблони Заилийского Алатау обладают комплексом ценных качеств: высокой устойчивостью ко многим заболеваниям, высокой морозостойкостью, широкой экологической пластичностью. Однако в последнее время эти уникальные формы плодовых находятся под угрозой исчезновения. Поэтому сейчас одной из основных задач является сохранение и восстановление популяций дикоплодовых лесов Казахстана, как источника генофонда культуры яблони мирового значения.
В селекционной практике для быстрого и эффективного размножения растительного материала применяют микроклональное размножение [2, 3]. Биотехнологические методы микроклонального размножения тканей и органов растений на искусственных питательных средах получили широкое распространение во многих странах [2-9]. Создание коллекции дикорастущей яблони в культуре in vitro, массовое ее размножение, и получение в дальнейшем саженцев, освобожденных от эндофитной инфекции – важная задача для сохранения и восстановления дикорастущих популяций.
Микроклональное размножение включает несколько этапов. В первую очередь – это отбор первичного экспланта, его стерилизация, подбор оптимальных условий культивирования для роста и развития побегов на питательной среде [3-5, 7-8]. Трудность введения древесных культур, особенно яблони, в асептические условия, связана с высоким процентом инфицированности растительного материала при отборе его в полевых условиях, а также значительным содержанием фенольных соединений в тканях, приводящих к некрозу изолированных эксплантов. Инфицированность растительного материала связана с высокой зараженностью его бактериальной, микоплазменной, а также вирусной инфекцией.
В связи с этим на данный момент остро встал вопрос о закладке маточных садов с растительным материалом, размноженным в учреждениях, занимающихся производством оздоровленного посадочного материала класса супер-элита, где вегетативное потомство получают в культуре in vitro от единичного исходного растения, или семени, отобранного по сортовой (клоновой) типичности с гарантированной чистотой от всех известных вирусных, бактериальных и микоплазменных заболеваний [10].
Ранее сотрудниками Института биологии и биотехнологии растений были представлены данные по получению асептических растений яблони в культуре in vitro [1113]. Целью настоящей работы являлось получение асептических растений дикорастущей яблони в культуре in vitro из семян, отработка эффективных режимов стерилизации и создание коллекции in vitro дикорастущих форм.
Объектами исследования являлись 3 формы дикорастущей яблони Malus sieversii (Ledeb.) M. Roem., собранные в ущелье Алмарасан Иле-Алатауского государственного национального природного парка. Координаты GPS: 1) КГ 21 – N 43°07'446", E 076°55'166", высота над уровнем моря 1398 м; 2) КГ 22 – N 43°07'43", E 076°55'56", высота над уровнем моря 1389 м; 3) КГ 23 – N 43°07'444", E 076°55'136", высота над уровнем моря 1396 м.
Для проращивания очищенные семена яблони обрабатывали раствором отбеливателя «Белизна» (1:1) в течение 5 минут, помещали в сосуды с влажным перлитом для стратификации в течение 8 недель при +4°С и проращивали при 23-25°С, освещенности 40 µE·m-2·s-1, 16-ти часовом фотопериоде (рисунок 1А, 1Б). По истечении указанного срока, семена в сосудах с перлитом переносили в светокультуральную комнату при температуре 23-25°С, освещенности 40 µE·m-2·s-1, 16-ти часовом фотопериоде для проращивания.

А – очищенные от мякоти плодов семена; Б – погружение семян во влажный перлит ля стратификации; В – проростки
Рисунок 1 – Проращивание семян дикорастущей яблони КГ 21 для введения в культуру in vitro.
Для введения в культуру in vitro срезали 1-3 недельные проростки яблони длиной 11,5 см и стерилизовали в 0,1% растворе HgCl2 в течение 7 и 10 мин в ламинарном боксе (рисунок 1В). Яблоня при введении в культуру in vitro выделяет фенольные соединения, которые приводят к гибели эксплантов. Для уменьшения концентрации фенолов в питательной среде простерилизованные побеги помещали на жидкую среду Мурасиге Скуга (МС), содержащей 30 г/л сахарозы с добавлением регуляторов роста: 0,5 мг/л 6бензиламинопурина (БАП), 0,01 мг/л индолилмасляной кислоты (ИМК), 1 мг/л гибберелловой кислоты (ГК) и 1 мг/л аскорбиновой кислоты (АК), рН 5,7. Во избежание развития некроза тканей проростки ежедневно переносили на свежую питательную среду [10-12, 14].
Введённые в культуру in vitro экспланты были протестированы на отсутствие эндофитной инфекции на специализированной среде 523, в состав которой входили: 10 г/л сахарозы, 8 г/л гидролизата казеина, 4 г/л дрожжевого экстракта, 2 г/л KH2PO4, 0,15 г/л MgSO4·7H2O, 6 г/л джелрайта, рН 6,9 [15]. Дальнейшее микроклональное размножение проводили с асептическими растениями яблони.
Для микроклонального размножения яблони использовали питательную среду МС с 30 г/л сахарозы, 0,5 мг/л БАП, 0,01 мг/л ИМК, 4 г/л агара, 1,25 г/л джелрайта, pH 5,7.
Пробирочные растения культивировали в светокультуральной комнате при температуре 23-25°С, освещенности 40 µE·m-2·s-1, 16-ти часовом фотопериоде и пассировали на свежую питательную среду с интервалом 3-4 недели.
Коэффициент размножения микрочеренков яблони рассчитывался по формуле (1):
Р=а/вс, (1)
где а - кол-во образовавшихся побегов в - кол-во высаженных побегов
с - кол-во пассажей
Статистическую обработку экспериментальных данных проводили по общепринятым методикам, описанным в пособии Г.Ф. Лакина [16].
Микроклональное размножение включает несколько последовательных этапов. В первую очередь необходимо было получить проростки из семян, очищенных от мякоти плодов сразу после сбора, а также после их стартификации во влажном перлите в течение 8 недель. В результате был отмечен высокий процент лабораторной всхожести (ЛВ) у всех стратифицированных образцов. В среднем ЛВ составила – 88,9% (рисунок 2). Процент ЛВ у семян, не прошедших стратификацию, был значительно ниже.
Полученные проростки обрабатывали в ламинарном боксе 0,1% раствором HgCl2 в течение 7 и 10 минут. Было выявлено, что для стерилизации побегов, полученных из семян, 7 минутная экспозиция в растворе HgCl2 была наиболее оптимальной. Жизнеспособность побегов при данной длительности стерилизации выше, чем при 10 мин обработке, при которой был отмечен высокий процент некроза, инфицированность побегов в обоих случаях стерилизации не отличалась (таблица 1).
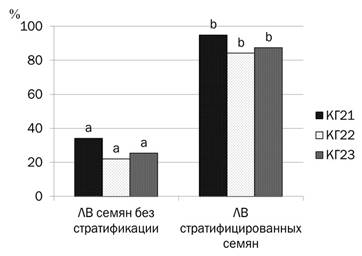
Рисунок 2 – Лабораторная всхожесть семян дикорастущих
форм яблони после стратификации во влажном перлите в течение
8 недель
Следует отметить, что было выявлено очень слабое выделение фенолов побегами in vitro в питательную среду. Уже через 2-3 дня питательная среда переставала окрашиваться растениями, интенсивность окрашивания была незначительна, некоторые побеги
фенолов совсем не выделяли (рисунок 3А-3В). Тогда как у побегов in vitro, полученных из черенков или срезанных непосредственно с деревьев длительность выделения фенольных веществ составляла 10-16 дней, при этом отмечалась высокая интенсивность окрашивания, которая могла приводить к гибели растений в культуре in vitro [14-16].
Таблица 1 – Введение в культуру in vitro побегов яблони
|
Наименование образца |
Кол-во экс-в, шт |
Некроз побегов |
Инфицированые побеги |
Кол-во выживших побегов |
Кол-во асептических побегов после проверки на среде 523 |
||||
|
шт. |
% |
ш т. |
% |
шт. |
% |
шт. |
% |
||
|
Стерилизация 7 мин HgCl2 |
|||||||||
|
Форма 21 |
18 |
2 |
11,1 |
2 |
11,1 |
14 |
77,8 |
14 |
77,8а |
|
Форма 22 |
20 |
0 |
0 |
0 |
0 |
20 |
100 |
20 |
100а |
|
Форма 23 |
34 |
0 |
0 |
3 |
8,8 |
31 |
91,2 |
31 |
91,2а |
|
Сред. ± ср.откл |
3,7±3,6а |
|
6,6±3,7a |
|
89,7±5,6b |
|
89,7±5,6b |
||
|
Стерилизация 10 мин HgCl2 |
|||||||||
|
Форма 21 |
20 |
5 |
25,0 |
3 |
15,0 |
12 |
60,0 |
10 |
50,0 |
|
Форма 22 |
22 |
4 |
18,2 |
0 |
0 |
18 |
81,8 |
18 |
81,8 |
|
Форма 23 |
40 |
7 |
17,5 |
4 |
10,0 |
29 |
72,5 |
28 |
70,0 |
|
Сред. ± ср.откл |
20,2±2,5c |
|
8,3±3,2a |
|
71,4±5,6d |
|
67,3±10,6d |
||
|
Примечание – Значения, обозначенные разными буквами, достоверно различаются между собой при р<0,01. |
|||||||||
Одним из наиболее актуальных моментов при введении побегов в условия in vitro и их дальнейшего успешного микроклонального размножения является контроль чистоты пробирочных растений. Бактериальную инфекцию не всегда легко обнаружить, так как она часто локализована во внутренних тканях. При этом растения не имеют выраженных внешних симптомов заражения и могут несколько месяцев культивироваться на питательных средах. С течением времени симптомы заболевания проявляются и весь растительный материал становится непригодным для дальнейшего культивирования. Через 3 недели роста побегов на жидкой питательной среде проводили проверку растительного материала на наличие эндофитной инфекции на среде 523 (рисунок 3Г). После проверки, на среде 523 у 2,4% растений была выявлена инфекция, в результате асептическими были 97,6% побегов (таблица 1).
Низкий процент инфицированности объясняется, тем, что побеги получены из семян, которые относительно стерильны. Поэтому способ получения растений in vitro дикорастущей яблони из семян намного эффективнее, чем из черенков и побегов, так как позволяет получать высокий процент выхода асептических растений, требует меньших затрат на реактивы и труд при каждодневном пересаживании побегов на свежую питательную среду.
В результате пробирочные растения были размножены на питательной среде МС, коэффициент размножения в среднем составлял – 4,4.
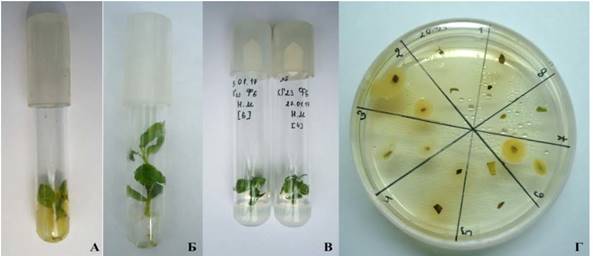
А – 1 неделя на жидкой питательной среде (выделение фенольных веществ); Б – 3 недели на жидкой питательной среде; В – 2 недели на твердой питательной среде; Г – проверка побегов in vitro на среде 523 для обнаружения бактерий и грибов (10 г/л сахарозы, 8 г/л гидролизата казеина, 4 г/л дрожжевого экстракта, 2 г/л KH2PO4, 0,15 г/л MgSO4•7H2O и 6 г/л джелрайта)
Рисунок 3 – Введение в культуру in vitro побегов дикорастущей яблони КГ23.
В результате проведенной работы коллекция асептических растений в культуре in vitro была пополнена 3 дикорастущими видами Malus sieversii КГ 21, КГ 22, КГ 23, и на данный момент насчитывает 40 образцов (рисунок 4).

А – дикорастущая яблоня КГ 21 на питательной среде МС с добавлением 0,5 мг/л БАП,
0,01 мг/л ИМК, 4 г/л агар и 1,25 г/л джелрайт; Б – асептические растения в светокультуральной комнате (24±1°С, освещенность 40 µмол•м-2•с-1, фотопериод 16/8 час)
Рисунок 4 – Коллекция in vitro Malus domestica Borkh и Malus sieversii (Ledeb. M. Roem.)
В дальнейшем, созданная коллекция асептических растений in vitro может послужить основой для проведения широкого спектра биологических исследований. Прежде всего для их последующей реинтродукции в естественные места обитания и в питомниководческие хозяйства.
Выводы:
1. Для получения проростков дикорастущей яблони эффективно использовать семена, стратифицированные в течение 8 недель во влажном перлите при температуре +4°С. Лабораторная всхожесть побегов при данной обработке в среднем составила – 88,9%.
2. Для получения высокого процента (89,7%) асептических побегов в культуре in vitro необходима стерилизация проростков, полученных из семян в 0,1% растворе HgCl2 в течение 7 мин. У проростков, полученных из семян, отмечено слабое выделение фенолов, а также после проверки побегов на питательной среде 523 выявлен низкий процент инфицированности.
3. Пополнена коллекция асептических растений яблони в культуре in vitro 3 дикорастущими видами Malus sieversii, на данный момент коллекция насчитывает 40 образцов.
Литература
1. Вавилов Н.И. Избранные труды. Генетика и селекция. М. – 1966.
2. Reed B.M. The basics of in vitro storage and cryopreservation // National Clonal Germplasm Repository, Corvallis, O.R. USA. – 2002. – Р. 34-46.
3. Волгина М.А., Карычев К.Г., Ковальчук И.Ю. Микроклональное размножение подвоев яблони и груши // Научные достижения в биотехнологии, виноградарстве и ягодоводстве. – Алматы: Бастау, 1997. – Т. 13. – С. 11-15.
4. Трускинов Э.В. Культура in vitro как современный способ воспроизведения, сохранения и интродукции вегетативно размножаемых растений // Биолог. разнообразие. Интродукция растений. – С.П., 2007. – С. 85.
5. Антоненко О.Ф. Мiкроклональний метод // Захист рослин. Киев, – 2002. –№ 2. –
C. 14.
6. Wilkin C.P., Bengochea T., Dodds J.H. The use of in vitro methods for plant genetic conservation // Outlook on Agricultur. – 1982. – Vol. 11, N 2. – P. 67-72.
7. Kausal N., Modgil M., Thakur M., Sharma D.R. In vitro clonal multiplication of an apple rootstock by culture of shoot apices and axillary buds // Indian J. Exp. Biol. – 2005. – Vol. 43. – Р. 561-565.
8. Dobránszki J., Jámbor-Benczúr E., Hudák I., Magyar-Tábori K. Model experiments for establishment of in vitro culture by micrografting in apple // Int. J. Hortic. Sci. – 2005. – Vol. 1. – Р. 47-49.
9. Pierik R.L.M. Commercial micropropagation in Western Europe and Israel // Micropropagation. Technology and Application. Kluwer Academic Publishers, Dordrecht. – 1991. – Р. 155–166.
10. Ромаданова Н.В., Кушнаренко С.В. Микроклональное размножение некоторых сортов яблони: введение в культуру in vitro // Поиск. Серия естественных и технических наук. № 1.– 2006. С. 54-58.
11. Ромаданова Н.В., Мишустина С.А., Матакова Г.Н., Рахимбаев И.Р., Кушнаренко С.В. Введение в культуру in vitro и микроклональное размножение перспективных сортов, клоновых подвоев и дикорастущих форм яблони // Ізденістер, нəтижелер, Исследования, результаты. – Алматы. – № 3 (059). – 2013. – С. 142-149.
12. Romadanova N.V., Mishustina S.A., Matakova G.N., Kuhsnarenko S.V., Rakhimbaev I.R., Reed B.M. In vitro collection of Malus shoot cultures for cryogenic bank development in Kazakhstan // Acta Horticulturae. – 2016 – Vol. 1113. – Р. 271-277.
13. Избасаров Д.С., Калтаев С.К., Маденов Э.Д., Нурмуратулы Т.Н., Карычев К.Г., Янкова А.И., Уразаева М.В., Нуртазина Н.Ю., Сальников Е.М., Береснева Л.В. Рекомендации о порядке производства посадочного материала плодовых культур и винограда в Алматинской области. – Алматы, 2010. – 30 с.
14. Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture // Physiol Plant. – 1962. – V. 15. – P. 473-479.
15. Viss P.R., Brooks E.M., Driver J.A. A simplified method for the control of bacterial contamination in woody plant tissue culture // In Vitro Cell. Dev. Biol. – 1991. – V. 27. – C. 42.
16. Лакин Г.Ф. Биометрия // М.: Высшая школа, 4 изд, – 1990. – 213 с.
Ромаданова Н.В., Серадж Н.А., Нұрманов М.М., Қарашолақова Л.Н.
MALUS SIEVERSII ЖАБАЙЫ АЛМАСЫН IN VITRO ЖАҒДАЙЫНА ЕНГІЗУ
Мақалада Malus sieversii (Ledeb.) M. Roem алмасының жабайы формаларын in vitro жағдайына енгізу нəтижелері келтірілген. Тұқымдарды көктету, алынған өскіндерді зарарсыздандыру, 523 арнайы қоректік ортасында эндофитті микрофлораға тексеру əдістемелері жəне микроклонды көбейту биотехнологиясы жақсартылды. Жасалған əдістеме өсімдіктердің көбеюінің жоғары коэффициентін жəне супер-элита класына жататын көшеттерді жел мезгіліне тəуелсіз алуға мүмкіндік береді. Нəтижесінде формаларды қажетті белгілері бойынша тікелей in vitro жағдайында іріктеу есебінен сұрыптау процесі қысқарады. Гермоплазмамен халықаралық алмасуда вирустық, бактериалды жəне микоплазмалық инфекциядан сауықтырылған асептикалық in vitro өсімдіктерді пайдалану карантиндік бақылаудан өту тəртібін жеңілдетеді.
Кілт сөздер: алма тұқымдары, жабайы формалар, in vitro культурасы.
Romadanova N.V., Seraj N.A., Nurmanov М.М., Karasholakova L.N.
INTRODUCTION OF WILD MALUS SIEVERSII APPLE INTO IN VITRO CULTURE
The article presents the results of introduction of wild Malus sieversii (Ledeb.) M. Roem apple forms into in vitro culture. Methods of seed germination, sterilization of obtained seedlings, testing for the presence of endophytic infection on a specialized 523 nutrient medium, biotechnology for mass micropropagation have been worked out. A proven method allows to get super-elite class seedlings all year round regardless of the season. As a result, the selection process is shortened by selecting the forms according to the required characteristics directly in vitro culture. The use of in vitro aseptic, healthy plants from viral, bacterial and mycoplasmal infection facilitates the procedure for quarantine control in the international exchange of germplasm.
Keywords: apple seeds, wild forms, in vitro culture.
Сапарбекова А.А., Мамаева Л.А., Байшанова А.Е., Кедельбаев Б.Ш.
Южно-Казахстанский государственный университет им. М. Ауезова, Шымкент Казахский национальный аграрный университет, Алматы
РЕКУЛЬТИВАЦИЯ ПОЧВ, ЗАГРЯЗНЕННЫХ УГЛЕВОДОРОДАМИ ТЯЖЕЛЫХ НЕФТЕПРОДУКТОВ
Использование термофильной культуры микроорганизмов, идентифицированной как Bacillus mesentericus fuscus М 314-А8 -3, обладающей высокой углеводородокисляющей способностью приводит к ускорению процесса биодеградации углеводородов мазута. В наших исследованиях произошло снижение нефтепродуктов в замазученных почвах за 60 дней с 1,6 г/100 г почвы до 0,6 г/100 г почвы, то есть на 62,5%. При этом, общее количество аренов снизилось с 8,5% до 3,2%. Из идентифицированных ароматических углеводородов, остался пирен и бензокарбазол, но количество их снизилось. Использование герметичных чехлов не только повышает степень деструкции на 8%, но и экономит поливную воду.
Ключевые слова: почва, мазут, биодеградация, рекультивация, микроорганизмы.
Проблема антропогенного воздействия человек на землю из года в год становится острой, тяжело решаемой задачей для всех стран нашего континента. В связи с чем, в рамке программы Erasmus + Program была организовано партнерское взаимоотношение «International University Cooperation on Land Protection in European-Asiatic Countries – IUCLAND» между следующими странами Европы и Азии: Италия, Хорватия, Словакия, Китай, Кыргызстан и Казахстан. Основной задачей которой является привлечь общественное внимание к проблеме охраны земель во всем мире, и в частности в Казахстане. Известно, что предприятия нефтедобывающей и нефтеперерабатывающей промышленности являются одним из основных источников загрязнения окружающей
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.