
Министерство образования и науки Челябинской области
Челябинский институт развития профессионального образования
Задания для выполнения практических работ
по учебной дисциплине «Химия»
Профиль подготовки
Естественно- научный
г. Челябинск, 2019 г
Задания по выполнению лабораторных работ по дисциплине «Химия» разработаны авторским коллективом преподавателей ПОО Челябинской области в соответствии с Примерной программой общеобразовательной учебной дисциплины «Химия» для профессиональных образовательных организаций, рекомендованной ФГАУ «ФИРО» в качестве примерной программы для реализации основной профессиональной образовательной программы СПО на базе основного общего образования с получением среднего общего образования (Протокол №3 от 21.07.2015г.; регистрационный номер рецензии 384 от 23.06.2015г. ФГАУ «ФИРО»).
Методические рекомендации обеспечивают реализацию дифференцированного подхода в обучении, позволяют применять опережающий метод познания и практического освоения учебного материала студентами ПОО СПО Челябинской области.
Рецензенты:
Г.П.Андрусенко – руководитель Центра ОМ сопровождения ПО ЧИРПО; О.В.Башарина – зав.лабораторией информатизации ПО и СИ.
О.В. Рогоза- преподаватель химии ЧТПиГХ имени Я.П.Осадчего
Содержание
|
Введение |
6 |
|
РАЗДЕЛ 1. Органическая химия |
5 |
|
1.1 Предмет органической химии Практическая № 1. Обнаружение углерода и водорода в органических соединениях. Обнаружение галогенов (Проба Бельштейна) |
10 |
|
1.2 Предельные углеводороды Практическая № 2. Получение метана и изучение его свойств: горения, отношения к бромной воде и раствору перманганата калия |
11 |
|
1.3 Этиленовые и диеновые углеводороды Практическая № 3. Получение этилена дегидратацией этилового спирта. Взаимодействие этилена с бромной водой. Растворимость перманганата калия |
13 |
|
Практическая № 4 Сравнение пламени этилена с пламенем предельных углеводородов (метана, пропан-бутановой смеси |
14 |
|
1.7 Гидроксильные соединения Практическая №5. Изучение свойств спиртов. Получение диэтилового эфира. Окисление спиртов различного строения хромовой смесью. Получение глицерата меди. |
14 |
|
1.8 Альдегиды и кетоны Практическая № 6. Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала», восстановление гидроксида меди(11). Взаимодействие формальдегида с гидросульфитом натрия |
16 |
|
1.9 Карбоновые кислоты и их производные Практическая № 7. Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами. Получение изоамилового эфира уксусной кислоты. |
18 |
|
Практическая №8. Сравнение степени ненасыщенности твердого и жидкого жиров. Омыление жира.
|
20 |
|
Практическая №9. Получение мыла и изучение его свойств: пенообразования, реакций ионного обмена, гидролиза, выделения свободных жирных кислот.
|
21 |
|
1.10 Углеводы Практическая №10. Реакция «серебряного зеркала» глюкозы, взаимодействие глюкозы с гидроксидом меди (11) при различных температурах. Действие аммиачного раствора оксида серебра на сахарозу. |
22 |
|
Практическая №11.Обнаружение лактозы в молоке. Действие йода на крахмал. Цветные реакции белка.
|
25 |
|
1.11 Амины. Аминокислоты. Белки Практическая № 12. Образование солей анилина. Бромирование анилина. |
26 |
|
1.13 Биологически активные вещества Практическая№13. Обнаружение витамина А в подсолнечном масле. Обнаружение витамина С в яблочном соке. Определение витамина Д в рыбьем жире или курином желтке.
|
29 |
|
Практическая№14. Действие амилазы слюны на крахмал. Действие дегидрогеназы на метиленовый синий. Действие каталазы на пероксид водорода.
|
31 |
|
Практическая№15. Анализ лекарственных препаратов, производных салициловой кислоты. Анализ лекарственных препаратов, производных п-аминофенола.
|
32 |
|
РАЗДЕЛ 2. Общая и неорганическая химия |
|
|
Практическая № 16. Изготовление моделей некоторых органических и неорганических веществ |
35 |
|
Практическая № 17 Очистка веществ фильтрованием и дистилляцией. Очистка веществ перекристаллизацией
|
37 |
|
2.8 Растворы Практическая № 18 Приготовление растворов различных видов концентрации |
39 |
|
2.11 Основные классы органических и неорганических соединений Практическая №19. Получение хлороводорода и соляной кислоты, их свойства. |
40 |
|
Практическая №20. Получение аммиака, его свойства |
43 |
|
2.12 Химия элементов Практическая№ 21 Получение гидроксида алюминия и цинка: исследование их свойств Получение и исследование свойств оксидов серы, углерода и фосфора |
45 |
|
Практическая№ 22 Получение и исследование свойств оксидов серы, углерода и фосфора |
47 |
|
2.13 Химия в жизни общества Практическая№ 23. Ознакомление с коллекцией удобрений и пестицидов
|
48 |
|
Практическая№ 24. Ознакомление с образцами средств бытовой химии и лекарственных препаратов. |
50 |
|
Критерии оценивания лабораторных работ |
52 |
|
Как оформить отчёт по лабораторной работе |
53 |
|
|
|
Введение
Цель методических рекомендаций по выполнению практических работ по учебной дисциплине «Химия»:
организация выполнения студентами практических работ;
формирование и закрепление навыков работы с лабораторным оборудованием
формирование навыков самостоятельной работы студентов со справочной литературой;
развитие внимательности и аккуратности при выполнении практических работ;
формирование общеучебных и общепрофессиональных компетенций студентов.
Учебная дисциплина «Химия» направлена на формирование общих компетенций.
Требования к знаниям и умениям при выполнении практических работ студентами
Умения:
проводить наблюдения, планировать и выполнять эксперименты, выдвигать гипотезы и строить модели, применять полученные знания по физике для объяснения разнообразных физических явлений и свойств веществ; практического использования физических знаний; оценивать достоверность естественно-научной информации;
Знания:
О фундаментальных физических законах и принципах, лежащих в основе современной физической картины мира; наиболее важных открытиях в области физики, оказавших определяющее влияние на развитие техники и технологии; методах научного познания природы;
Развитие познавательных интересов, интеллектуальных и творческих способностей в процессе приобретения знаний и умений по физике с использованием различных источников информации и современных информационных технологий;
Воспитание убежденности в возможности познания законов природы; использования достижений физики на благо развития человеческой цивилизации; необходимости сотрудничества в процессе совместного выполнения задач, уважительного отношения к мнению оппонента при обсуждении проблем естественнонаучного содержания; готовности к морально-этической оценке использования научных достижений, чувства ответственности за защиту окружающей среды;использование приобретенных знаний и умений для решения практических задач повседневной жизни.
Требования к выполнению лабораторных работ:
Студент должен выполнять лабораторные работы в соответствии с изучаемыми темами.
Каждый студент после выполнения работы должен представить отчет о проделанной работе с анализом полученных результатов и выводом по работе.
Отчет о проделанной работе следует делать в рабочих тетрадях, аккуратно оформленным. С соблюдением основных правил выполнения схем, рисунков, графиков, таблиц. Содержание отчета указано в описании лабораторной работы.
Таблицы и рисунки следует выполнять с помощью чертежных инструментов (линейки, циркуля и т. д.) карандашом
Расчет следует проводить с точностью до двух значащих цифр.
Вспомогательные расчеты можно выполнить на отдельных листах, а при необходимости на листах отчета.
Критерий оценки лабораторной работы
Оценку по лабораторной работе студент получает, с учетом срока выполнения работы, если:
расчеты выполнены правильно и в полном объеме;
сделан анализ проделанной работы и вывод по результатам работы;
студент может пояснить выполнение любого этапа работы;
отчет выполнен в соответствии с требованиями к выполнению лабораторной работы. правильные ответы на контрольные вопросы к каждой работе.
Предложенные в пособии задания учитывают общую направленность образовательного процесса на достижение личностных, метапредметных и предметных результатов обучения.
Настоящие методические указания содержат практические работы, которые позволят обучающимся закрепить теорию по наиболее сложным разделам курса и направлены на формирование следующих компетенций:
ОК 01. Выбирать способы решения задач профессиональной деятельности, применительно к различным контекстам.
ОК 02. Осуществлять поиск, анализ и интерпретацию информации, необходимой для выполнения задач профессиональной деятельности.
ОК 03. Планировать и реализовывать собственное профессиональное и личностное развитие.
ОК 04. Работать в коллективе и команде, эффективно взаимодействовать с коллегами, руководством, клиентами.
ОК 06. Проявлять гражданско-патриотическую позицию, демонстрировать осознанное поведение на основе традиционных общечеловеческих ценностей.
ОК 07. Содействовать сохранению окружающей среды, ресурсосбережению, эффективно действовать в чрезвычайных ситуациях.
ОК 09. Использовать информационные технологии в профессиональной деятельности.
ОК 11. Планировать предпринимательскую деятельность в профессиональной сфере.
Методические рекомендации по выполнению практических работ по общеобразовательной дисциплине «Химия» направлены на достижение следующих результатов обучения:
- использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов с которыми возникает необходимость сталкиваться в профессиональной сфере;
- использование различных источников для получения химической информации, умение оценивать её достоверность для достижения хороших результатов в профессиональной сфере;
- понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
- владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
- владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
- сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
- владение правилами техники безопасности при использовании химических веществ.
Практические работы предназначены для обобщения, углубления и закрепления полученных теоретических знаний по дисциплине «Химия».
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
ПРИ ПРОВЕДЕНИИ ПРАКТИЧЕСКИХ РАБОТ
При работе в химической лаборатории существуют общие правила, которые необходимо строго соблюдать.
1. Перед каждой лабораторной работой следует изучить по учебнику относящийся к ней теоретический материал. Тогда лабораторные занятия будут полезными и продуктивными.
2. Начинать опыты, только внимательно прочитав полное описание работы и уяснив технику ее выполнения.
3. Все лабораторные работы выполнять индивидуально или парами по указанию преподавателя.
4. Приступать к выполнению задания только после разрешения преподавателя.
5. Внимательно прочесть надпись на этикетке, прежде чем взять вещество.
6. Не брать реактивы в большем количестве, чем требуется для опыта.
7. Опыт производить всегда в чистой посуде.
8. Нельзя выливать избыток реактива из пробирки обратно в реактивную склянку.
9. Не следует путать пробки от разных склянок, а также пипетки для взятия реактивов. Чтобы внутренняя сторона пробки оставалась чистой, пробку кладут на стол внешней поверхностью.
10. Не уносить реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место немедленно после использования.
11. Все работы с вредными веществами проводить только под тягой. Под тягой наливать концентрированные кислоты и щелочи и не переносить их на рабочее место.
12. Все опыты, сопровождающиеся выделением ядовитых летучих и дурно пахнущих веществ, проводить только в вытяжном шкафу.
13. Нагревая пробирки, не держать их отверстием к себе или в сторону находящихся рядом товарищей.
14. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
15. Реактивы не пробовать на вкус.
16. При работе с газоотводной трубкой убирать спиртовку из-под пробирки с реакционной смесью нужно лишь тогда, когда конец газоотводной трубки, опущенный в жидкость, удален из нее. В противном случае жидкость засосет в реакционную пробирку, и может произойти растрескивание пробирки.
17. Осторожно пользоваться спиртовками. Спиртовку нельзя зажигать, наклоняя ее к другой горящей спиртовке. Чтобы погасить спиртовку следует накрыть ее сверху колпачком.
18. Реактивы не брать руками. После окончания эксперимента руки тщательно вымыть.
19. Не загромождать свое рабочее место лишними предметами, содержать рабочее место в чистоте.
ПЕРВАЯ ПОМОЩЬ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
В лаборатории бывают случаи, требующие неотложной медицинской помощи, – порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо немедленно обратиться к врачу.
Для оказания первой помощи в лаборатории имеется аптечка.
Основные правила первой помощи сводятся к следующему:
1. При ранении стеклом удалите осколки из раны, смажьте рану раствором иода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо раствором соды (в случае ожога кислотой), либо разбавленной уксусной кислотой (в случае ожога щелочью), а затем опять водой.
3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог питьевой содой и забинтовать.
4. При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды, а затем промыть разбавленным раствором питьевой соды (при попадании кислоты) или 1 % раствором борной кислоты (при попадании щелочи).
После ознакомления с правилами техники безопасности при работе в химической лаборатории каждый учащийся должен расписаться в журнале по технике безопасности.
Раздел 1
Практическое занятие №1
Обнаружение углерода и водорода в органических соединениях. Обнаружение галогенов (Проба Бельштейна)
Цели работы:
Провести реакции, подтверждающие наличие углерода и водорода в органических веществах.
Провести реакции, подтверждающие наличие галогенов в органических веществах
Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: вещества молекулярного строения, органические вещества, углеводороды;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Реактивы:
Сахарный песок, хлеб, оксид меди (II), известковая вода, парафин, медный купорос, хлорэтан, медная пластина.
Оборудование:
Асбестовая сетка, сухое горючее, спички, ложечка для сжигания вещества, пробирки, штатив.
Ход работы:
Опыт 1. Определение углерода пробой на обугливание и на выделение копоти при горении.
На ложечку для сжигания вещества положите кусочек хлеба и нагрейте над пламенем. Обуглившаяся масса черного хлеба – углерод.
На ложечку для сжигания вещества положите кусочек парафина, внесите в пламя. Копоть, выделяющаяся при горении – углерод. Запишите наблюдения.
Опыт 2. Определение углерода и водорода сожжением вещества с оксидом меди (II).
Приготовьте смесь из хорошо растертого сахара и порошкообразного оксида меди (II), взятого в избытке. Поместите смесь в пробирку слоем 0,5 см. У отверстия пробирки поместите рыхлый комочек ваты с нанесённым на него безводным сульфатом меди. Вставьте в пробирку пробку с газоотводной трубкой, конец которой опустите в другую пробирку с известковой водой (5мл). Прибор укрепите в штативе, и подогрейте смесь в пробирке. Когда вы придете к заключению, что реакция закончилась, выньте из известковой воды конец газоотводной трубки и после этого прекратите нагревание.
Дайте прибору остыть, после чего разберите его и рассмотрите результаты реакции, отметив, произошли ли изменения с сахаром, оксидом меди и с известковой водой? Опишите и объясните причину этих изменений. Составьте уравнения реакции. Сделайте вывод, свидетельствуют ли прошедшие реакции о том, что в состав сахара входят углерод и водород и почему.
По ходу работы заполните таблицу и сделайте выводы.
Опыт 3. Определение хлора пробой Бельштейна.
Прокалите медную пластину до получения черного налета оксида меди (II), затем внесите её в пробирку с хлорэтаном и вновь поместите образец в пламя. Пламя окрасится в сине-зелёный цвет. Опишите и объясните причину этих изменений. Составьте уравнения реакции. Сделайте вывод.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
Решить задачу на вывод химической формулы вещества (вариант задания получить у преподавателя)
1. Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода.
2. Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида
3. Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения.
4. Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров вещества по воздуху равна 2.
5. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
6. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие № 2
Получение метана и изучение его свойств: горения, отношения к бромной воде и раствору перманганата калия
Цели работы:
1. Получить метан в лабораторных условиях.
2. Провести опыты, подтверждающие химические свойства метана.
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: предельные углеводороды, органические вещества, алканы;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Реактивы:
Обезвоженный ацетат натрия, гидроксид натрия, гидроксид кальция, раствор перманганата калия, бромная вода.
Оборудование:
Асбестовая сетка, сухое горючее, спички, Штатив, пробирки, держатель, пробка с газоотводной трубкой
Ход работы:
Примечание: Оба опыта нужно проводить друг за другом быстро, не прекращая нагревания.
Опыт 1. Получение метана.
В сухую пробирку, снабженную пробкой с газоотводной трубкой, поместить смесь из обезвоженного ацетата натрия и натронной извести (смесь NaOH + Ca(OH)2). Укрепить пробирку в зажиме штатива горизонтально и нагреть смесь в пламени горелки. Напишите уравнение получения метана.
Опыт 2. Свойства метана
2.1. Пропускание метана через раствор перманганата калия и бромной воды.
В одну пробирку налейте 1-2 мл раствора перманганата калия, в другую – столько же бромной воды. Пропустите выделяющийся метан поочередно в каждую пробирку. Почему не происходит обесцвечивание раствора? Запишите наблюдения.
2.2. Горение метана.
Поджечь выделяющийся метан у конца газоотводной трубки. Метан горит голубоватым пламенем. Запишите наблюдения. Напишите уравнение горения метана.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
5. Название и цель работы.
6. Перечень реактивов и оборудования.
7. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
8. Общий вывод по работе.
Контрольные вопросы
7. Напишите уравнение реакции хлорирования метана.
8. Напишите уравнение реакции горения пентана.
9. Запишите два изомера для гексана.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие № 3
Получение этилена дегидратацией этилового спирта. Взаимодействие этилена с бромной водой. Растворимость перманганата калия
Цели работы:
1. Получить этилен в лабораторных условиях.
2. Провести опыты, подтверждающие химические свойства этилена.
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: непредельные углеводороды, органические вещества, алканы, алкены;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Реактивы:
Этиловый спирт (90%), концентрированная серная кислота, соляная кислота, раствор перманганата калия, бромная вода.
Оборудование:
Асбестовая сетка, сухое горючее, спички, штатив, пробирки, держатель, пробка с газоотводной трубкой
Ход работы:
Примечание: Оба опыта нужно проводить друг за другом быстро, не прекращая нагревания.
Опыт 1. Получение этилена.
В одну пробирку налейте 2-3мл этилового спирта и осторожно добавьте 6-9мл концентрированной серной кислоты. Затем всыпьте немного предварительно прокаленного песка, чтобы избежать толчков жидкости при кипении. Закройте пробирку пробкой с газоотводной трубкой, закрепить в держателе и осторожно нагрейте, пропуская образовавшийся газ во вторую пробирку с разбавленным раствором перманганата калия, подкисленного серной кислотой. Какой газ выделяется при нагревании смеси этилового спирта с серной кислотой? Как изменяется цвет раствора перманганата калия? Напишите уравнение реакции получения этилена путем дегидратации этилового спирта.
Опыт 2. Свойства этилена
2.1. Пропускание этилена через раствор перманганата калия и бромной воды.
В одну пробирку налейте 1-2 мл раствора перманганата калия, в другую – столько же бромной воды. Пропустите выделяющийся этилен поочередно в каждую пробирку. Отметьте обесцвечивание растворов. Запишите наблюдения и уравнения реакций.
2.2. Горение этилена.
Поджечь выделяющийся этилен у конца газоотводной трубки. Этилен горит желтым коптящим пламенем. Запишите наблюдения, сравните пламя этилена и метана. Напишите уравнение горения этена.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
Осуществите превращения (составьте уравнения согласно схеме). Подпишите названия веществ. Формулы веществ в уравнениях представить в молекулярном и структурном виде.
С2Н6 → С2Н4 → С2Н5ОН → С2Н4
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие № 4
Сравнение пламени этилена с пламенем предельных углеводородов (метана, пропан-бутановой смеси)
Интернет-ресурс
Практическое занятие №5
Изучение свойств спиртов. Получение диэтилового эфира. Окисление спиртов различного строения хромовой смесью. Получение глицерата меди
Цели работы:
1. Изучить растворимость спиртов в воде.
2. Провести реакции окисления одноатомных спиртов.
3. Получить диэтиловый эфир.
4. Провести качественную реакцию на многоатомные спирты
5. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: одноатомные и многоатомные спирты, первичные и вторичные спирты, органические вещества, простые эфиры, реакции окисления, качественные реакции;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Реактивы:
Этиловый спирт (90%), бутиловый спирт, натрий, серная кислота,глицерин, растворы сульфата меди (II) и гидроксида натрия, хромовая смесь.
Оборудование:
Асбестовая сетка, сухое горючее, спички, штатив, пробирки, держатель, пробка с газоотводной трубкой
Ход работы:
Опыт 1. Изучение растворимости спиртов в воде.
Налейте в одну пробирку немного этилового спирта, в другую - бутилового, в третью - глицерина (обратите внимание на их вязкость). Понюхайте содержимое пробирок. Добавьте в каждую пробирку немного воды. Обратите внимание, сразу ли происходит растворение спиртов в воде. Опишите физические свойства этилового спирта и глицерина.
Опыт 2. Получение диэтилового эфира.
Налейте в пробирку 1мл этилового спирта, добавьте столько же концентрированной серной кислоты. Слегка нагрейте. Обратите внимание на специфический запах диэтилового эфира. Напишите уравнение реакции получения диэтилового эфира из этанола.
Опыт 3. Получение глицерата меди.
В пробирку поместите 2-3 капли раствора сульфата меди (II) и 4-5 капель раствора гидроксида натрия. Обратите внимание на выпадение голубого осадка гидроксида меди (II).
Добавьте в эту пробирку раствор глицерина и тщательно перемешайте. Что произошло с осадком? Как изменилась окраска раствора? Запишите наблюдения. Напишите в структурной форме уравнение реакции взаимодействия глицерина с гидроксидом меди (II) и назовите полученное вещество.
Опыт 4. Окисление спиртов хромовой смесью.
Смешайте в химическом стакане 4 мл 5%-го раствора дихромата калия, 8 мл 20%-го раствора серной кислоты. Осторожно разделите полученный раствор на 2 пробирки. В первую пробирку добавьте и 1 мл этилового спирта, во вторую – изопропилового спирта. В первой пробирке окраска сразу меняется с оранжевой на изумрудно-зеленую (появляется характерный запаха уксусного альдегида). Смесь во второй пробирке осторожно нагрейте.
Пронаблюдайте изменение цвета раствора на зеленый – вторичный спирт окисляется до кетона. Запишите уравнение реакции окисления первичного и вторичного спиртов хромовой смесью.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1) Осуществите превращения (составьте уравнения согласно схеме). Подпишите названия веществ. Формулы веществ в уравнениях представить в молекулярном и структурном виде.
С3Н8→ С3Н6 → С3Н7ОН → С3Н6
С2Н4 → С2Н5ОН → С2Н5Br → С2Н5ОН → С2Н5ОNa
2) Запишите сходство в свойствах одноатомных и многоатомных спиртов.
3) Запишите различие в окислении первичных и вторичных спиртов.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие №6
Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала», восстановление гидроксида меди(11). Взаимодействие формальдегида с гидросульфитом натрия
«Качественные реакции на альдегиды»
Цель: Изучить реакции окисления, характерные для альдегидов,
научиться проводить качественные реакции на альдегиды;
;
развивать аккуратность через оформление навыков, наблюдательность,
Оборудование: нитрат серебра, сульфат меди (II), гидроксид натрия, раствор формалина, аммиачная вода, прибор для нагревания, пробирки.
Цели работы:
1. Провести реакцию восстановления гидроксида меди (II) формальдегидом.
2. Провести реакцию восстановления серебра формальдегидом, добиваясь образования устойчивого серебряного слоя на стенках пробирки.
3. Провести реакцию взаимодействия формальдегида с гидросульфитом натрия.
4. Написать уравнения выполненных реакций.
5. Закрепить навыки работы с лабораторным оборудованием
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: альдегиды и кетоны, качественные реакции, реакции восстановления;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Правила техники безопасности:
1. Соблюдать правила пожарной безопасности при работе с сухим горючим.
2. Не пробовать реактивы на вкус.
3. Выполнять только опыты, предусмотренные работой.
4. При попадании реактивов на кожные покровы смыть большим количеством воды.
Реактивы:
Формалин, нитрат серебра (2% раствор), аммиак, вода, гидроксид натрия (10% раствор), сульфат меди (II), гидросульфит натрия.
Оборудование:
Асбестовая сетка, сухое горючее, спички, пробирки, штатив.
Ход работы:
Опыт 1. Реакция формальдегида с гидроксидом меди (II).
В пробирку поместите 5 капель формалина, затем 2 капли раствора сульфата меди (II) и 5 капель 10% раствора гидроксида натрия. Сразу начните нагревать, следя за изменениями, происходящими в пробирке. Образующийся в конце реакции красный осадок имеет состав Сu2О. Запишите наблюдения и уравнение реакции.
Опыт 2. Реакция «серебряного зеркала».
При проведении опыта строго соблюдайте последовательность добавления реактивов.
В чистую сухую пробирку поместите 2 капли 2% раствора нитрата серебра и взболтайте, чтобы он хорошо смочил стенки пробирки. Добавьте каплю концентрированного раствора аммиака. Введите 2 капли формалина. После этого, не взбалтывая содержимого, слегка подогрейте, не доводя до кипения. Наблюдайте образование на стенках пробирки блестящего слоя серебра. Реакция «серебряного зеркала» - характерная реакция на альдегиды. Запишите наблюдения. Напишите уравнение реакции восстановления серебра формалином.
Опыт 3. Взаимодействие формальдегида с гидросульфитом натрия.
В пробирку к 1 мл насыщенного раствора гидросульфита натрия прибавьте 1 мл формалина и смесь энергично взболтайте. Если необходимо, реакционную смесь охладите холодной водой. В пробирку внесите стеклянную палочку и трите ею о стенки пробирки для инициирования процесса кристаллизации. При этом выпадает кристаллический осадок гидросульфитного соединения. Составьте уравнения реакции.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Осуществите превращения (составьте уравнения согласно схеме). Подпишите названия веществ. Формулы веществ в уравнениях представить в молекулярном и структурном виде.
С2Н2 → С2Н4 → С2Н5ОН → СН3СОН
2. Для чего используют реакцию с гидросульфитом натрия?
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие № 7
. Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами. Получение изоамилового эфира уксусной кислоты
Цели работы:
1. Изучить растворимость различных карбоновых кислот в воде.
2. Сравнить взаимодействие уксусной кислоты с различными металлами.
3. Получить изоамиловый эфир уксусной кислоты.
4. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: амины, аминокислоты, белки, качественные реакции, реакции восстановления;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Реактивы:
Растворы уксусной кислоты, гидроксида натрия, бензойная кислота, масляная кислота, гранулы цинка, порошок магния, соляная кислота, оксид меди (II), концентрированная уксусная кислота, изоамиловый спирт, концентрированная серная кислота, 10% раствор карбоната натрия, полоска фильтровальной бумаги.
Оборудование:
Штатив с пробирками, держатель, стеклянная палочка, асбестовая сетка, сухое горючее, спички, химический стакан на 250 мл, пробка с трубкой, водяная баня, делительная воронка.
Ход работы:
Опыт 1. Растворимость различных карбоновых кислот в воде.
В три пробирки с водой добавьте разные карбоновые кислоты. В первую - уксусную, во вторую - бензойную, в третью – масляную, в четвертую – стеариновую. Содержимое пробирок перемешайте. Уксусная и масляная кислоты хорошо растворяются в воде, бензойная и стеариновая кислоты в воде не растворились. Пробирки с не растворившимися кислотами нагрейте. Наблюдайте растворение бензойной кислоты. Стеариновая кислота в воде не растворяется. Добавьте в каждую пробирку раствор лакмуса. В пробирках с какими кислотами изменилась окраска индикатора? После охлаждения пробирки с бензойной кислотой осадок вновь выпадает. Прибавьте к осадку немного раствора гидроксида натрия. Наблюдайте вновь растворение осадка. Напишите уравнение реакции.
Объясните различие растворимости различных карбоновых кислот.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
В две пробирки налейте по 2 мл раствора уксусной кислоты. В одну из них поместите гранулу цинка, а в другую насыпьте 1/5 ложки порошка магния. Что наблюдаете? В какой пробирке реакция идет быстрее? С чем это связано? Напишите уравнение реакции в молекулярном и ионном виде.
Сделайте вывод о реакции металлов, в зависимости от их положения в ряду напряжений.
Опыт 3. Получение изоамилового эфира уксусной кислоты.
Смешайте в пробирке 3мл уксусной кислоты, 5мл изоамилового спирта и 2мл концентрированной серной кислоты. Нагрейте смесь на кипящей водяной бане в течение 20минут. После охлаждения вылейте содержимое в стакан с холодной водой, отделите эфир с помощью делительной воронки, промойте его раствором соды. Познакомьтесь с запахом сложного эфира, смочив полоску фильтровальной бумаги каплей эфира. Напишите уравнение реакции получения сложного эфира. По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие №8
Сравнение степени ненасыщенности твердого и жидкого жиров. Омыление жира
Цели работы:
1. Сравнить степени ненасыщенности твердого и жидкого жиров.
2. Провести процесс омыления твердого жира.
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: жиры, предельные и непредельные кислоты, высшие карбоновые кислоты, эфиры;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
-------------------
Реактивы:
15%-ный спиртовой раствор гидроксида натрия, раствор хлорида натрия, растительное масло, твердый жир, этиловый эфир, бромная вода.
Оборудование:
Штатив с пробирками, держатель, стеклянная палочка, асбестовая сетка, сухое горючее, спички, химический стакан, колба, бюретка, водяная баня, обратный холодильник, фильтровальная бумага, твердый жир.
Ход работы:
Опыт 1. Сравнение степени ненасыщенности твердого и жидкого жиров.
В одну пробирку вносят несколько капель растительного масла, в другую - расплавленного жира. В обе пробирки прибавляют несколько капель этилового эфира до растворения жира, а затем приливают из бюретки бромную воду до тех пор, пока не появится устойчивая желтая окраска, тщательно взбалтывая содержимое пробирок. Определите количество израсходованной бромной воды для твердого и жидкого жира. Объясните результаты опыта. Напишите уравнения реакций.
Опыт 2. Омыление жира.
В колбу поместите 3-4 г измельчённого жира и прилейте 10 мл спиртового раствора гидроксида натрия. Перемешайте смесь стеклянной палочкой, колбу со смесью закройте обратным холодильником, опустите в водяную баню, закрепив лапкой в штативе, и нагревайте 15-20 минут до кипения. Омыление ведите до тех пор, пока жидкость не станет однородной.
Для определения конца омыления можно налить несколько капель полученной смеси в пробирку, добавить 5-6 мл воды и нагреть раствор. Если взятая смесь растворяется в воде без выделения капель жира, омыление можно считать законченным. Если в растворе есть капли жира, то смесь надо нагревать еще несколько минут.
Полученную густую жидкость перелейте в стакан и добавьте при перемешивании насыщенный раствор поваренной соли. При этом должен выделиться слой мыла, всплывающий на поверхность. Дайте смеси отстояться, охладите её водой, полученное мыло извлеките на фильтровальную бумагу и просушите.
По ходу работы заполните таблицу, запишите уравнения реакций и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Какие кислоты входят в состав растительных жиров?
2. Какие кислоты входят в состав животных жиров?
3. Приведите примеры твердого растительного и жидкого животного жиров.
4. Для каких целей применяют жиры?
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие №9.
Получение мыла и изучение его свойств: пенообразования, реакций ионного обмена, гидролиза, выделения свободных жирных кислот
Цели работы:
1. Изучить свойства мыла.
2. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: жиры, высшие карбоновые кислоты, мыла;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
--------------------------------------
Реактивы:
Этиловый спирт, раствор соляной кислоты, дистиллированная вода, хлорид кальция, поваренная соль, фенолфталеин, вода.
Оборудование:
Штатив с пробирками, держатель, асбестовая сетка, сухое горючее, спички, химический стакан, колба, капиллярная трубка, стеклянная палочка.
Ход работы:
Опыт 1. Растворимость мыла в различных растворителях.
В две пробирки поместите по стружке мыла. В одну добавьте 10 капель воды, в другую – 10 капель этилового спирта. Хорошо взболтайте. Что можно сказать о растворимости мыла?
Опыт 2. Гидролиз мыла.
В каждую пробирку из предыдущего опыта добавьте 2-3 капли фенолфталеина. Как изменилась окраска раствора? Почему? Запишите уравнение реакции гидролиза мыла в молекулярном и ионном виде.
Опыт 3. Выделение свободных жирных кислот.
К 5 мл подогретого гомогенного раствора мыла осторожно добавьте порциями раствор соляной кислоты до выделения свободных жирных кислот, которые всплывают на поверхность жидкости. Запишите уравнение реакции взаимодействия мыла с соляной кислотой в молекулярном и ионном виде.
Опыт 4. Реакции ионного обмена.
В гомогенный раствор мыла с водой добавьте раствор хлорида кальция. Что наблюдаете? Запишите уравнение реакции взаимодействия мыла с хлоридом кальция в молекулярном и ионном виде.
Опыт 5. Пенообразование мыла.
Налейте в колбу 15 мл воды и через капиллярную трубку продувайте воздух. Повторите опыт, заменив воду раствором мыла.
В каком случае образуется пена?
По ходу работы заполните таблицу, запишите уравнения реакций и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Почему мыло сушит кожу?
2. Почему при растворении мыла в воде образуются хлопья?
3. Почему в жёсткой воде количество хлопьев увеличивается?
4. Если на раствор мыла подействовать серной кислотой, то на поверхность всплывает твердое нерастворимое в воде вещество. Составьте уравнение реакции, назовите это вещество.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие №10.
Реакция «серебряного зеркала» глюкозы, взаимодействие глюкозы с гидроксидом меди (11) при различных температурах. Действие аммиачного раствора оксида серебра на сахарозу.
Цели работы:
1. Провести реакцию серебряного зеркала глюкозой.
2. Доказать экспериментально, что глюкоза обладает свойствами многоатомного спирта и альдегида.
3. Исследовать действие аммиачного раствора оксида серебра на сахарозу.
4. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: функциональные группы, качественные реакции, реакции восстановления, моносахариды, олигосахариды;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
-------------------------------
Реактивы:
10% раствор глюкозы, сахароза, раствор гидроксида натрия, раствор сульфата меди (II), серная кислота, вода, нитрат серебра (2% раствор), аммиак.
Оборудование:
Асбестовая сетка, сухое горючее, спички, пробирки, штатив.
Ход работы:
Опыт 1. Реакция «серебряного зеркала» глюкозы.
При проведении опыта строго соблюдайте последовательность добавления реактивов.
В чистую сухую пробирку поместите 2 капли 2% раствора нитрата серебра и взболтайте, чтобы он хорошо смочил стенки пробирки. Добавьте каплю концентрированного раствора аммиака. Введите 2 капли глюкозы. После этого, не взбалтывая содержимого, слегка подогрейте, не доводя до кипения. Наблюдайте образование на стенках пробирки блестящего слоя серебра. Реакция «серебряного зеркала» - характерная реакция на альдегидную группу. Запишите наблюдения. Напишите уравнение реакции восстановления серебра глюкозой.
Опыт 2. Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах.
2.1. Обнаружение у глюкозы свойств многоатомного спирта.
Поместите в пробирку 1 мл раствора щелочи (гидроксида натрия) и 2 мл раствора сульфата меди (II). Встряхните содержимое пробирки до образования осадка. Добавьте каплю, глюкозы и тщательно перемешайте. Обратите внимание на образование раствора синего цвета, что является характерным для многоатомных спиртов. Запишите наблюдения. Напишите уравнение реакции глюкозы с гидроксидом меди (II). Подпишите названия веществ.
2.2. Обнаружение у глюкозы свойств альдегидов.
Пробирку с содержимым из первого опыта нагревайте осторожно, следя за последовательными изменениями, происходящими с осадком. Образующийся в конце реакции красный осадок имеет состав Cu2O. Данная реакция характерна для альдегидов. Запишите наблюдения. Напишите уравнение реакции восстановления гидроксида меди (II) глюкозой. Подпишите названия веществ.
Опыт 3. Действие аммиачного раствора оксида серебра на сахарозу.
В пробирку налейте1 мл раствора сахарозы,1 мл аммиачного раствора оксида серебра и нагрейте пробирку. Ничего не происходит, реакция не идет, т.к. сахарозу образуют циклические формы глюкозы и фруктозы, а они не дают реакцию серебряного зеркала. Почему?
В другую пробирку налейте1 мл раствора сахарозы и 2-3 капли разбавленной серной кислоты. Пробирку нагревайте в течение 30 секунд. Затем, добавляя в пробирку раствор гидроксида натрия, доведите раствор до слабощелочной среды (индикатор - лакмусовая бумага). К полученному раствору добавьте 2 мл аммиачного раствора оксида серебра и опять нагрейте пробирку. Наблюдайте образование на стенках пробирки блестящего слоя серебра. Это объясняется тем, что при нагревании раствора серной кислоты с раствором сахарозы протекает реакция гидролиза. Напишите уравнение реакции гидролиза
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Глюкоза содержит гидроксильную и альдегидную группы. К каким классам органических веществ можно ее отнести?
2. Глюкоза способна подвергаться различным видам брожения. Напишите уравнения реакций.
3. К какому классу углеводов относится сахароза?
4. Укажите области применения сахарозы.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие № 11
Обнаружение лактозы в молоке. Действие йода на крахмал.
Цели работы:
1. Обнаружить лактозу в молоке.
2. Исследовать растворимость крахмала в воде, провести качественную реакцию на крахмал
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: функциональные группы, качественные реакции, реакции восстановления, моносахариды, олигосахариды, полисахариды;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
-----------------------------------------------
Реактивы:
Крахмал, вода, спиртовой раствор йода, молоко, раствор уксусной кислоты, реактив Фелинга.
Оборудование:
Асбестовая сетка, сухое горючее, спички, пробирки, штатив, воронка, фильтровальная бумага, химический стакан.
Ход работы:
Опыт 1. Обнаружение лактозы в молоке.
В небольшой химический стакан налейте 5-7 мл молока, разбавленного водой (1:1), добавьте к нему несколько капель уксусной кислоты при перемешивании смеси стеклянной палочкой. В кислой среде белок свертывается и выпадает в виде хлопьев. Осадок отфильтруйте и отбросьте, а фильтрат нейтрализуйте, добавляя по каплям при перемешивании стеклянной палочкой раствор гидроксида натрия до слабощелочной реакции по индикаторной бумажке. Отлейте 2 мл полученного щелочного раствора, добавьте к нему 2 мл реактива Фелинга, смесь перемешайте и нагрейте верхнюю часть раствора до начинающегося кипения. Меняется ли окраска раствора? Объясните ход реакции. Запишите наблюдения. Напишите уравнение реакции гидролиза лактозы, реакцию восстановления галактозы.
Опыт 2. Свойства крахмала.
2.1. Растворение крахмала в воде.
Насыпьте в пробирку немного крахмала, добавьте 2 мл холодной воды и хорошо взболтайте. Обратите внимание, что крахмал не растворяется в холодной воде. Налейте в другую пробирку 5 мл воды и нагрейте до кипения. Влейте в пробирку с кипятком содержимое первой пробирки. Обратите внимание на образование вязкого раствора – клейстера. Опишите растворимость крахмала в холодной и горячей воде.
2.2. Качественная реакция на крахмал.
В пробирку с охлажденным клейстером добавьте каплю сильно разбавленной йодной воды. Обратите внимание на изменение окраски раствора. При нагревании полученного раствора синее окрашивание исчезает. Укажите характерный признак качественной реакции на крахмал.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Как объяснить наличие восстанавливающих свойств у лактозы?
2. Почему при нагревании исчезает синее окрашивание?
3. Напишите реакцию гидролиза крахмала.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие №12
Образование солей анилина. Бромирование анилина. Образование солей глицина. Получение медной соли глицина. Денатурация белка. Цветные реакции белка
Цели работы:
1. Овладение навыками проведения химических опытов, подтверждающих свойства анилина.
2. Показать особые свойства аминокислот на примере раствора глицина.
3. Провести реакции, подтверждающие свойства белков.
4. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: амины, аминокислоты, белки, качественные реакции, реакции восстановления;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
-----------------------------------------------
Реактивы:
Раствор глицина, анилин, дистиллированная вода, гидроксид натрия, соляная кислота, бромная вода, оксид меди (II),раствор белка, сульфат меди, концентрированная азотная кислота, аммиак.
Оборудование:
Штатив с пробирками, держатель, стеклянная палочка, асбестовая сетка, сухое горючее, спички, шпатель.
Ход работы:
Опыт 1. Образование солей анилина.
В пробирку налейте 1 мл анилина и 4 мл воды. Взболтайте. Пронаблюдайте образование капель анилина. Объясните данное явление. С помощью универсальной индикаторной бумаги определите среду раствора анилина. В пробирку добавьте соляной кислоты до полного растворения анилина и изменения окраски индикатора. Почему при добавлении соляной кислоты происходит растворение анилина? Напишите уравнение реакции.
К раствору добавьте раствор щелочи до появления капель анилина. Почему при добавлении щелочи анилин выделяется из водного раствора? Напишите уравнение реакции.
Опыт 2. Бромирование анилина.
Стеклянную палочку смочите в анилине и опустите в пробирку с 3 мл воды. Хорошо встряхните пробирку и убедитесь, что эмульсия практически отсутствует. Прибавьте по каплям к содержимому пробирки бромную воду до появления осадка.
Каково строение образующегося осадка? Напишите уравнение реакции.
Опыт 3. Образование солей глицина.
В 2 пробирки налейте по 1-2 мл раствора глицина и добавьте в одну пробирку раствор гидроксида натрия, а в другую – раствор соляной кислоты. Что наблюдаете?
Опыт 4. Получение медной соли глицина.
В пробирку с 2 мл раствора глицина добавьте на кончике шпателя порошок оксида меди (II). Пробирку осторожно нагрейте до кипения. Наблюдайте окрашивание раствора в ярко-синий цвет?
Составьте уравнения реакций.
Опыт 5. Денатурация белка.
Белок куриного яйца растворите в 150 мл воды. В три пробирки поместите по 2 мл раствора белка. В первую пробирку добавьте немного раствора сульфата меди (II), во вторую – раствор серной кислоты, третью нагрейте. Объясните наблюдаемые явления.
Опыт 6. Цветные реакции белков.
Ксантопротеиновая реакция.
В пробирку налейте 2-3 мл раствора белка, добавьте 2 мл концентрированной азотной кислоты. Какого цвета выпал осадок? Пробирку нагрейте. Смесь охладите, и добавьте по каплям аммиак до изменения окраски в ярко-оранжевую.
Биуретовая реакция.
В пробирку налейте2-3 мл раствора белка, добавьте 2-3 мл гидроксида натрия и сульфата меди (II). Содержимое пробирки окрасится в красно-фиолетовый цвет.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Напишите формулу анилина.
2. Перечислите основные свойства анилина.
3. Почему амины называют органическими основаниями?
4. Почему аминокислоты являются гетерофункциональными соединениями?
5. Какими свойствами обладают аминокислоты?
6. Какие физические свойства характерны для аминокислот?
7. Какой состав имеет молекула белка?
8. Какие цветные реакции доказывают наличие белка?
9. Что называют первичной структурой белка? Как она образуется?
10. С помощью каких связей образуется вторичная и третичная структуры белка?
11. Что такое денатурация? Какие вещества и явления приводят к денатурации белка? Почему?
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие № 13
Обнаружение витамина А в подсолнечном масле. Обнаружение витамина С в яблочном соке. Определение витамина Д в рыбьем жире или курином желтке
Цели работы:
1. Провести реакции обнаружения водорастворимого витамина С во фруктовых соках при помощи качественных реакций.
2. провести реакции обнаружения жирорастворимых витаминов А и D в различных продуктах питания при помощи качественных реакций, основанных на цветных реакциях, характерных для той или иной группировки, входящей в витамин.
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: витамины, аминокислоты, белки, качественные реакции, классификация витаминов;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
-----------------------------------------
Реактивы:
Яблочный, апельсиновый, лимонный соки, рыбий жир, подсолнечное масло, облепиховое масло, крахмал, 1%-ный раствор FeCl3, 5% раствор йода, раствор брома, этанол, раствор гидроксида натрия.
Оборудование:
Штатив, пробирки, держатель, горелка, сухое горючее, спички, стеклянная палочка.
Ход работы:
Опыт 1. Определение витамина А в подсолнечном масле.
В 1 пробирку налейте 1мл подсолнечного масла, в другую – 1мл облепихового масла. Добавьте в каждую пробирку по 2-3 капли 1%-ного раствора FeCl3. При наличии витамина А появится ярко – зеленое окрашивание. Сравните результаты в двух пробирках и сделайте выводы.
Опыт 2. Определение витамина D в рыбьем жире.
В пробирку с 1 мл рыбьего жира прилейте 1мл раствора брома. При наличии витамина D появляется зеленовато-голубое окрашивание. Обоснуйте результат опыта.
Опыт 3. Определение витамина С во фруктовых соках.
Налейте в 3 пробирки по 2мл яблочного, апельсинового, лимонного сока и добавьте воды 8мл. Приготовьте крахмальный клейстер (1 г крахмала на стакан воды) и добавьте в каждую пробирку. Далее по каплям добавляйте 5%-ный раствор йода до появления устойчивого синего окрашивания, не исчезающего 10-15 с. Техника определения основана на том, что молекулы аскорбиновой кислоты легко окисляются йодом. Как только йод окислит всю аскорбиновую кислоту, следующая капля окрасит раствор в синий цвет. Сравните результаты, сделайте выводы о содержании витамина С в различных соках.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Как классифицируют витамины?
2. Как взаимосвязаны кулинарная обработка плодов, овощей и сохранность витаминов в них?
3. Что такое гиповитаминозы, авитаминозы, гипервитаминозы.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие № 14
Действие амилазы слюны на крахмал. Действие дегидрогеназы на метиленовый синий. Действие каталазы на пероксид водорода
Цели работы:
1. Определить действие амилазы на крахмал.
2. Провести каталитическую реакцию для пероксида водорода под действием каталазы.
3. Определить действие дегидрогеназы на метиленовый синий.
4. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: ферменты, качественные реакции;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
------------------------------------------
Реактивы:
Раствор крахмала, раствор фермента, вода, спиртовой раствор йода, кусочки мяса, картофеля, пероксид водорода, молоко.
Оборудование:
Штатив, пробирки, держатель, горелка, сухое горючее, спички, стеклянная палочка, стеклянные стаканы пипетки, предметные стекла, мерный цилиндр, резиновая груша, стеклянная трубка.
Ход работы:
Опыт 1. Действие амилазы слюны на крахмал.
Предварительно прополоскав рот, наберите 2-4 мл слюны и поместите в маленький мерный цилиндр. В цилиндр добавьте воды, доведя объем до 10 мл.
Смешайте 5 мл раствора крахмала с 1 мл раствора фермента в маленькой мензурке. Через 30 с после перемешивания возьмите каплю полученного раствора и проверьте ее на содержание крахмала, перемешав с каплей раствора йода на предметном стекле. Если крахмал еще присутствует, то необходимо проверять раствор через каждые 30 с до тех пор, пока крахмал перестанет обнаруживаться. Запишите общее время, необходимое для полного гидролиза крахмала. Запишите уравнение реакции гидролиза крахмала.
Вновь смешайте 5 мл раствора крахмала с 1 мл раствора фермента и разделите полученный раствор поровну в 2 пробирки. Одну из пробирок поместите в стаканчик с теплой водой (≈35-40 С). Каждые 30 с отбирайте по 1 капле смеси растворов из каждой пробирки и смешивайте на предметном стекле с каплей йода до тех пор, пока крахмал перестанет обнаруживаться. Запишите в каждом случае общее время, необходимое для гидролиза крахмала. Сделайте вывод об эффективности амилазы при различных температурах.
Опыт 2. Действие дегидрогеназы на метиленовый синий (стиральная синька)
Небольшое количество аптечного формалина (с учетом его исходной концентрации) разведите водой до получения 0,5%-ного раствора формальдегида.
В 2 пробирки налейте по 5 мл некипяченого молока, добавьте по 15 капель 0,5%-ного раствора формальдегида и по несколько капель раствора метиленового синего. Наблюдайте, что краситель постепенно бледнеет и в конце концов обесцвечивается. Это объясняется тем, что благодаря содержащейся в молоке дегидрогеназе атомы водорода формальдегида присоединятся к молекуле красителя.
В каждую пробирку добавьте немного растительного масла, чтобы изолировать полученную смесь от воздуха и предотвратить окисления красителя.
Одну пробирку поставьте в пустой стаканчик, а другую в стаканчик с теплой водой (≈35-40 0С). Наблюдайте, что в пробирке, помещенной в воду, краситель обесцвечивается быстрее, чем в первой (т.к. наиболее эффективна дегидрогеназа в условиях, близких к температуре тела млекопитающих).
С помощью резиновой груши и стеклянной трубки через реакционную смесь продуйте воздух, наблюдайте восстановление цвета красителя (происходит его окисление). Сделайте выводы.
Опыт 3. Действие каталазы на перексид водорода
В 5 пробирок налейте по 2 мл раствора пероксида водорода.
В первую пробирку опустите кусочек сырого мяса. Наблюдайте выделение пузырьков газа. К отверстию пробирки поднесите тлеющую лучинку, наблюдайте вспыхивание и горение лучинки. Запишите реакцию разложения пероксида водорода.
Во вторую пробирку опустите кусочек сырого картофеля и поднесите тлеющую лучинку. Вновь наблюдайте выделение пузырьков газа и вспыхивание лучинки.
В третью пробирку опустите измельченный на терке картофель и поднесите тлеющую лучинку. Наблюдайте более интенсивное выделение газа, т. к. реакция катализируется каталазой, содержащейся в клетках не только поверхности одного куска, их стало больше (увеличилась площадь поверхности).
В четвертую и пятую пробирки опустите по кусочку вареного мяса и картофеля. Ничего не происходит, т.к. при варке ферменты разрушаются и не катализируют реакцию разложения пероксида водорода.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Запишите промежуточные формы разложения крахмала.
2. Опишите действие ферментов.
3. Дайте определение каталитической реакции. Приведите примеры.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическая работа № 15
Анализ лекарственных препаратов, производных салициловой кислоты. Анализ лекарственных препаратов, производных п-аминофенола
Цели работы:
1. Провести анализ лекарственных препаратов на растворимость в воде, этаноле, щелочи.
2. Провести качественные реакции для лекарственных препаратов.
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: эфиры,карбоновые кислоты, фенолы, качественные реакции;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
-------------------------------------------------------
Реактивы:
Салициловая кислота (о-гидроксибензойная кислота), ацетилсалициловая кислота (салициловый эфир уксусной кислоты), салол (фениловый эфир салициловой кислоты), парацетамол (n- N-ацетиламинофенол), фенацетин (1-этокси-4-ацетаминобензол);
Оборудование:
Штатив, пробирки, держатель, горелка, сухое горючее, спички, стеклянная палочка, пипетки, фарфоровая ступка, пестик.
Ход работы:
Опыт 1. Анализ лекарственных препаратов, производных салициловой кислоты.
1.1. Растворимость лекарственных средств в различных растворителях. Разотрите в ступке таблетки салициловой кислоты, ацетилсалициловой кислоты и салола. Перенесите в пробирки по 0,1 г каждого лекарства (приблизительно 1/5 часть таблетки). Добавьте в каждую пробирку 2-3 мл дистиллированной воды. Визуально определите и сравните скорость растворения лекарственных препаратов в воде. Если лекарственные препараты не растворились полностью, то нагрейте пробирки с веществами до кипения. Сравните результаты в трех пробирках и сделайте выводы. Проделайте ещё раз опыт, добавив вместо воды по 2-3 мл этанола. Что наблюдаете? Нагрейте на спиртовке пробирки до полного растворения осадков. Сравните растворимость лекарственных препаратов в воде и этаноле.
1.2. Взаимодействие лекарственных препаратов с щелочами.
Взболтайте по 0,1 г каждого препарата с 2-3 мл воды и добавьте по 2-3 мл разбавленного раствора щелочи (гидроксида натрия). Изменилась ли растворимость веществ? Объясните наблюдаемые явления, напишите уравнения соответствующих реакций.
1.3. Проведение качественной реакции.
Взболтайте по 0,1 г каждого препарата с 2-3 мл воды и добавьте несколько капель раствора хлорида железа (III). Что наблюдаете? В каких пробирках произошло изменение окраски? Объясните наблюдаемое явление.
Опыт 2. Анализ лекарственных препаратов, производных n-аминофенола.
2.2. Растворимость лекарственных средств в различных растворителях
Разотрите в ступке таблетки парацетамола и фенацетина. Перенесите в пробирки по 0,1 г каждого лекарства (приблизительно 1/5 часть таблетки). Добавьте в каждую пробирку 2-3 мл воды. Визуально определите и сравните растворимость лекарственных препаратов в воде. Если лекарственные препараты не растворились полностью, то нагрейте пробирки с веществами до кипения. Обратите внимание, меняется ли растворимость лекарственных препаратов в воде в зависимости от температуры?
Внесите в пробирки по 0,1 г лекарственного препарата и добавьте в каждую по 2-3 мл этанола. Отметьте растворимость веществ в этаноле. Нагрейте пробирки до кипения. Сравните растворимость лекарственных препаратов в воде и этаноле.
2.2. Проведение качественной реакции.
Взболтайте по 0,1 г каждого препарата с 2-3 мл воды и добавьте несколько капель хлорида железа (III). Что наблюдаете? Обоснуйте наблюдаемое явление.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Напишите структурные формулы салола, салициловой кислоты, аспирина, парацетамола.
2. Опишите лекарственное действие парацетамола и аспирина.
3. Какие лекарственные препараты называют анальгетиками? На какие две группы они делятся?
4. Назовите последовательность действий при выполнении анализа лекарственных препаратов, производных салициловой кислоты.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
ПР №16.Изготовление моделей некоторых органических и неорганических веществ.
Цели работы:
1. Изготовитьи назвать модели молекул углеводородов и неорганических веществ при изучении их пространственной структуры.
2. Записать уравнения реакций
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение зависимость свойств веществ от их состава и строения;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение называть изученные вещества по номенклатуре ЮИПАК; определять принадлежность веществ к определенным классам;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
--------------------------------------------------------------------
Оборудование:
Пластилин разных цветов, зубочистки.
Ход работы:
Опыт 1. Изготовление моделей молекул предельных углеводородов.
Скатайте 4 шарика (условно изображающих атомы углерода) из пластилина одного цвета диаметром примерно 2см и 10 шариков (условно изображающих атомы водорода) из пластилина другого цвета диаметром примерно 1см.
Возьмите шарик большего размера и 4 спички, которые будут изображать связи С – Н и расположите спички так, чтобы угол между ними был равен 109°28́́ .
На свободные концы спичек прикрепите четыре шарика другого цвета. Получилась шаростержневая модель метана СН4.
Мысленно соедините центры ядер атомов водорода. Изображение какой геометрической фигуры вы получили? Зарисуйте собранную модель метана, указав на рисунке угол между связями, подпишите название геометрической фигуры.
Замените один «атом» водорода на «атом» углерода и, соблюдая расположение спичек, доделайте модель молекулы этана С2Н6. Что общего в строении этих веществ, в чём различие?
Аналогично соберите модели сначала пропана С3Н8, затем бутана С4Н10. Чем объясняется строение углеродной цепи в молекулах пропана и бутана? Зарисуйте собранную модель бутана, указав на рисунке угол между связями, подпишите название.
Получите изомер бутана. Для этого снимите крайний «атом» углерода со спички и поменяйте его местами с «атомом» водорода у среднего шарика. Зарисуйте полученную модель изобутана, подпишите название, запишите, чем схожи и чем отличаются модели бутана и изобутана.
Разберите модель.
Опыт 2. Изготовление моделей молекул непредельных углеводородов.
Из полученного набора соберите модели молекул органических веществ: 1)этена С2Н4, 2) ацетилена С2Н2.
Зарисуйте собранные вами модели молекул органических веществ, указав на рисунке угол между связями, подпишите их, назовите геометрические фигуры.
Опыт 2. Изготовление моделей молекул органических и неорганических веществ.
Изготовьте шаростержневые модели молекул метана и четырех молекул хлора. С помощью этих моделей продемонстрируйте поэтапное замещение атомов водорода в метане на атомы хлора с образованием хлороводорода и соответствующих галогенопроизводных метана. Запишите уравнения реакций замещения всех этапов.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения |
Рисунки |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Почему при изготовлении моделей молекул требуются шарики разных размеров?
2. Какое из основных положений теории А.М.Бутлерова было использовано при работе?
3. Что понимается под химическим строением молекул?
4. Почему при изготовлении модели молекулы пропана «атомы углерода» нужно соединять под углом 1090 28¢?
5. Какой вид связи между «атомами углерода»?
6. Сформулировать положение теории строения, которое объясняет различие в свойствах изомеров.
7. Чем объясняется зигзагообразное строение углеродной цепи в молекулах пропана и бутана? Какова величина угла в зигзагообразном отрезке углеродной цепи?
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическое занятие № 17
Очистка веществ фильтрованием и дистилляцией. Очистка веществ перекристаллизацией
Цели работы:
1. Провести очистку веществ различными способами.
2. Выявить различия в физических свойствах веществ, лежащие в основе этих способов разделения смеси.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: фильтрование, дистилляция, перекристаллизация;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Задачи преподавателя:
-ознакомить обучающихся с правилами безопасного поведения и этапами практической работы;
-закрепить знания по теме «Химия – наука о веществах»;
-развить у обучающихся навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков безопасного обращения с веществами в повседневной жизни.
Реактивы:
Бихромат калия, перманганат калия, загрязненная водопроводная вода.
Оборудование:
Асбестовая сетка, сухое горючее, спички, круглодонные колбы, стаканы, воронки, штатив, ступка, холодильник, приемник, фарфоровая чашка, пробирки, термометр, фильтровальная бумага, воронка для фильтрования, стеклянная палочка.
Ход работы:
Опыт 1. Очистка загрязненной воды.
1.1. Фильтрование.
Рассмотрите выданный вам образец загрязненной воды. Определите компоненты смеси. Опишите физические свойства этих веществ. Жидкости от взвешенных нерастворимых веществ могут быть очищены путем фильтрования. Если в растворе имеется осадок, то нужно дать ему отстояться. Затем для фильтрования изготовьте фильтр и подгоните его к воронке на 3-5 мм ниже края. Смочите водой и прижмите фильтр к стенкам воронки так, чтобы под ним не было пузырьков воздуха.
Жидкость для фильтрования сливайте в воронку по стеклянной палочке, прислонив к ней носик стакана.
1.2. Дистилляция.
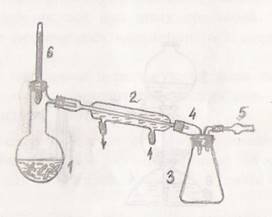 Соберите
прибор для перегонки воды (см. рисунок). В водопроводную воду добавьте немного
раствора перманганата калия и налейте в перегонную колбу Вюрца (1). Поместите в
нее длинные капиллярные трубки. Плотно закройте пробкой с вставленным в нее
термометром (6). Ртутный шарик термометра должен находиться на уровне отводной
трубки колбы. Соедините колбу с воздушным холодильником (2). Приемник (3) для
воды плотно закройте пробкой с вставленным в нее аллонжем (4) и хлоркальциевой
трубкой (5), заполненной натронной известью и соедините с холодильником.
Нагрейте воду до кипения и наблюдайте за перегонкой.
Соберите
прибор для перегонки воды (см. рисунок). В водопроводную воду добавьте немного
раствора перманганата калия и налейте в перегонную колбу Вюрца (1). Поместите в
нее длинные капиллярные трубки. Плотно закройте пробкой с вставленным в нее
термометром (6). Ртутный шарик термометра должен находиться на уровне отводной
трубки колбы. Соедините колбу с воздушным холодильником (2). Приемник (3) для
воды плотно закройте пробкой с вставленным в нее аллонжем (4) и хлоркальциевой
трубкой (5), заполненной натронной известью и соедините с холодильником.
Нагрейте воду до кипения и наблюдайте за перегонкой.
Опыт 2. Перекристаллизация бихромата калия.
Перекристаллизация – основана на различии растворимости веществ с изменением температуры.
На лабораторных химических весах взвесьте 50 г бихромата калия. Отмерьте мерным цилиндром и налейте в стакан 50 мл горячей дистиллированной воды. Нагрейте до полного растворения навески, перемешивая содержимое стакана стеклянной палочкой. Охладите раствор, часть растворенного вещества выпадет в осадок, а примеси останутся в маточном растворе, так как по отношению к ним раствор не будет насыщен. Таким образом, очищаемое вещество освобождается от примесей.
Отфильтруйте через складчатый фильтр, вложенный в воронку с короткой трубкой. Фильтрат соберите в стакан, поставленный в кристаллизатор с холодной водой, и хорошо перемешайте в течение 10 мин стеклянной палочкой.
Выделившиеся кристаллы еще раз отфильтруйте. Все образовавшиеся кристаллы вытряхните на сложенный вдвое лист фильтровальной бумаги. Стеклянной палочкой распределите кристаллы ровным слоем, накройте другим листом сложенным вдвое, и отжимают кристаллы между листами. Если бумага стала мокрой, возьмите новые листы и снова отжимайте кристаллы до тех пор, пока бумага не перестанет увлажняться. Кристаллы «перебирайте» стеклянной палочкой, и если они не пристают к ней или полностью отстают от нее при легком встряхивании, то высушивание можно считать законченным. Кристаллы оставляют на воздухе еще на полчаса, распределив их тонким слоем на листе фильтровальной бумаги. Взвесьте получившиеся кристаллы.
По ходу работы заполните таблицу и сделайте выводы.
Опыт 3. Определение хлора пробой Бельштейна.
Содержание отчета:
9. Название и цель работы.
10. Перечень реактивов и оборудования.
11. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
12. Общий вывод по работе.
Контрольные вопросы
1. Для чего используется перегонка?
2. Какие виды перегонки вы знаете?
3. Из чего состоит прибор для перегонки?
4. Методы очистки твердых веществ.
5. Что такое насыщенный раствор?
6. Как рассчитывается выход продукта?
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическая работа № 18
Приготовление растворов различных видов концентрации
Цели работы:
1. Приготовить раствор заданной концентрации.
2. Вычислить массу вещества и воды, необходимых для приготовления раствора заданной массовой доли вещества.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-подготовка раствора заданной концентрации в быту и на производстве;
-умение давать определение и оперировать следующими химическими понятиями: вещества молекулярного и немолекулярного строения, растворы;
- решение расчетных задач по химическим формулам и уравнениям.
Задачи преподавателя:
-ознакомить обучающихся с правилами безопасного поведения и этапами практической работы;
-ознакомить обучающихся с видами растворов, способами их приготовления и способами выражения состава раствора;;
-развить у обучающихся навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков безопасного обращения с веществами в повседневной жизни.
Реактивы:
Хлорид натрия, вода.
Оборудование:
Весы, разновесы, стеклянный цилиндр, колба.
Ход работы:
Опыт 1. Приготовление раствора соли с определенной массовой долей вещества.
1. Получите у преподавателя задание. Вычислите, сколько соли и воды потребуется для приготовления указанного раствора с заданной массовой долей вещества. В расчетах используйте формулы
m(в-ва)
w= ------------ * 100% ;m(р-ра) = m(в-ва) + m(Н2О);
m(р-ра)
2. Отвесьте на весах соль и поместите её в колбу.
3. Отмерьте требуемый объем воды (при помощи стеклянного цилиндра) и вылейте её в колбу с солью. Содержимое колбы перемешайте до полного растворения соли.
Содержание отчета:
13. Название и цель работы.
14. Перечень реактивов и оборудования.
15. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
16. Общий вывод по работе.
Контрольные вопросы
Решить задачу на определение массовой доли растворенного вещества (вариант задания получить у преподавателя).
1. Определите массовую долю хлорида натрия в растворе, полученном при растворении соли массой 20г в воде массой 300г.
2. Определите, сколько граммов гидроксида натрия содержится в растворе массой 250г массовой долей растворённого вещества 20%. Определите, сколько граммов гидроксида калия содержится в растворе объёмом 200мл с массовой долей КОН 10%, плотность которого равна 1,09г/мл.
3. К 300мл гидроксида калия с массовой долей КОН 20% (плотность 1,2 г/мл) прибавили КОН массой 40г. Определите массовую долю КОН в новом растворе.
4. К 200мл раствора серной кислоты (плотность 1,066г/мл) с массовой долей кислоты 10% прилили 1 литр воды. Определите массовую долю серной кислоты в полученном растворе.
5. Определите массовую долю хлорида натрия в растворе, полученном при смешивании раствора массой 200г с массовой долей хлорида натрия 20% и раствора объёмом 100мл с массовой долей хлорида натрия 30% и плотностью 1,15г/мл.
6. При упаривании раствора хлорида натрия массой 500г с массовой долей растворённого вещества 1%, получен новый раствор массой 150г. Какова массовая доля полученного раствора?
7. Сколько килограмм соли надо растворить в воде массой 2кг, чтобы получить раствор с массовой долей 20%?
Список литературы.
1. Габриелян, О. С. Химия для профессий и специальностей технического профиля [Текст]: учебник / О. С. Габриелян, И. Г. Остроумов. – 6-е изд., стер. – М. : Академия, 2017. – 269 с. : ил. – (Профессиональное образование).
2.Габриелян О.С. Химия: тесты, задачи и упражнения: учеб.пособие для студ. учреждений сред. проф. образования / О.С.Габриелян, Г.Г. Лысова. – 5-е изд., стер. – М.: Издательский центр «Академия», 2017.
Практическая №19.
Получение хлороводорода и соляной кислоты, их свойства
.
Цели работы.
1. Получить и собрать хлороводород.
2. Получить соляную кислоту
3. Написать уравнения выполненных окислительно-восстановительных реакций и разобрать их методом электронного баланса.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-составление уравнений реакций с помощью метода электронного баланса;
-определение возможности протекания химических превращений в различных условиях;
-объяснение зависимости свойств веществ от их состава и кристаллической решетки;
-умение давать определение и оперировать следующими химическими понятиями: окислитель и восстановитель, окисление и восстановление, вещество, химическая связь, молярный объем газообразных веществ, растворы;
-отражение химических процессов с помощью уравнений реакций.
Задачи преподавателя:
-ознакомить обучающихся с правилами безопасного поведения и этапами практической работы;
-ознакомить обучающихся с порядком сборки приборов для получения газов, правилами собирания и распознавания хлороводорода;
-развить у обучающихся навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков безопасного обращения с веществами в повседневной жизни.
Реактивы:
Кристаллический хлорид натрия, вода дистиллированная, раствор серной кислоты (3:2), синяя лакмусовая бумага.
Оборудование:
Асбестовая сетка, сухое горючее, спички, пробирки, штативс пробирками, пробка с газоотводной трубкой, U-образная трубка, пробка со стеклянной трубкой и активированным углем.
Ход работы:
Опыт 1. Получение хлороводорода и соляной кислоты, изучение их свойств.
Поместите в пробирку-реактор хлорид натрия (2–3 ложечки для сжигания) и смочите раствором концентрированной серной кислоты. Закройте пробирку пробкой с газоотводной трубкой, которая соединена с U-образной трубкойс лакмусовой бумагой, заполненной водой на 1/5 ее объема. Другое колено U-образной трубки закройте пробкой со стеклянной трубкой и активированным углем. Пробирку-реактор прогрейте и сильно нагревайте верхнюю часть реакционной смесив течение 1–1,5 мин. Уровень воды в правом колене вначале несколько повышается. По мере увеличения содержания хлороводорода в газовой смеси пробулькивание газов замедляется, затем может прекратиться. При несильном нагревании можно наблюдать втягивание жидкости из левого колена в правое колено U-образной трубки. Эти явления можно объяснить интенсивным растворением хлороводорода в воде. Лакмусовая бумага краснеет. Напишите уравнение реакции, объясните условия течения реакции.
Опыт 2. Взаимодействие соляной кислоты с металлами.
Опустите в пробирку кусочек цинка и добавьте раствор полученной соляной кислоты. Обратите внимание на выделение газа (водорода). Запишите наблюдения. Напишите уравнение данной окислительно-восстановительной реакции, используя метод электронного баланса.
Опыт 3. Взаимодействие соляной кислоты с основными оксидами.
Поместите в пробирку немного оксида магния и добавьте раствор полученной соляной кислоты. Обратите внимание на растворение осадка. Запишите наблюдения. Составьте уравнения реакции в молекулярном и ионном виде.
Опыт 4. Взаимодействие соляной кислоты с некоторыми солями.
Поместите в пробирку немного карбоната натрия и добавьте раствор полученной соляной кислоты. Обратите внимание на растворение осадка и выделение газа. Запишите наблюдения. Составьте уравнения реакции в молекулярном и ионном виде.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Осуществите превращения (составьте уравнения согласно схеме). Подпишите названия веществ.
NaCl → HCl → СО2 → Na2СО3
Запишите уравнения реакций в молекулярном и ионном виде.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическая работа №20 Получение аммиака, его свойства
Цели работы.
1. Получить и собрать аммиак.
2. Получить соляную кислоту
3. Написать уравнения выполненных окислительно-восстановительных реакций и разобрать их методом электронного баланса.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-составление уравнений реакций с помощью метода электронного баланса;
-определение возможности протекания химических превращений в различных условиях;
-объяснение зависимости свойств веществ от их состава и кристаллической решетки;
-умение давать определение и оперировать следующими химическими понятиями: окислитель и восстановитель, окисление и восстановление, вещество, химическая связь, молярный объем газообразных веществ, растворы;
-отражение химических процессов с помощью уравнений реакций.
Задачи преподавателя:
-ознакомить обучающихся с правилами безопасного поведения и этапами практической работы;
-ознакомить обучающихся с порядком сборки приборов для получения газов, правилами собирания и распознавания аммиака;
-развить у обучающихся навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков безопасного обращения с веществами в повседневной жизни.
Реактивы:
Кристаллический хлорид аммония, кристаллический гидроксид натрия, вода, раствор соляной кислоты, фенолфталеин.
Оборудование:
Асбестовая сетка, сухое горючее, спички, штатив с пробирками, пробка с газоотводной трубкой.
Ход работы:
Опыт 1. Получение аммиака и растворение его в воде.
Действия: Насыпьте смесь соли аммония и щелочив пробирку. Закройте пробкой с газоотводной трубкой, конец которой направлен вверх в перевернутую пробирку. Нагрейте смесь. Ощущается запах аммиака. Напишите уравнение реакции, объясните условия течения реакции.
Опыт 2. Растворимость аммиака в воде.
Через некоторое время пробирку с аммиаком, не переворачивая, закройте пробкой, затем опустите в кристаллизатор с водой. Откройте пробку. Вода заполняет пробирку, так как аммиак хорошо растворим. Добавьте к раствору фенолфталеин. Как изменился цвет раствора? Сделайте вывод о среде раствора аммиака. Напишите уравнение реакции взаимодействия аммиака с водой.
Опыт 3.Горение аммиака
Продолжая нагревать смесь, подожгите выделяющийся газ. Наблюдайте яркое пламя. Аммиак горит с образованием азота. Напишите уравнение реакции горения.
Опыт 4. Взаимодействия аммиака с кислотами.
Добавляем к окрашенному водному раствору аммиака разбавленную соляную кислоту. Раствор обесцвечивается. Составьте уравнения реакции в молекулярном и ионном виде.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Осуществите превращения (составьте уравнения согласно схеме). Подпишите названия веществ.
NH3 → NH4OH → NH4Cl → NH3 →N2
Для последней реакции составьте электронный баланс.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическая№ 21
Получение гидроксидов алюминия и цинка: исследование их свойств
Цели работы.
1. Получить гидроксид цинка и провести опыты, подтверждающие его свойства.
2. Получить гидроксид алюминия и исследовать его характерные химические свойства.
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-составление уравнений реакций с помощью метода электронного баланса;
-объяснение зависимости свойств веществ от их состава и кристаллической решетки;
-умение давать определение и оперировать следующими химическими понятиями: окислитель и восстановитель, окисление и восстановление, вещество, химическая связь, амфотерность, растворы;
-отражение химических процессов с помощью уравнений реакций.
---------------------------------------------------------------
Гидроксид натрия, хлорид цинка, серная и соляная кислоты, сульфат алюминия.
Оборудование:
Асбестовая сетка, сухое горючее, спички, штатив с пробирками.
Ход работы:
Опыт 1. Получение гидроксида цинка и изучение его свойств.
1.1. Получение.
В две пробирки налейте по 1 мл хлорида цинка и прилейте несколько капель гидроксида натрия. Пробирки встряхните. Что наблюдаете? Напишите уравнение реакции в молекулярном и ионном виде.
1.2. Свойства гидроксида цинка.
К одной пробирке с гидроксидом цинка прилейте несколько капель раствора кислоты, к другой – несколько капель раствора щелочи. Пробирки встряхните. Что наблюдаете? Напишите уравнение реакции в молекулярном и ионном виде. Сделайте вывод о характере свойств гидроксида цинка.
Опыт 2. Получение гидроксида алюминия и изучение его свойств.
1.1. Получение.
В две пробирки налейте по 1 мл сульфата алюминия и прилейте несколько капель гидроксида натрия. Пробирки встряхните. Что наблюдаете? Напишите уравнение реакции в молекулярном и ионном виде.
1.2. Свойства гидроксида алюминия.
К одной пробирке с гидроксидом алюминия прилейте несколько капель раствора кислоты, к другой – несколько капель раствора щелочи. Пробирки встряхните. Что наблюдаете? Напишите уравнение реакции в молекулярном и ионном виде. Сделайте вывод о характере свойств гидроксида алюминия.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. Осуществите превращения (составьте уравнения согласно схеме). Подпишите названия веществ.
NaOH → Zn(OH)2 → ZnCl2 → Zn(OH)2 → ZnO
Запишите уравнения реакций в молекулярном и ионном виде.
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическая работа №22
Получение и исследование свойств оксидов серы, углерода и фосфора
Цели работы.
1. Получить оксид углерода (IV) и изучить его свойства.
2. Получить оксидыфосфора и исследовать их свойства.
3. Получить оксиды серы и исследовать их свойства.
4. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-составление уравнений реакций с помощью метода электронного баланса;
-определение возможности протекания химических превращений в различных условиях;
-объяснение зависимости свойств веществ от их состава и кристаллической решетки;
-умение давать определение и оперировать следующими химическими понятиями: окислитель и восстановитель, окисление и восстановление, вещество, химическая связь, молярный объем газообразных веществ, растворы;
-отражение химических процессов с помощью уравнений реакций.
------------------------------------------------------------------
Реактивы:
Мел, известковая вода (р-р гидроксида кальция), раствор соляной кислоты, индикатор, лучина, красный фосфор, вода.
Оборудование:
Асбестовая сетка, сухое горючее, спички, штатив с пробирками, пробка с газоотводной трубкой,колбы, ложечки для сжигания, воронки, стаканы.
Ход работы:
Опыт 1. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1 – 2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2 – 3мл известковой воды. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и рассмотрите её в свете теории электролитической диссоциации.
Опыт 2. Получение оксида фосфора и изучение его свойств.
В металлическую ложечку для сжигания поместите около 0,5 г красного фосфора. Осторожно подожгите фосфор в пламени, быстро поместите в колбу с водой и прикройте стеклянной воронкой. При взбалтывании колбы наблюдайте растворение белого оксида фосфора в воде. Охарактеризуйте внешний вид продуктов реакции, отметьте, как протекает реакция; составьте уравнения реакций горения фосфора.
В колбу с водой добавьте индикатор – метиловый оранжевый. Объясните изменение окраски раствора, охарактеризуйте среду (кислая, нейтральная или щелочная) полученного раствора. Растворим ли оксид фосфора в воде? Составьте уравнения реакции оксидов фосфора P2O5 и P2O3 с водой. Составьте уравнения электролитической диссоциации ортофосфорной кислоты каждой ступени. Назовите все полученные соединения и ионы, содержащие фосфор.
Опыт 3. Получение оксида серы и изучение его свойств.
В металлическую ложечку для сжигания поместите около 0,5 г серы. Осторожно подожгите серу в пламени, быстро поместите в колбу с водой и прикройте стеклянной воронкой. При взбалтывании колбы наблюдайте растворение белого оксида серы в воде. Охарактеризуйте внешний вид продуктов реакции, отметьте, как протекает реакция; составьте уравнения реакций горения фосфора.
В колбу с водой добавьте индикатор – метиловый оранжевый. Объясните изменение окраски раствора, охарактеризуйте среду (кислая, нейтральная или щелочная) полученного раствора. Составьте уравнения реакции оксидов серыSO2 и SO3 с водой.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
17. Название и цель работы.
18. Перечень реактивов и оборудования.
19. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
20. Общий вывод по работе.
Контрольные вопросы
Решите задачи:
1. Какой объем диоксида серы SO2 при нормальных условиях можно получить при сжигании серы массой 500 г? (Ответ: 350 л).
2. Привести примеры уравнений реакций (не менее двух на каждый случай) получения SO2, которые:
а) сопровождаются изменением степени окисления серы;
б) не сопровождаются изменением степени окисления серы.
3. Написать уравнение реакции получения сернистого газа (SO2) из железного колчедана (FeS2). Рассчитать объем SO2 (условия нормальные), который получится при окислении 1,5 кг железного колчедана. (Ответ: 560 л).
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическая№ 23.
Ознакомление с коллекцией удобрений и пестицидов
Цели работы:
1. Ознакомиться с коллекцией удобрений и пестицидов.
2. Научиться по простейшим реакциям определять вид минеральных удобрений, описывать внешний удобрений
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-умение давать определения и оперировать следующими химическими понятиями: минеральные соединения, пестициды, качественные реакции;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Задачи преподавателя:
-ознакомить обучающихся с правилами безопасного поведения и этапами практической работы;
-закрепить знания по теме «Химия в жизни общества»;
-развить у обучающихся навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков безопасного обращения с веществами в повседневной жизни.
Реактивы:
Коллекция удобрений и пестицидов, вода, щелочь.
Оборудование:
Штатив с пробирками, держатель, стеклянная палочка, асбестовая сетка, сухое горючее, спички, шпатель.
Ход работы:
Опыт 1. Определение удобрений по внешнему виду.
По внешним признакам удобрений (цвет, консистенция, слеживаемость) опишите предложенные вам удобрения. Заполните таблицу:
|
№ пробирки |
цвет |
консистенция |
слеживаемость |
|
№ 1 |
|
|
|
|
№ 2 |
|
|
|
|
№ 3 |
|
|
|
Опыт 2. Растворимость удобрений в воде.
По 1 г предложенных вам удобрений насыпьте в пробирку, добавьте в пробирку 5 мл воды. Хорошо перемешайте. В воде хорошо растворяются азотные и калийные удобрения.
С тем образцами, которые хорошо растворяются в воде необходимо проделать следующие опыты.
1. К 2 мл исходного раствора добавьте 1-2 мл щелочи и подогрейте. Запах аммиака указывает на принадлежность к азотным удобрениям. Запишите уравнения реакции.
2. К 2-3 мл исходного раствора добавьте AgNO3, если выпадет творожный белый осадок, то это калийные хлорсодержащие удобрения, а если появился желтый цвет, то это фосфатные удобрения. Запишите уравнения реакций. Сделайте выводы.
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
21. Название и цель работы.
22. Перечень реактивов и оборудования.
23. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
24. Общий вывод по работе.
Контрольные вопросы
5. Запишите классификацию удобрений.
6. Напишите формулы фосфатных, калийных удобрений.
7. Какими качественными реакциями можно определить состав удобрений?
8. Какие физические свойства характерны для удобрений?
9. Какой состав имеют растворимые и нерастворимые удобрения?
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
Практическая№ 24.
Ознакомление с образцами средств бытовой химии и лекарственных препаратов.
Цели работы:
1. Ознакомиться с химическим составом и инструкциями по применению важнейших лекарственных препаратов и материалов;
2. Ознакомиться с составом и применением некоторых химических средств санитарии и гигиены.
3. Написать уравнения выполненных реакций.
Характеристика основных видов учебной деятельности студентов:
-выполнение химического эксперимента в полном соответствии с правилами безопасности;
-наблюдение, фиксация и описание результатов проведенного эксперимента;
-объяснение химических явлений, происходящих в быту и на производстве;
-умение, готовность и способность применять методы познания при решении практических задач;
-сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
----------------------------------------------------------------------------------------
Реактивы:
Образцы лекарственных препаратов и средств личной гигиены, индикатор универсальный, мыло (2-х видов), шампунь (2-х видов), зубная паста (2-х видов), чистящие и моющие средства (2-х видов).
Оборудование:
Штатив с пробирками, стеклянная палочка, шпатель, химические стаканы, предметное стекло, пипетка (или стеклянная трубочка).
Ход работы:
Опыт 1. Определение удобрений по внешнему виду.
Ознакомьтесь с составом и правилами пользования домашней аптечкой, признаками пригодности ее составляющих к использованию. Получите представление о составе, свойствах и применении.Заполните таблицу:
|
Название лекарства |
Состав |
Формула основного составляющего |
Применение |
|
|
|
|
По химической формуле лекарственного препарата предположите свойства данного соединения. Запишите возможные реакции.
Опыт 2. Знакомство с образцами средств гигиены и моющих средств.
На образец мыла нанесите 1-3 капли воды и поместите кусочек универсальной индикаторной бумаги. Результаты наблюдений занесите в таблицу.
Внесите универсальную индикаторную бумагу в образец шампуня и определите уровень рН. Результаты занесите в таблицу.
Определите наличие абразивных материалов в образце зубной пасты. Нанесите на предметное стекло образец зубной пасты размером с горошину и разотрите. Наличие крупинок свидетельствует о присутствии частиц, обеспечивающих механическую очистку эмали зубов. Результаты занесите в таблицу, сформулируйте вывод.
По упаковке двух образцов моющих и чистящих средств определите их состав, применение. Рассмотрите и опишите их внешний вид. Занесите данные в таблицу.
|
Образец средства |
Внешний вид |
Состав |
Применение |
Значение рН
|
|
|
|
|
|
|
По упаковке |
Практически |
По ходу работы заполните таблицу и сделайте выводы.
Содержание отчета:
1. Название и цель работы.
2. Перечень реактивов и оборудования.
3. Заполнение таблицы:
|
Алгоритм выполнения и наблюдения |
Уравнения реакций и выводы |
|
|
|
4. Общий вывод по работе.
Контрольные вопросы
1. На чем основано моющее действие СМС?
2. Почему не рекомендуется умывать лицо мылом?
3. Запишите уравнение реакции гидролиза мыла
Список литературы.
1. Габриелян, О. С.Естествознание. Химия [Текст]: учебник / О. С. Габриелян, И. Г. Остроумова. – 2-е изд., стер. – М.: Академия, 2017. – 238 с.: ил. – (Профессиональное образование).
2. Габриелян, О. С. Химия [Текст]: тесты, задачи и упражнения : учеб.пособие / О. С. Габриелян, Г. Г. Лысова. – 5-е изд., стер. – М.: Академия, 2017. – 335 с.: ил. – (Профессиональное образование).
3. Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М.Практикум: учеб.пособие для студ. учреждений сред. проф. образования. - М., 2015. – 304 с.
ИНСТУКЦИЯ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ ДЛЯ СТУДЕНТОВ
1. Данная инструкция обязательна для выполнения всеми студентами, допущенными по состоянию здоровья, к лабораторно-практическим занятиям по физике.
2. Опасность возникновения травм:
- при работе со спиртовками;
- при работе с горячими жидкостями;
- при работе со стеклянной посудой;
- при работе с электроприборами;
3. В кабинете физики должна быть аптечка, укомплектованная необходимыми медикаментами и перевязочными средствами для оказания первой помощи пострадавшим.
4. Учебные приборы должны иметь двойную или усиленную изоляцию (II класс), либо III класса (присоединяться непосредственно к источникам питания с напряжением не выше 42в).
5. Запрещается использовать ртуть для проведения лабораторных работ и опытов.
1. Не трогать приготовленные к работе материалы и оборудование.
2. Внимательно выслушать инструктаж по ТБ при проведении работы.
3. Получить учебное задание у преподавателя.
Требования безопасности во время занятий
1. При проведении лабораторных работ будьте внимательны и дисциплинированы, точно выполняйте указания преподавателя.
2. Не приступайте к выполнению работы без разрешения преподавателя.
3. Размещайте приборы, материалы, оборудование на своем рабочем месте таким образом, чтобы исключить их падение или опрокидывание.
4. Особенно осторожно обращайтесь со стеклянными сосудами.
5. Не допускайте предельных нагрузок измерительных приборов!
6. Следите за исправностью всех креплений в приборах и приспособлениях.
7. При сборке электрических цепей используйте провода с прочной изоляцией, без видимых повреждений; избегайте пересечения проводов.
8. Источник тока в электрической цепи подключайте в последнюю очередь.
9. Собранную цепь включайте после проверки и разрешения преподавателя.
10. Нельзя прикасаться к находящимся под напряжением элементам, лишенных изоляции. Производить пересоединения в цепях и смену предохранителя до отключения источника питания.
11. Пользуйтесь инструментами с изолированными ручками.
12. По окончании работы отключите источник электропитания, после чего разберите электрическую цепь.
13. Нельзя уходить с рабочего места без разрешения преподавателя.
14. Обнаружив неисправность в устройствах, сообщите об этом преподавателю. В устройствах находящихся под напряжением немедленно отключите источник питания.
15. Не следует нагревать воду свыше 700 С.
16. Нельзя зажигать спиртовку от другой спиртовки.
1. Приведите в порядок своё рабочее место, проверьте его безопасность.
2. Ничего не выносите из кабинета без указания преподавателя.
3. Вымойте лицо и руки с мылом.
4. Обо всех недостатках, обнаруженных во время работы, сообщите преподавателю.
Критерии оценивания лабораторных работ:
Оценка «5» ставится, если студент выполняет работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений; самостоятельно и рационально монтирует необходимое оборудование; все опыты проводит в условиях и режимах, обеспечивающих получение правильных результатов и выводов; соблюдает требования правил безопасности труда; в отчете правильно и аккуратно выполняет все записи, таблицы, рисунки, чертежи, графики, вычисления; правильно выполняет анализ погрешностей.
Оценка «4»ставится, если выполнены требования к оценке «5» , но было допущено два - три недочета, не более одной негрубой ошибки и одного недочёта.
Оценка «3» ставится, если работа выполнена не полностью, но объем выполненной части таков, позволяет получить правильные результаты и выводы: если в ходе проведения опыта и измерений были допущены ошибки.
Оценка «2» ставится, если работа выполнена не полностью и объем выполненной части работы не позволяет сделать правильных выводов: если опыты, измерения, вычисления, наблюдения производились неправильно.
Во всех случаях оценка снижается, если студент не соблюдал требования правил безопасности труда.
Как оформить лабораторный отчет
1. Перед выполнением работы необходимо ознакомиться с целью и ходом выполнения работы.
2. Повторить (или изучить) теоретический материал по данной теме.
3. Подготовить тетрадь для выполнения данной работы.
4. На уроке выполнить исследование (измерения, наблюдения).
5. Составить отчет о выполнении лабораторной работы по схеме:
1. Дата, наименование и номер работы.
2. Цель исследования и перечень необходимого оборудования.
· Сформулируйте цель исследования. Она должна быть ясной и конкретной.
· Сформулируйте и запишите гипотезу, которую собираетесь проверить в ходе лабораторной работы. Гипотеза должна быть четкой, давая ясное и точное описание того, что может случиться и почему (если…, то….).
· Напишите краткое теоретическое обоснование эксперимента.
· Укажите, какие переменные являются независимыми, какие – зависимыми, какие – неизменными.
· Независимая переменная – величина, которую вы будете менять в ходе эксперимента. Например, при изучении зависимости ускорения от угла наклона плоскости, вы будете менять угол наклона, следовательно, он является независимой переменной.
· Зависимая переменная – величина, которую вы будете измерять в ходе эксперимента. В предыдущем примере - это время движения шарика вдоль плоскости.
· Постоянная величина (контролируемая) – это величина, которая остается неизменной в процессе измерений, например, длина наклонной плоскости и масса шарика.
3. Методы и материалы.
· Опишите оборудование и материалы, необходимые для проведения эксперимента и методы измерения необходимых величин: как будете изменять независимую переменную, как будет измеряться зависимая переменная, как будете контролировать постоянные величины.
· Не забудьте указать инструментальные погрешности всех приборов.
4. Схема или зарисовка опыта, установки.
· Сделайте схематический рисунок установки, используемой в ходе лабораторной работы.
5. Условия, необходимые для проведения опыта.
· Опишите условия, которые необходимо обеспечить при проведении эксперимента, чтобы обеспечить наибольшую точность результата.
6. Сбор и обработка данных
· Результаты измерений обычно оформляются в виде таблицы. Таблицы должны быть пронумерованы и иметь заголовок, который кратко отражает содержание таблицы. В таблице также необходимо указать погрешности измерений. Единицы измеряемых величин указываются только в названии столбцов.
· Полученные данные должны быть правильно обработаны и представлены в таблицах или графиках. К графикам необходимо сделать аннотации и присвоить номера.
· Вычислите погрешности измерения, оформите конечный результат в виде
а = аср ± ∆а.
7. Вывод:
· Сделайте вывод на основе полученных данных и выдвинутой гипотезы. Сравните ваши результаты с литературными данными.
8. Рефлексия и оценка результата.
· Оцените достоинства и недостатки использованного метода. Опишите основные источники погрешностей. Сделайте предложения по улучшению методики проведения эксперимента и использованного оборудования.
Небрежное оформление отчета, исправления недопустимы!
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.