
Отзыв на открытый урок по химии в 9 классе учителя химии
МКОУ «Аладашская СОШ-детский сад»
Ибрагимовой Фатимат Мурадагаевной
по теме: «Положение железа в Периодической таблице химических элементов и строение его атома.
Структура урока включает в себя следующие этапы:
1. Организационный момент
2. Проверка домашнего задания
3. Изучение нового материала
4. Первичное закрепление новых знаний
5. Домашнее задание.
6. Рефлексия
Организационный момент заключался в приветствии учителя, проверки наличия учащихся на уроке, наличия необходимых принадлежностей.
При проверке и оценке знаний был применен графический диктант с последующей взаимопроверкой по эталону.
На этапе мотивации, был использован отрывок из произведения Даниэля Дефо «Робинзон Крузе», что позволило совместно с обучающимися сформулировать тему урока «Положение железа в Периодической таблице химических элементов и строение его атома. Свойства железа». После составления кластера в общей беседе были определены цель и план урока. Совместная постановка темы и целей урока активизировали деятельность учащихся.
Главные вопросы нового материала по теме урока: железо как химический элемент (его положение в ПСХЭ и особенности строения атома), железо как простое веществ (его физические и химические свойства, нахождение в природе), составление уравнений химических реакций и формул различных соединений железа, подходы к называнию веществ.
С помощью разнообразных методов и приёмов (беседы, проблемно- поискового, самостоятельной работы, работы с учебником, выполнения лабораторных опытов «Взаимодействие железа со сложными веществами», обобщения, анализа информации, работы с видеофрагментом «Горение железа в кислороде») важные вопросы урока были отработаны и поняты учащимися.
Для эффективного проведения урока были использованы следующие формы организации учебной деятельности учащихся:
1) индивидуальная работа (работа с Периодической таблицей химических элементов; работа у доски; работа с учебником, коллекциями «Металлы и их сплавы»);
2) фронтальная работа;
3) работа в парах(лабораторные опыты).
В ходе урока во избежание однообразия и переутомляемости, поддержания интереса к теме, учительница чередовала индивидуальную и групповую формы работы.
На уроке имело место использование дополнительного материала.
Для знакомства обучающихся с нахождением железа в природе и его соединениями были заслушаны заранее подготовленные сообщения учащихся, использован краеведческий материал (Курская магнитная аномалия).
В середине урока проведена физкультминутка, которая сняла интеллектуальное напряжение и повысила настроение детей.
Закрепление материала проведено в форме беседы, а также в виде самостоятельной работы учащихся - работа с карточками-заданиями у доски и в тетрадях.
Закрепление материала позволило выяснить, что учащиеся в основном поняли новый материал, помогло выявить ошибки в его понимании и исправить их.
Социолог школы: /_______________/ П.Г.Алипулатова
Отзыв на открытый урок по химии в 9 классе учителя химии
МКОУ «Аладашская СОШ-детский сад»
Ибрагимовой Фатимат Мурадагаевной
по теме: «Положение железа в Периодической таблице химических элементов и строение его атома.
На протяжении всего урока применялись различные приёмы оценивания учащихся: словесные («Молодец! Хорошо поработали!»), мимические (улыбка). Оценка мотивирует учащихся к достижениям, формирует устойчивую самооценку, вызывая уверенность в себе.
По домашнему заданию был дан подробный инструктаж, домашнее задание включает творческий компонент.
В конце урока была проведена рефлексия.
В целом, структура урока соответствовала выбранному типу учебного занятия – комбинированный урок; цели урока были достигнуты, в ходе занятия обучающиеся проявляли достаточную активность, изучаемый материал был им понятен.
Использование ИКТ (слайдовой презентации, видеофрагмента) позволило разнообразить материал урока, сделало его наглядно-образным, интересным.
Для устранения типичных ошибок считаю необходимым продолжить работу над написанием окислительно – восстановительных уравнений, напомнить учащимся, что такое ионы; давать больше заданий на уравнивание химических реакций.
Учитель русского языка и литературы:
Алисултанова Валида Абдурагимовна /__________________/
Конспект открытого урока по химии в 9 классе учителя химии
МКОУ «Аладашская СОШ-детский сад»
Ибрагимовой Фатимат Мурадагаевной
Тема урока: «Положение железа в Периодической таблице химических элементов и строение его атома. Свойства железа»
Тип урока: комбинированный
Вид урока: Проблемно – исследовательский с применением эксперимента. Цель урока:
Образовательные:
-рассмотреть положение химического элемента железа в Периодической системе химических элементов Д. И Менделеева, строение атома;
- изучить химические свойства простого вещества - железа, познакомиться с природными соединениями железа.
Развивающие:
- развить навыки составления уравнений химических реакций;
- логическое мышление и память учащихся;
- совершенствовать умения доказывать, сравнивать.
Воспитательные:
- воспитывать коммуникативные навыки;
- повышение интереса к предмету;
- способствовать воспитанию у учащихся чувства гордости за свою Родину как самую богатую природными ресурсами страну.
Задачи урока.
Образовательные:
-составить полное представление об элементе и простом веществе – железе, о его физических свойствах, опираясь на знания зависимости свойств металлов от строения их атомов;
- предсказать характерные химические свойства железа;
Развивающие:
- на основе межпредметных связей продолжить формирование умений устанавливать взаимосвязь между составом, строением и свойствами веществ;
-познакомить учащихся с химическими свойствами, способствовать развитию исследовательских навыков;
-развивать у учащихся представления о познаваемости и единстве окружающего нас мира в результате предоставления информации о разных формах существования железа и его нахождении в природе;
-продолжить формирование умений работать быстро, экономя время урока.
Воспитательные:
- формировать у учащихся чувство гордости за свою Родину как самую богатую природными ресурсами страну;
- воспитывать культуру учебного труда, аккуратность;
-формировать умения работать в паре, желание помогать друг другу, учиться работать собранно, внимательно;
- совершенствовать технику безопасного труда.
Эксперимент. Вытеснение железом атома меди из соли этого
металла, как менее активного, чем железо.
Реактивы и оборудование. Д. Железо, сульфат меди, химические стаканчики.
Л.О. железо, соляная кислота, пробирки.
Оборудование: коллекции «Металлы и сплавы», «Железные руды», раздаточный материал: карточки «Физические свойства железа», инструктивные карточки к лабораторной работе «Взаимодействие железа со сложными веществами», персональный компьютер, проектор, презентация «Железо и его свойства».
Ход урока.
I. Организационный момент
Учитель. Приветствие класса. Проверка готовности к уроку.
II. Повторение и проверка знаний.
Вопрос ученикам: Какую большую тему мы с вами изучаем?
Ответ: Металлы.
-Какие металлы мы изучили на прошедших уроках? (Аl и Ca).
Проведем графический диктант на знание этих металлов.
(см. приложение 1).
-Поменяйтесь тетрадями между собой, сравните с ответами на экране и поставьте соседу оценку по критериям:
без ошибок- 5
1-2 ошибки-4
3-5 ошибок-3
Слайд1.
Учитель. Сегодня на уроке мы продолжим знакомиться с представителями семейства металлов. С каким? Послушайте рассказ -загадку.
III. Подготовка к восприятию нового материала
Учитель. Герою знаменитого романа Даниэля Дефо повезло. Корабль, с которого он спасся, сидел на мели совсем недалеко от острова. Робинзон сумел погрузить на плот все необходимое и благополучно переправился на остров.
Слайд 2.
Ему повезло еще раз – цитируем роман: «После долгих поисков я нашел ящик нашего плотника, и это была для меня поистине драгоценная находка, которой я не отдал бы тогда за целый корабль с золотом…»
Что же было в плотницком ящике?
Да, обыкновенные железные инструменты: топор, пила, молоток, гвозди. …
Вопрос. Что общего у инструментов?
Вопрос. Какой металл использовался для инструментов?
Как видим, без железа не может обойтись даже приключенческая литература. Чрезвычайно важное место занимает этот металл в жизни человека.
Слайд 3.
Подтверждением этого являются слова академика А.Е. Ферсмана:
“...железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного труда и трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества”
Я думаю, вы уже догадались, с каким металлом мы познакомимся сегодня на уроке. Сформулируйте тему нашего урока.
Слайд 4.
Тема урока: «Положение железа в Периодической таблице химических элементов и строение его атома. Свойства железа»
(запись тему в тетрадях)
Учитель. Ребята, давайте составим план, по которому мы будет изучать данный металл. Для этого предлагаю вам заполнить кластер в листочках на столах.
(составление плана, чтение)
Учитель. Что первым будем изучать, следующий этап …..
- На доске выстраивается план урока
План изучения темы
1.Строение атома железа
2.Нахождение в природе.
Природные соединения железа
3.Получение металла.
4.Физические свойства
5.Химические свойства железа.
- план составлен, каковы же будут цели нашего урока.
Слайд 5.
Учитель.
цели урока - рассмотреть положение химического элемента железа в Периодической системе химических элементов Д. И Менделеева, строение атома.
Изучить физические и химические свойства простого вещества - железа, познакомиться с природными соединениями железа.
IV. Изучение нового материала.
Учитель. Изучение железа начнем с характеристики его как элемента, его положению в периодической таблице.
Задание 1. Охарактеризовать положение железа в ПСХЭ.
(ученик работает у ПСХЭ)
(Железо находится в 4 периоде в побочной подгруппе VIII группы. Это d-элемент, у которого заполняется электронами предпоследний энергетический уровень. Порядковый номер 26, Аr = 56)
Учитель. Атомы железа устроены несколько отлично от атомов элементов главных подгрупп. Давайте определим особенности электронного строения атома железа.
У доски работает …………
Задание 2. Составить электронную и графическую формулу для элемента железо.
(один ученик работает у доски, класс самостоятельно выполняет в тетрадях)
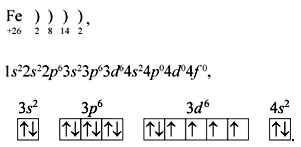
Учитель. Анализируя электронную формулу мы видим, что распределение электронов у атома железа отличается от ранее изученных металлов.
- С чем связана такая особенность?
железо – это элемент побочной подгруппы. Строение атомов элементов побочных подгрупп отличается от строения атомов элементов главных подгрупп.
Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.
Учитель вместе с учащимися формулирует вывод о свойствах элемента железа на основе строения его атома.
- Исходя из строения, какие свойства (окислительные или восстановительные) будут проявлять атомы железа?
!Подобно всем металлам, атомы железа проявляют восстановительные свойства.
? Какую степень окисления при этом будет проявлять железо?
! +2
-Железо - такой же восстановитель, как и другие металлы. Однако атомы железа при окислении отдают не только электроны последнего уровня, приобретая степень окисления +2, но и способны к отдаче электрона с предпоследнего уровня, приобретая степень окисления +3.
Учитель. Какой вывод можно сделатьизучив по строению атома железа?
Вывод: Валентные электроны располагаются на внешнем и предвнешнем энергетических уровнях.
- железо в реакциях проявляет степень окисления +2, +3
(запись в тетради).
2.Нахождение в природе
Учитель. Продолжим изучение железа, поговорим о нахождении простого вещества железа в природе. В этом нам помогут учащиеся, подготовившие сообщение
Заслушиваются сообщения учащихся.
1-й ученик. Железо занимает 4-е место по распространённости в земной коре (после кислорода, кремния и алюминия). По современным представлениям в 16-километровой толще земной коры содержится 4,5 % железа. В следующем слое, лежащем под земной корой, железа находится втрое больше. Центр земного шара состоит в основном из железа с примесью никеля и кобальта. В среднем же земной шар состоит на 34,6 % из железа. В составе Земли железо преобладает как по массе, так и по числу атомов. Учёные полагают, что первое железо, попавшее в руки человека, было метеоритного происхождения. Не случайно на некоторых древних языках железо именуется «небесным камнем». «Земное» железо – практически всегда связанное в виде соединений, минералов, а
Вопрос. Самородное железо встречается очень редко. Какие минеральные ресурсы используют для получения железа?
(железные руды)
Рассмотрим важнейшие руды содержащие железо.
Демонстрация.
Магнетит – магнитный железняк оксид железа
Гематит - красный железняк
Лимонит – бурый железняк
Пирит - железный колчедан
Слайд 6.
Железные руды отличаются по содержанию железа.
Учитель. Откройте учебник на с 171 по таблице 33 определите
Какие руды богаты железом?
(Ответы учеников)
- Какие вам известны крупные месторождения железных руд в России?
(Урал, Сибирь, Кольский полуостров, КМА). Россия богата железными рудами.
- особой гордостью для нас является Курская магнитная аномалия, о ней нам расскажет…………………..
2 –й ученик. КМА.
Слайды 7-10
3.Способы получения железа.
Учитель. Производство железа из руд началось в конце 1 тысячелетия до н. э. Бронзовый век сменился железным только тогда, когда человечество смогло поднять температуру пламени в печах до температура выплавления железа. Металлическое железо выплавляли путем нагревания руды с древесным углем при высокой температуре.
Учитель. Какие вам известны современные способы получения металлов?
(наиболее активные металлы получают при пропускании постоянного электрического тока через растворы и расплавы их соединений. Менее активные восстанавливают из оксидов углем, оксидом углерода 2, алюминием.)
- эти способы используются и для получения и железа.
Слайд 11.
Получение железа из его соединений
Fe2O3 + 3C = 2Fe + 3CO;
Fe2O3 + 3CO = 2Fe + 3CО2.
Fe2O3 + 3H2 = 2Fe + 3H2O;
Fe2O3 + 2Al = 2Fe + Al2O3
4.Физические свойства железа.
Учитель. Переходим к следующему пункту нашего плана. О чем поговорим дальше? (о физических свойствах железа).
(Лабораторная работа)
Рассмотрите образцы железа в коллекциях.
На ваших столах лежат карточки с заданием№1. (см.Приложение 2.)
Подумайте и назовите физические свойства железа - простого вещества, используя ваши знания об общих физических свойствах металлов.
- А теперь проверим, правильно ли вы назвали физические свойства железа.
- Откройте учебник на с.172 и сравните свои ответы с учебником.
(чтение)
(Химически чистое железо – серебристо-серый, блестящий металл, по внешнему виду очень похожий на платину. Довольно мягкий, пластичный. Его можно обрабатывать: резать, ковать, прокатывать, штамповать. Ему можно придавать большую прочность и твердость путем закалки - метод термического воздействия.
Температура плавления 1540 С – тугоплавкий металл.
Температура кипения 3070 С.
Плотность 7, 87 г/см3.
Чистое железо в отличие от всех других металлов обладает необычайно высокой склонностью к намагничиванию)
Учитель. Железо высокой чистоты содержит менее 0,01 % примесей. Такое железо устойчиво к коррозии и хорошо сопротивляется действию кислот.
Однако ничтожные примеси лишают его этих драгоценных свойств и железо начинает «болеть».
Вопрос. В древности появилось такое выражение: «Металл, принесенный в жертву «рыжему дьяволу», так чем же чем «болеет» железо?
Слайд 12. Коррозия металлов.
Железо разрушается под действием окружающей среды, т.е. подвергается коррозии – «ржавлению». При этом на поверхности образуется «ржавчина».
На земном шаре ежегодно поражается ржавчиной такое количество железа, которое равняется четверти его годовой добычи.
5. Химические свойства железа
Переходим к следующему пункту нашего плана – химические свойства.
- Определите место железа в электрохимическом ряду напряжений, сделайте вывод об его активности.
- какие химические свойства будет проявлять железо? (взаимодействие с неметаллами, кислотами, солями, водой)
Слайд13.
Учитель. Железо взаимодействует с простыми и сложными веществами.
При взаимодействии со слабыми окислителями проявляет степень окисления +2. К слабым окислителям относятся: сера, растворы солей, растворы кислот (кроме HNO 3).
При взаимодействии с сильными окислителями железо проявляет степень окисления +3. К сильным окислителям относятся галогены, азотная кислота и концентрированная серная кислота.
СИЛЬНО КОНЦЕНТРИРОВАННЫЕ АЗОТНАЯ И СЕРНАЯ КИСЛОТА НЕ ВЗАИМОДЕЙСТВУЮТ С ЖЕЛЕЗОМ, ЖЕЛЕЗО ПАССИВИРУЕТСЯ, ЧТО ПОЗВОЛЯЕТ ПЕРЕВОЗИТЬ И ХРАНИТЬ КИСЛОТЫ В ЖЕЛЕЗНОЙ ТАРЕ!
- рассмотрим взаимодействие с простыми веществами - неметаллами.
- просмотрим видеофрагмент «Взаимодействие железа с кислородом»
Видеофрагмент «Взаимодействие железа с кислородом»
0 0 +2,+3 -2
3 Fe + 2 О2 → Fe3О4
3Fe +2O2 = Fe3O4 (Fe2O3 FeO) – раскаленное железо сгорает в кислороде с образованием железной окалины, состоящей из двух оксидов.
Железо взаимодействует с галогенами.
Рассмотрим реакцию взаимодействия железа с хлором как ОВР
(объяснение учителя)
0 0 +3 -1
2 Fe +3 Cl2 = 2FeCl3,
0 +3
![]()
![]() 2 Fe - 3e Fe окисления
2 Fe - 3e Fe окисления
восстановитель
0 -1
![]() 3 Сl2 + 2e 2Cl восстановления
3 Сl2 + 2e 2Cl восстановления
![]() окислитель
окислитель
0 0 +3 -1
Fe + 3 Cl2 = 2 Fe + 6Cl
Учитель. Взаимодействие железа со сложными веществами мы изучим, выполнив лабораторные опыты. работаем в парах.
1пара проводит химический эксперимент «Взаимодействие железа с разбавленной соляной кислотой ».
2пара - «Взаимодействие железа с сульфатом меди».
Работу выполняете по инструктивным листам (Приложение 3), к проведению лабораторных опытов. По окончанию каждая группа предоставляет отчет.
Учитель. Прежде чем приступить к выполнению опытов, давайте вспомним технику безопасности.
(техника безопасности при проведении Л.О)
Учащиеся выполняют лабораторные опыты и оформляют их в тетради.
- Какие признаки химической реакции вы наблюдали?
- Какой вывод можно сделать о химических свойствах железа?
(вытеснение водорода из разбавленных кислот)
(в соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснять металлы, стоящие правее него, из водных растворов их солей)
У доски. Рассмотреть химические реакции как ОВР. Указать степени окисления элементов, определить окислитель и восстановитель, указать переход электронов.
Взаимодействие железа с водой.
Для проведения этой реакции необходима высокая температура (700-9000С), используя учебник, составьте уравнение реакции в тетрадях.Учитель. Познакомившись с химическими свойствами железа, сделаем вывод.
Вывод. Железо взаимодействует с неметаллами, водой, разбавленными кислотами и солями, образованными менее активными металлами, выступая в роли восстановителя.
Физминутка.
Глубоко вздохнули: вот, мы набрали кислород. Выдохнув: из легких чистых газ уходит углекислый. Руки вверх, потом вперед – не поймать нам водород. Руки в стороны. Ходить. Будем с химией дружить.
Вывод по уроку. Итак, вернемся к плану нашего урока. Все ли вопросы мы рассмотрели?
Слайд 14.
Великий Гете сказал: «Просто знать, еще не все, знания надо уметь использовать».
Закрепим ваши знания
1. В чем состоит главное отличие в строении атома железа от атомов металлов, изученных ранее?
2. Можно ли железо назвать элементом с постоянной степенью окисления?
Какие степени окисления проявляет железо?
3. Какие железные руды вы можете назвать?
4. Назовите физические свойства железа
5. Химически чистое железо практически не подвергается коррозии на воздухе. Почему же так быстро ржавеют железные гвозди, болты, трубы и другие изделия?
6. С какими веществами взаимодействует железо?
7. Концентрированные серную и азотную кислоты перевозят в стальных баллонах, не опасаясь их разрушения. Почему?
Учитель. На следующем уроке мы продолжим изучать тему «Железо», познакомимся со свойствами соединений железа. Переходим к закреплению. Решим задачу.
Закрепление знаний и умений.
Задача. Чтобы обнаружить примеси железа в платиновой посуде, например чашке, ее, нагревают до температуры красного каления. Тогда ее поверхность покрывается красным налетом. С чем связано появление налета? Как удалить этот налет не повредив изделие?
4Fe+ 3O2=2Fe2O3
Fe2O3 + 6HCl =2FeCl3 + 3H2O
Задание. Рассмотреть химическую реакцию взаимодействия железа с серной кислотой как ОВР
Выставление отметок.
Домашнее задание: § 48, упражнение 2. , с. 173. Творческое задание. Составить сообщение «А знаете ли вы?..» - интересные факты о железе. Слайд 15.
Рефлексия.
Учитель. А теперь предлагаю вам высказать свое отношение к уроку
Задание: Закончить предложения по образцу:
Сегодня я понял (а), что…
Главным на уроке для меня было…
Больше всего мне запомнилось…
Настроение после урока у меня …..
Приложение.
Приложение 1.
Графический диктант.
1. Это активный щелочноземельный металл.
2. Этот металл обладает относительно высокой электропроводностью.
3. Это мягкий металл.
4. Этот металл входит в состав сплава «электрон», используемого в ракетной технике, авиа- и автостроении.
5. Атомы этого металла входят в состав молекулы мела.
6. Оксид этого металла входит в состав драгоценного камня- рубина.
7. Этот металл самый распространенный металл земной коры.
8. Этот металл получают электролизом расплава его оксида в криолите.
9. Этот металл хранят в закрытом сосуде, под слоем масла.
10. Этот металл можно разрезать ножом.
11. Этот металл обладает высокой коррозийной стойкостью.
12.Этотметалл незаменимый конструкционный материал в самолетостроении, а также в строительстве.
13. С солями этого металла связана жесткость воды.
14. Оксид этого металла носит техническое название - негашеная известь.
15. Атомы этого металла входят в состав гипса.
16. Оксид этого металла обладает амфотерными свойствами.
17. Валентность этого металла – III.
18. Этот металл входит в состав зубной пасты «Новый жемчуг».
19. Валентность этого металла – II.
20. Из этого металла делают электрические провода.
|
Варианты ответов: |
Al |
2,4,6,7,8,11,12,16,17,20.
|
|
Са |
1,3,5,9,10,13,14,15,18,19.
|
Приложение 2.
Карточка 1
Из перечисленных свойств подчеркните те, которые характерны для железа:
газообразное, твердое, жидкое, красного цвета, серебристо-белое, имеет запах, без запаха, пластичное, хрупкое, куется, обладает высокой тепло- и электропроводностью, низкой тепло- и электропроводностью, тугоплавкий, легкоплавкий, температура плавления равна 1540 С, температура плавления равна 660 С, температура плавления равна 851 С, тяжелый (p = 7,85 г /см),
легкий (р. = 2,7 г /см), способен намагничиваться, не способен намагничиваться, растворяется в воде, не растворим в воде.
Приложение 3.
Лабораторный опыт 1. (работа в парах)
Взаимодействие железа с соляной кислотой.
Соблюдайте технику безопасности
1.Проведите опыт.
В пробирку положите 1 мг железа восстановленного и налейте 2–3 мл раствора соляной кислоты. Определите признаки химической реакции. Когда реакция закончится (пузырьки водорода начнут выделяться медленно), обратите внимание на окраску раствора хлорида железа (II).
Задание. Составить уравнения химических реакций, указать степени окисления элементов, определить окислитель и восстановитель, указать переход электронов.
Лабораторный опыт 2 (работа в парах)
Взаимодействие железа с сулфатом меди (II) .
Соблюдайте технику безопасности
1.Проведите опыт.
В пробирку налейте 4–5 мл раствора сульфата меди, затем опустите железный гвоздь. Что наблюдаете?
Отметьте признаки химической реакции.
Задание. Составить уравнения окислительно-восстановительных реакций взаимодействия железа с сульфатом меди, расставить коэффициенты, используя схему электронного баланса.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.