
№______САБАҚТЫҢ ЖОСПАРЫ
ПЛАН ЗАНЯТИЯ №_______
Топ
Группа________________________________________
Күні
Дата____________________________________
Пәні
Дисциплина: Химия
Сабақтың тақырыбы:
Тема занятия: «Арены. Гомологический ряд, изомеры, номенклатура аренов. Свойства и получение аренов»
Цель занятия: Изучить строение бензола , номенклатуру, изомерию, способы получения. Познакомить с важнейшими физическими и химическими свойствами аренов.
4. Задачи
4.1. Обучающие: Выявление и оценка степени овладения системой знания и комплексом навыков и умений о группе ароматических; готовности учащихся успешно применять полученные знания на практике
4.2 Воспитательные:
воспитание интереса к предмету и изучаемой теме;
воспитание культуры общения, умения работать в коллективе, взаимопомощи, активность в работе.
4.3 Развивающие:
Развитие мышления обучающихся, умения анализировать, обобщать и делать выводы; Развитие интереса к химии через содержание учебного материала.
5. Ожидаемые результаты:
5.1 Учащиеся должны понимать: основное содержание материала по теме : «Арены. Гомологический ряд, изомеры, номенклатура аренов. Свойства и получение аренов» т.е. правила построения молекул аренов, номенклатуру, изомерию, физические и химические свойства
5.2. Учащиеся должны иметь ценностные установки : познавательного интереса к предмету , самостоятельного анализа, контроля и самоконтроля
5.3. Учащиеся должны уметь : делать выводы и заключения; формировать вопросы к учебному материалу в связи с осмыслением его на уроке
6. Межпредметная связь: История, физика, математика.
7. Комплексное учебно-методическое обеспечение:ПО Activstudio, раздаточный материал, реактивы и оборудование к демонстрационному опыту УМК, (4) И.Г. Хомченко «Общая химия» (2) Н.Н. Нурахметов, К.Б. Бекишов, «Химия» 11 кл.
Урок начинается с организационного момента и настроя учащихся на урок.
Проверка домашнего задания:
1 задание: Проверям знания студентов простыми ответами «да» или «нет»
1. Алкины – углеводороды в молекулах которых имеются два атома углерода, связанные двойной связью нет
2. Простейшим алкином является ацетилен или этин С2Н2 да
3. Тип гибридизации у алкинов sp2 нет
4. Тройная связь в молекуле ацетилена складывается из одной δ- связи и двух π - связей. да
5. Гидрирование – это присоединение воды? Нет
6. Обесцвечивание бромной воды является качественной реакцией на ацетилен и на другие алкины. Да
5. Алкины вступают в реакцию только замещения. нет
6. Ацетилен используют для автогенной сварки и резки металлов да
7. нет
8. Химические свойства алкинов зависят от агрегатного состояния нет
9. Общая формула гомологического ряда алкинов СnH2n-2 Да
10. В лаборатории ацетилен получают взаимодействием карбида кальция с водой. Да
2 задание: Студентам представлены формулы углеводородов, в которые они должны рассортировать в два сосуда. В первый сосуд опускают только алкины , а во второй все другие.
Алкины: С2Н2 , С3Н4 , С4Н6 , С5Н8 , С6Н10 , С7Н12 , С8Н14 , С9Н16 , С10Н18 .
Другие: С2Н4 , С3Н8 , С4Н8 , С5Н12 , С5Н10 , С7Н16 , С8Н16 , С8Н18 .
3 задание : Найти соответствие между реагентами и продуктами химической реакции
|
CH3–C≡CH+ 2H2 ––t°,Pd→
|
CH3–CBr2–CH3
|
|
3СH≡CH →
|
AgC≡CAg↓+ H2O |
|
HC≡CH +2 Br2 → |
С6Н6 (бензол) |
|
HC≡CH + Ag2O →
|
CH3–CH- CH3 |
|
CH3–C≡CH +2 HBr → |
4CO2 + 2H2O +Q |
|
2C2H2 + 5O2 →
|
CHBr2–CHBr2 |
|
HC≡CH + 2Na → |
C2H5 – C – CH3 || O |
|
HgSO4 C2H5–C≡CH + H2O → H2SO4 |
NaC≡CNa + H2
|
Тема урока : «Арены. Гомологический ряд, изомеры, номенклатура аренов. Свойства и получение аренов.»
Цель занятия: Изучить строение бензола , номенклатуру, изомерию, способы получения. Познакомить с важнейшими физическими и химическими свойствами аренов.
План урока
1. История открытия бензола:
2. Арены. Строение молекулы бензола и гомологический ряд
3. Номенклатура
4. Изомерия
5. Физические свойства
6. Химические свойства
7. Получение
8. Применение
1 .История открытия бензола:
Бензол был открыт еще в 1649 г. Иоганном Глаубером. Однако, тогда еще ничего не было известно о его составе. Во второй раз бензол был "открыт" Майклом Фарадеем. Он выделил его из светильного газа в 1825 году и тогда же был установлен его состав - С6Н6. Позже было выделено большое количество соединений содержащих бензольный цикл и большинство из них имели приятный запах например в 1833 году немецкий физик-химик Э. Мичерлих получил неизвестное вещество при сухой перегонке кальциевой соли бензойной кислоты поэтому в 1860 г. А. Кекуле предложил для них название "ароматические углеводороды". Это название сохранилось до сих пор, а по систематической номенклатуре этот класс углеводородов называется арены
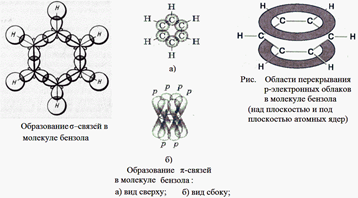
2.Арены. Строение молекулы бензола и гомологический ряд
Арены - это углеводороды с общей формулой СnH2n - 6 в молекулах которых есть одно или несколько бензольных колец.
Простейший представитель аренов –
бензол. Химическая формула С6Н6. Все шесть атомов
углерода находятся в состоянии sp2-гибридизации. Три гибридизованных
электронных облака каждого атома углерода образуют три ![]() -связи: две С-С –
с соседними атомами углерода и одну связь С-Н. Углы между связями - 120°. То
есть цикл получается устойчивый, т.к. реализуется валентный угол 120° для sp2-гибридизованных
атомов углеродов в отличие от циклопропана и циклобутана. Так как все атомы
углерода находятся в sp2-гибридизации, то все они и шесть атомов
водорода находятся в одной плоскости. А негибридизованные р-облака каждого
атома углерода перпендикулярны этой плоскости и параллельны друг другу и
перекрываются между собой над плоскостью цикла и под плоскостью, образуя
общую
-связи: две С-С –
с соседними атомами углерода и одну связь С-Н. Углы между связями - 120°. То
есть цикл получается устойчивый, т.к. реализуется валентный угол 120° для sp2-гибридизованных
атомов углеродов в отличие от циклопропана и циклобутана. Так как все атомы
углерода находятся в sp2-гибридизации, то все они и шесть атомов
водорода находятся в одной плоскости. А негибридизованные р-облака каждого
атома углерода перпендикулярны этой плоскости и параллельны друг другу и
перекрываются между собой над плоскостью цикла и под плоскостью, образуя
общую ![]() -систему:
-систему:
Алкены с
одной ![]() -связью легко
вступают в реакции присоединения, а бензол с прочной
-связью легко
вступают в реакции присоединения, а бензол с прочной ![]() -системой – очень
трудно. К
-системой – очень
трудно. К ![]() -связи алкенов и
к
-связи алкенов и
к ![]() -системе бензола
притягивается электрофильная частица, только в случае бензола не происходит
разрыва
-системе бензола
притягивается электрофильная частица, только в случае бензола не происходит
разрыва ![]() -системы, а идет
реакция замещения водорода на другие атомы или группы атомов. То есть для
аренов характерны реакции электрофильного замещения, хотя присоединять другие
атомы они тоже могут, но эти процессы для них нехарактерны, т.к. идут тяжело.
-системы, а идет
реакция замещения водорода на другие атомы или группы атомов. То есть для
аренов характерны реакции электрофильного замещения, хотя присоединять другие
атомы они тоже могут, но эти процессы для них нехарактерны, т.к. идут тяжело.
Исходя из выше
сказанного, правильнее изобразить строение бензола правильным шестиугольником с
кружочком внутри. ![]() Такая формула
подразумевает равноценность всех С-С связей и общую
Такая формула
подразумевает равноценность всех С-С связей и общую ![]() -электронную
систему.
-электронную
систему.
Примеры ароматических веществ:
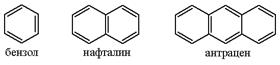
Арены
- это углеводороды с общей формулой СnH2n - 6 в
молекулах которых есть одно или несколько бензольных колец. Ближайший
гомолог бензола – метилбензол ![]() , тривиальное
название его – толуол.
, тривиальное
название его – толуол.
Гомолог бензола состава C8H10 имеет
четыре изомера:
1. Изомерия 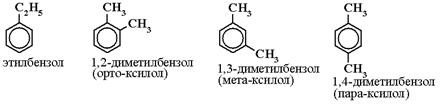
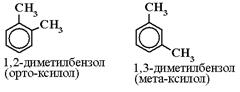
Арены имеют два вида изомерии:
1) Изомерия по положению заместителей в бензольном кольце:
2) Изомерия по строению углеводородного радикала:
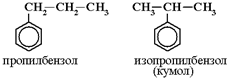
3.Номенклатура
Названия аренов строятся на основе слова бензол с указанием радикалов и их положения в бензольном кольце.
При этом неважно по или против часовой стрелки нумеровать атомы углерода в кольце, главное, чтобы сумма цифр, указывающих положение заместителей, была наименьшей:
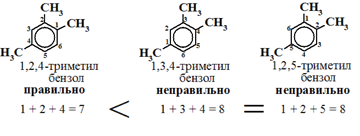
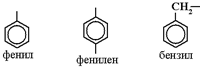
Названия ароматических радикалов:
Вещества с участием этих радикалов:
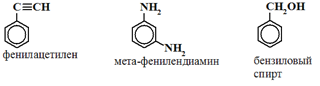
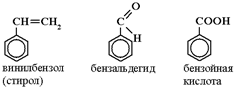
По систематической номенклатуре все названия ароматических углеводородов имеют суффикс ен: бензен, толуен, ксилен, стирен.
2. Физические свойства
Бензол и первые члены гомологического ряда бензола - чаще всего бесцветные жидкости , обладающие характерным запахом (демонстрируются образцы аренов: толуол, ксилол). Углеводороды, в состав которых входит не более одного бензольного кольца, как правило, легче воды. Арены в воде нерастворимы, но хорошо растворяются в органических растворителях, и сами являются таковыми.
Преподаватель демонстрирует эксперименты:
Студенты результаты опыта записывают в таблицу физических свойств аренов
|
Образец |
Агрегатное состояние |
Запах |
Растворимость в воде |
Растворимость в этаноле |
Растворимость масел |
|
Ксилол
|
|
|
|
|
|
|
Толуол
|
|
|
|
|
|
3. Химические свойства
Для бензола и его
гомологов с его прочной ![]() -электронной
системой характерны реакции электрофильного замещения, для
гомологов бензола характерны реакции окисления по углеводородному
радикалу, менее характерны - реакции присоединения.
-электронной
системой характерны реакции электрофильного замещения, для
гомологов бензола характерны реакции окисления по углеводородному
радикалу, менее характерны - реакции присоединения.
Реакции электрофильного замещения
1) Галогенирование (по ионному механизму):
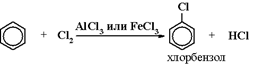
2) Алкилирование галогеналканами(по ионному механизму):
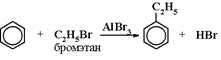
3) Нитрование (по ионному
механизму)катализатором служит H2SO4 (конц.)
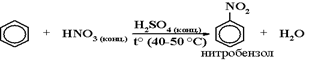
4) Сульфирование
![]()
5) Гидрирование
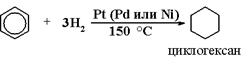
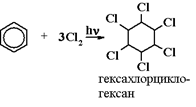
6) Галогенирование бензола (радикальное):
7) Галогенирование гомологов бензола (радикальное):
Галоген замещает водород в алкильном радикале, причем легче замещается атом водорода при третичном атоме углерода, затем при вторичном и в последнюю очередь – при первичном:
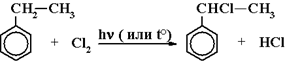
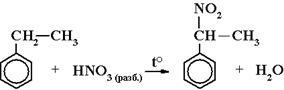
8) Нитрование гомологов бензола (радикальное). Реакция Коновалова:
По своему влиянию на перераспределение электронной плотности в бензольном
кольце заместители (атомы и группы атомов) делятся на ориентанты I рода,
ориентирующие электрофильную частицу в орто- и пара- положения, (-NH2,
-OH, –CH3,(Al,K), Cl (F, Br, I)) и ориентанты II рода,
ориентирующие электрофильную частицу в мета-положение (-CCl3, -NO2,
-COOH, -CHO, -SO3H).
Реакции окисления
9) Горение сильно коптящим пламенем:
![]()
4.
Получение
1) Дегидрирование с одновременной циклизацией алканов в
присутствии катализаторов Cr2O3, или Pt, или Pd:

2) Дегидрирование циклоалканов каталитическое:
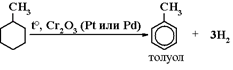
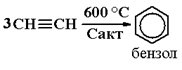
3) Тримеризация ацетилена, пропина:
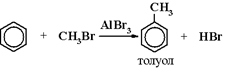
4) Алкилирование ароматических углеводородов (реакция Фриделя Крафтса)
5) Реакция Вюрца-Фиттига:
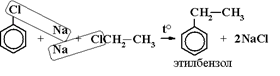
Сравнительная таблица химических свойств
|
Группы в-в |
Реакции присоединения |
Реакции замещения |
Реакции окисления |
Реакция горения |
|
Арены |
|
|
|
|
|
Алкины |
|
|
|
|
5. Основные области применения аренов:
Бензол и его гомологи являются важным сырьем для органического синтеза. Бензол применяется в производстве красителей, лекарственных препаратов, взрывчатых веществ, пластмасс, органических ядовитых химикатов, растворителей
Закрепление пройденного материала
1. Сколько соединений изображено ниже. Назовите эти соединения
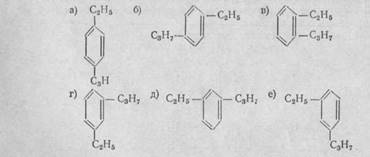
2. Задача: Вычислите массу бензола , полученного из ацетилена объемом 201,6 л при нормальных условиях
3. Напишите равнения реакций, при помощи которых можно осуществить превращения по схеме:
С→СН4→C2H2→C6H6→C6H5CI
В конце урока подводим результаты
Домашнее задание: (4) И.Г. Хомченко «Общая химия» гл.21 (2) Н.Н. Нурахметов, К.Б. Бекишов, «Химия» 11 кл. Гл 2§2.12 -2.14
Рефлексия проводится методом «Светофор». У каждого учащегося имеется набор кругов трёх цветов –красный ,желтый и зелёный. Если на уроке все понятно – зеленый круг, если не все понятно , то желтый , если не понял –красный.
Список использованных источников:
1. «Химия » 10 класс Н.Н. Нурахметов, К.Б. Бекишов, Н.А. Заграничная, Г.В. Абрамов. Мектеп. 2014г.
2. Общая химия И.Г. Хомченко Москва 1987 г. 464 с.
3. Справочник школьника «Химия» 8-11 класс. Н.Б. Алистратова.Астана «Арман-ПВ». 2015г.
4. Химия 8, 9, 11 классы/О.С. Габриэлян. Дрофа 2007.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.