
При воздействии на организм сильных патогенных факторов или при неблагоприятном развитии болезненных процессов, приводящих к резким нарушениям метаболизма и расстройствам жизненно важных физиологических функций, могут возникать тяжелые состояния, представляющие непосредственную угрозу для жизни больного. Такие состояния получили название экстремальных (лат. extremum – чрезвычайный, крайний, чрезмерный, предельный). Эти состояния иногда называют «неотложными», что указывает на необходимость принятия срочных терапевтических воздействий. К числу экстремальных состояний (ЭС) относятся: коллапс, шок, кома. От экстремальных состояний необходимо отличать терминальные состояния, к которым относятся все стадии умирания – преагония, агония, клиническая смерть, начальный этап состояния после успешной реанимации. Терминальные состояния являются следствием неблагоприятного течения экстремальных состояний. При неэффективной терапии терминальные состояния заканчиваются биологической смертью.
|
Патогенный фактор |
|
Экстремальное состояние |
|
|
|
|
|
Биологическая смерть |
Этапы расстройств жизнедеятельности организма при действии чрезвычайных патогенных факторов (П.Ф. Литвицкий, 2016).
Причины, приводящие к развитию ЭС подразделяются на экзогенные и эндогенные.
Экзогенные (внешние) факторы – могут иметь физическую, химическую, биологическую природу.
Физические факторы:
|
- механические; - электрические; - термические; |
- радиационные; - гравитационные; - барометрические. |
Химические факторы:
- дефицит или избыток: кислорода, субстратов метаболизма, жидкости;
- выраженные интоксикации лекарственными препаратами, промышленными ядами, кислотами, щелочами.
Биологические факторы:
- значительный дефицит или избыток экзогенных биологически активных веществ;
- микробы, паразиты и грибы (токсины, продукты их метаболизма и/или распада).
Эндогенные факторы, возникающие при неблагоприятном течении разнообразных болезней и патологических процессов:
- массивные внутренние кровотечения;
- кровоизлияния в жизненно важные органы;
- выраженная недостаточность функций органов и физиологических систем;
- избыток продуктов иммунных или аллергических реакций;
- эндокринные и метаболические расстройства;
- психические перенапряжения.
Патогенез экстремальных состояний
Экстремальные состояния характеризуются стадийным развитием. В большинстве случаев (за исключением остроразвивающихся ситуаций, заканчивающихся гибелью организма) в динамике экстремальных состояний выделяют 3 стадии: стадия активации адаптивных механизмов, стадия истощения и недостаточности адаптивных механизмов, стадия экстремального регулирования жизнедеятельности организма.
|
|
|
Активации адаптивных механизмов Причины: сигнальное действие повреждающего фактора; отклонение параметров гомеостаза. |
|
|
|
|
|
|
|
Недостаточности адаптивных механизмов Причины: нарастание степени и масштаба повреждения организма; перенапряжение и истощение адаптивных процессов. |
|
|
|
|
|
|
|
Экстремального регулирования жизнедеятельности организма Причины: дальнейшее нарастание степени и масштаба повреждения организма; нарастающая недостаточность адаптивных механизмов. |
Как и большинству патологических процессов, ЭС свойственна закономерно возникающая адаптивная реакция. В первую стадию происходит активация симпато-адреаноловой и гипофизарно-надпочечниковой систем, способствующая мобилизации ряда метаболических и системных защитно-приспособительных реакций. По мере увеличения тяжести состояния происходит сужение диапазона приспособительных реакций и развивается 2 стадия. На стадии недостаточности механизмов адаптации при различных экстремальных состояниях развивается комплекс закономерных стереотипных взаимосвязанных изменений в организме. Главными из них являются:
- расстройство и недостаточность функций органов и физиологических систем: нервно-гуморальной, дыхательной, сердечно-сосудистой, крови, гемостаза;
- значительные отклонения от нормы показателей гомеостаза, в том числе жизненно важных;
- повреждение субклеточных структур, клеток и нарушение межклеточного взаимодействия.
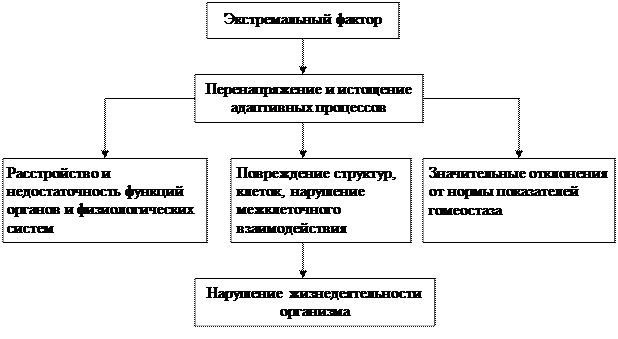
Расстройства в организме на стадии недостаточности механизмов адаптации.
В основе перехода организма на «экстремальное регулирование» лежит типовой механизм, заключающийся в том, что происходит максимальная экономия энергетических ресурсов организма, за счет снижения функциональной активности многих систем и перевод их на предельно упрощенный метаболический уровень регуляции. При этом сохраняется реализация сигналов ЦНС, необходимых для осуществления дыхания, кровообращения и других жизненно важных функций. Такая экономия функций повышает устойчивость «неработающих» структур к дефициту энергии, характерному для ЭС, и увеличивает вероятность восстановления функции после выхода или выведения организма из критического состояния. При прогрессировании указанных изменений развивается терминальное состояние и наступает смерть. Проведение эффективного лечения позволяет блокировать прогрессирование расстройств, восстановить и даже нормализовать состояние пострадавшего. Конкретные механизмы адаптации в значительной степени зависят от причины, особенностей ее воздействия на организм и его реактивности.
Главной причиной тяжелых расстройств обмена веществ и физиологических процессов при ЭС, как правило, является гипоксия, которая приводит к закономерным нарушениям обмена веществ, характерным для всех ЭС. Самым ранним проявлением нарушения обмена веществ является дефицит макроэргов: уменьшение содержания в клетках АТФ и увеличение продуктов ее гидролиза: АДФ и АМФ, аденозина и неорганического фосфора, а в головном мозге раньше всего уменьшается содержание креатинфосфата. Развивается метаболический ацидоз за счет накопления молочной, пировиноградной и кетокислот. Дефицит АТФ приводит к нарушению других видов обмена. Возрастает уровень остаточного азота в тканях и крови, повышается содержание аммиака.
Гипоксия приводит к повреждению биологических мембран клеток и их органелл. В основе повреждения лежит усиление свободнорадикальных процессов, сопровождающихся перекисным окислением липидов биологических мембран.
Происходит нарушение баланса электролитов и воды, а именно возрастает количество внеклеточного калия, усиливается выход воды в межклеточное пространство, происходит сгущение крови.
ЭС сопровождаются усиленным образованием биологически активных веществ: гистамина, серотонина, кининов, лизосомальных ферментов. Часто развивается диспротеинемия, накапливаются продукты денатурации белка. Как правило, развивается токсемия.
Система кровообращения. Всем ЭС свойственны расстройства микроциркуляции: нарушение перфузии микрососудов, расширение капилляров, прекапиллярных сфинктеров и венул, снижение их чувствительности к вазопрессорным влияниям, увеличение проницаемости сосудистой стенки. Возникает повышенная агрегация эритроцитов, что приводит к развитию «сладж феномена» повышается свертываемость крови и развивается диссеминированное внутрисосудистое свертывание крови (ДВС), микротромбоз сосудов, стаз.
Расстройства микроциркуляции в легких приводят к тяжелому нарушению их газообменной функции, «шоковое легкое», в почках к развитию почечной недостаточности, «шоковая почка». Нарушения микроциркуляции в печени, мозге могут вызвать печеночную недостаточность и расстройство нервной деятельности.
При ЭС развиваются и расстройства системной гемодинамики:
- падает объем циркулирующей крови и скорость кровотока;
- увеличивается депонирование крови;
- уменьшается венозный возврат крови к сердцу;
- падает тонус артериол и вен;
- падает давление крови;
- развивается сердечная недостаточность.
Система внешнего дыхания. Сначала развивается гипервентиляция легких, сменяющаяся развитием нарушений ритма и глубины дыхательных экскурсий, возникновением периодического дыхания типа Биота и Чейн-Стокса, появляется дыхание типа Куссмауля, развиваются дыхательные инспираторные задержки («апнейзис»). При очень тяжелых ЭС возникает временная остановка дыхания – претерминальная пауза, развивается дыхание в виде редких и глубоких судорожных «вздохов» – терминальное дыхание («гаспинг» дыхание).
Нервная система. Нарушения функций нервной системы наблюдаются при всех видах ЭС и относятся ко всем нервным процессам (корковым, вегетативным, локомоторным, сенсорным). Для большинства видов шока характерны в начальной стадии период возбуждения, сменяющийся заторможенностью, сознание утрачивается только при переходе в терминальное состояние.
Развитие коматозных состояний начинается с чувства сонливости, затрудненности общения с персоналом и родственниками, частичной утраты сознания с последующей его потерей.
При коллапсе сознание может быть длительно сохранено или сразу утрачивается.
Нарушения функции почек при ЭС возникают часто и проявляются олигурией или анурией, протеинурией, общей недостаточностью выделительной функции почек вплоть до уремии.
Нарушения функций печени характеризуются ослаблением процессов дезинтоксикации, синтеза мочевины, белково-синтетических процессов, диспротеинемией и нарушением всех видов обмена.
СТРЕСС
Стресс – типовой патологический процесс, возникающий на действие экстремальных факторов и включающий в себя комплекс неспецифических реакций, направленных на адаптацию и сохранение гомеостаза. Стресс является универсальным защитным механизмом, возникающим на действие всех чрезмерных раздражителей на уровне целостного организма.
Механизмы запуска стресс-реакций:
1) При интенсивном раздражении различных рецепторов.
2) При чрезмерном раздражении анализаторов.
3) При повышении в крови концентрации цитокинов.
4) С коры больших полушарий.
При воздействии экстремальных факторов с помощью выше описанных механизмов сигнал передается в гипоталамус, который является центральным звеном стресс-реализующих систем
(симпатоадреналовой, гипоталамо-гипофизарно-надпочечниковой).
Стресс-реализующая система (СРС).
Состоит из двух систем:
1) Симпато - адреналовой (симпатическая система и мозговое вещество надпочечников, при активации выделяются нейромедиаторы норадреналин и адреналин).
2) Гипоталамо- гипофизарно-надпочечниковая (в гипоталамусе выделяется кортиколиберин, под действием которого в аденогипофизе образуется АКТГ, он воздействует на пучковую зону коры надпочечников, где активируется синтез кортизола).
Выделяют:
· Центральное звено - ядра, расположенные в гипоталамусе;
· Периферическое звено-симпатические нервы и надпочечники.
При активации САС возникают следующие эффекты:
· Повышение силы и ЧСС;
· Повышение глубины и ЧДД;
· Централизация кровообращения (спазм периферических сосудов, расширение сосудов сердца и головного мозга);
· Выброс депонированных эритроцитов из селезенки и печени, и увеличение кислородной емкости крови – перераспределительный эритроцитоз (из-за спазма трабекул печени и селезенки под действием катехоламинов);
· Увеличение свертываемости крови;
· Увеличение глюкозы в крови за счет распада гликогена.
При активации ГГН системы (под действием ГК):
· Глюконеогенез;
· Протеолиз, повышение аминокислот в крови (используется в глюконеогенезе);
· Липолиз, увеличение жирных кислот в крови (используется в глюконеогенезе);
· Потенциируют и пролонгируют САС.
Данные реакции направлены на:
· Повышение кровоснабжения и оксигенации жизненно важных органов – т.е. синтеза АТФ;
· На остановку кровотечения;
· Репарацию поврежденных тканей за счет свободных АК.
Стадии стресса.
1. Стадия тревоги (фаза шока и противошока)
В фазу шока под действием стрессового фактора происходит нарушения адаптации и гомеостаза, что приводит к активации стресс-реализующей системы - СРС (САС и ГГН), запускаются срочные механизмы адаптации, обусловленные выделением катехоламинов и ГК, сопровождающиеся гиперфункцией органов и систем, участвующих в адаптации (повышение ЧСС, ЧДД, глюкозы и синтеза АТФ, централизация кровообращения). Данные реакции требуют больших энергетических затрат, но если адаптация достигается, то наступает стадия противошока, которая является переходной ко второй стадии.
2. Стадия резистентности. Возникает при длительном действии стрессового фактора, за счет включения долговременных защитных реакций, основную роль в которых играет ГГН система. В основе - активация генетического аппарата, синтез белка, развитие гипертрофии, гиперплазии органов, участвующих в адаптации. Формируется «структурный след».
3. Стадия истощения. 2 варианта течения:
1) Если стрессор чрезмерный и адаптация к нему невозможна, то истощение наступает после фазы шока за счет истощения САС и ГГН, развивается дефицит катехоламинов, надпочечниковая недостаточность, снижение АД, ЧСС, ЧДДàсмерть.
2) В том случае, если к стрессовому фактору возможна хотя бы частичная адаптация, то 3 стадия развивается после 2 стадии и для нее характерна триада Селье:
· Гиперплазия надпочечников;
· Гипоплазия лимфатических узлов;
· Изъязвление слизистой ЖКТ (из-за избытка катехоламинов и ГК).
Также повреждается миокард, возникает иммунодефицит и болезни дезадаптации (с наследственной предрасположенностью – СД, ЯБЖ, ИБС, ГБ, психические заболевания).
Стресслимитирующая система (СЛС)
Это система, подавляющая СРС. Выделяют:
· Центральные СЛС:
a) ГАМК-ергическая система,
b) Дофаминергическая;
c) Серотонинергическая;
d) Опиодергическая
· Периферические СЛС:
a) Аденозин
b) Цитопротект – белки
c) Простагландины
d) Оксид азота
При активации ГАМК-ергической, дофамин-, серотонинергических систем выделяются нейромедиаторы тормозного типа, которые подавляют центральные звенья, особенно на уровне гипоталамуса.
БОЛЬ
Боль – это эволюционно выработанная реакция, возникающая при действии на организм болевых (повреждающих) факторов, включающая своеобразные субъективные ощущения и интегрированный ответ организма и направленная на устранение повреждающего фактора и защиту организм от повреждения.
Интегративная реакция складывается из компонентов:
- сенсорный компонент, позволяет определить место повреждения.
- двигательный компонент, направлен на устранения действия повреждающих факторов.
- вегетативный компонент, связан с рефлекторным изменением тонуса симпатоадреналовой системы.
- эмоциональный компонент, отражает психоэмоциональную реакцию на повреждение.
- когнитивный компонент, участвует в формировании субъективного отношения к испытываемой в данный момент боли на основе накопленного опыта.
Виды боли:
1. По характеру и скорости наступления: Первичная Вторичная
Первичная боль (острая, быстрая, эпикритическая, локализованная). Быстрая (первичная) боль возникает в пределах 0,1с после воздействия раздражителя, быстро проходит, по характеру обычно резкая. Этот вид боли возникает с поверхности кожи, например, при уколе, порезе, при действии эл. тока и не ощущается в глубоких тканях организма. Быстрая боль (эпикритическая) связана с активацией А-дельта волокон (скорость проведения от 6-30 м\с) являющиеся тонкими миелинизированными волокнами.
Вторичная боль (тупая, медленная, протопатическая, тоническая, нелокализованная). Медленная (вторичная) боль проявляется через 0,5-1с или более после действия раздражителя, держится длительное время, по характеру – тупая. Обычно этот тип ассоциируется с деструкцией тканей, проводится как с кожи, так и из любых глубоких тканей. Медленная боль (протопатическая) связана с активацией немиелинизированных С-волокон (скорость проведения 0,5-2м\с).
2. В соответствии с расположением и классификацией рецепторов:
· Соматическая: - поверхностная (вызвана повреждением кожи, слизистых)
- глубокая (вызвана повреждением мышц, костей, сухожилий, суставов или соединительной ткани)
· Висцеральная - возникает при активации рецепторов внутренних органов (спазм гладкой мускулатуры, растяжение полых органов, нарушение МЦР в стенке органа, воспаление)
3. По биологической значимости для организма, по влиянию на адаптацию:
· Физиологическая (биологически целесообразная), при которой реакция систем организма направлена на защиту организма от повреждения и повышает возможности организма к адаптации
· Патологическая (биологически нецелесообразная), возникающая в результате нарушений в периферическом или центральном звеньях систем проведения, или контроля болевой чувствительности. Снижает способность организма к адаптации. К патологической боли относят: невралгии, каузалгии, фантомные боли, таламические боли (таламический синдром).
4. По характеру и качеству субъективных ощущений:
Режущая Колющая Ноющая и пр.
5. По локализации: Зубная Головная Желудочная Лицевая Кожная и пр.
Механизм боли
Три основные теории о механизме периферического кодирования болезненных стимулов:
1. Теория специфичности
2. Теория интенсивности
3. Теория распределения импульсов
Из них только первая получила экспериментальное подтверждение.
На настоящий момент принята за основу теория специфичности, согласно которой боль имеет собственные рецепторы (ноцицепторы), собственные проводящие пути и нервные центры.
Теория интенсивности. Считается, что она тоже имеет место нескольких процентах случаев. Согласно этой теории, боль воспринимают не только ноцицепторы, но и обычные механо-, термо- и хеморецепторы, если воздействие на них превышает пороговое значение. На эту теорию можно наслоить теорию распределения импульсов, согласно которой, если на обычные рецепторы воздействовать стандартным раздражением, то проводятся одиночные импульсы, а если действует сверхсильное (болевое) раздражение, то импульсы идут пачками, из-за чего данное раздражение передается как боль.
Проводящие пути
Ноцицептивный сигнал, распространяюсь по А-дельта и С волокнам, через чувствительный нейрон спинального ганглия поступает в задние рога спинного мозга. А и С волокна характеризуются разной скоростью проведения импульсов: А – до 30 м\с, С – до 2 м\с. Считается, что по А-дельта волокнам проводится первичная боль, а по С волокнам – вторичная.
В задних рогах СМ А-дельта и С волокна заканчиваются желатинозной субстанцией (2 нейрон). Из клеток задних рогов берут начало восходящие пути, идущие в составе бокового канатика, которые являются основными проводниками ноцицептивной информации в ГМ.
Спинно-таламический путь проводит болевой сигнал в вентробазальный комплекс таламуса и соматосенсорную зону коры и участвует в формировании первичной боли.
По Спинно-ретикулярному пути ноцицептивный поток направляется в интраламинарную и заднюю группу ядер таламуса, в гипоталамус, диэнцефалические структуры, соматосенсорные области коры больших полушарий. Этот путь принимает участие в передаче информации и формировании ощущений вторичной боли с участием реакции эндокринной, ССС систем, дыхания, мотиваций и защитной реакции.
При болевом воздействии ноцицептивный поток передается из СМ практически во все структуры головного мозга: ядра РФ, центрального околоводопроводного серого вещества, таламуса, гипоталамуса, лимбическую систему и колу больших полушарий. Этим объясняется изменение функций различных органов и систем при действии болевого раздражителя. Болевое раздражение активирует таламус и гипоталамус, где происходит выброс рилизинг-факторов. Они воздействуют на гипофиз и надпочечники, стимулируя выброс катехоламинов и взывают активацию всей симпатоадреналовой системы. Это проявляется усилением дыхания, повышением АД, увеличением ЧСС, гипергликемией, расширением зрачков и др. реакциями.
Контроль и регуляция боли осуществляется за счет взаимодействия ноцицептивной и антиноцицептивной систем.
Антиноцецептивная система. (АНЦС)
АНЦС – система, участвующая в регуляции порога болевых ощущений и выраженности болевой реакции. Основными элементами являются: серое околоводопроводное вещество среднего мозга и моста, окружающее Сильвиев водопровод. Нейроны этой обрасти посылают свои импульсы к ядру шва, тонкому вытянутому ядру, локализованным в нижних отделах моста и верхних отделах продолговатого мозга. Отсюда сигналы передаются в антиноцицептивный комплекс, локализованный в задних рогах СМ. В этом комплексе антиноцицептивные сигналы из центра блокируют болевую импульсацию до того, как она достигает головного мозга.
АНЦС является СЛМ, то есть ограничивающей негативное влияние стресса на организм. К непосредственным механизмам, активирующим центральные ядра АНЦС относятся:
· Болевая импульсация, поступающая в соотв. центры по спиномезенцефалическому тракту, который, как и спиноталамический, образован аксонами нейронов заднего рога СМ;
· Импульсация со стороны вышележащих отделов ГМ, возбуждаемых стрессовыми факторами (симпатические ядра гипоталамуса и др.
· ИЛ-1 и ФНО, циркулирующие в крови при сильном воспалительном процессе.
Существуют несколько медиаторов АНЦС, особенно следует отметить энкефалины, эндорфины и серотонин.
Многие нервные волокна, начинающиеся в перивентрикулярном ядре и околоводопроводном сером веществе, оканчиваются синапсами на нейронах ядра шва и выделают энкефалины. Волокна, которые берут начало в ядре шва и достигают энкефалинергических нейронов в задних рогах СМ, секретируют серотонин. Энкефалинергические нейроны образуют синапсы на А-дельта и С волокнах. Считается, что энкефалины блокируют входящий кальциевый ток в синаптических окончаниях. Так как входящий ток кальция необходим для выделения нейромедиатора из нервных окончаний, блокада Са-каналов ведет к развитию пресинаптического торможения.
Эндорфины выделяются клетками гипоталамуса, их продукция контролируется кортикотропин-рилизинг фактором. Его высвобождение стимулируется норадренаином, адреналином, серотонином и гистамином, тормозится – дофамином. Эндорфины блокируют образование ноцицептивных импульсов в хемоноцицепторах, уменьшая содержание брадикинина и блокируя действие простагландинов, увеличивают активность нейронов серого околоводопроводного вещества и тормозят нейроны дорсального рога. Таким образом, опиоидные пептиды блокируют поток болевой импульсации на всех уровнях ее проведения – рецепторах в СМ и ГМ.
Биологическое значение боли
Выделяют 2 аспекта:
· Боль является ценным эволюционным приобретением. Первичная боль позволяет своевременно и быстро реагировать на разрушительное внешнее воздействие. Вторичная боль формирует поведенческие реакции, заставляющие оберегать поврежденное место, источник боли), создавая тем самым оптимальные условия для восстановления повреждённой структуры и нарушенной функции. Боль активирует комплекс защитных реакций, направленных на восстановление гомеостаза.
· Боль становится причиной патологии в организме, если сопровождающие ее реакции, особенно вегетативные (со стороны ССС, дыхат. систем и крови), чрезмерны по своей выраженности. В этом случае вместо приспособительной реакции в тканях возникает гипоксия, нарушение обмена, ведущие к нарушению гомеостаза. Кроме того, боль может быть сопутствующим компонентом патол. процесса, с которым организм не в состоянии справится (злокачественная опухоль), либо сопровождает патологию ЦНС, усугубляющим болезнь. Боль вызывает перенапряжение адаптационных систем организма, вызывая их срыв, и приводит к нарушению гомеостаза. Такую биологически нецелесообразную боль принято называть патологической.
Патологическая боль
Носит хронический характер и приводит к дезинтеграции адаптационных процессов. Хроническая боль обусловлена пат. процессами в периферических и центральных отделах НС. Она с течением времени приводит к нарушениям нейроэндокринной регуляции и маршрутов импульсов. Нарушения могут возникать на разных уровнях:
Теории патологической боли
1) Теория нейроматрикса. Согласно этой теории, в нервной системе в области ретикулярной формации присутствует функционально связанная между собой нейрональная сеть, которая отвечает за целостность тела и называется нейроматриксом. Если эта сеть не получает информацию от части тела, то данная система формирует болевой болевой сигнал, в результате может ощущаться боль в ампутированной конечности.
2) Теория генераторных механизмов. В самой ноцицептивной системе могут формироваться очаги повреждения, которые генерируют импульсы, воспринимаемые как болевые ощущения от того участка, за который отвечает данная часть ноцицептивной системы.
Основные формы болевых синдромов.
Фантомные боли – возникают у больных после ампутации конечностей. Создается впечатление, что болит то место, которого на самом деле уже нет (но которое болело в прошлом при наличии конечности). Боли имеют периферическое происхождение: любой сенсорный вход усиливает фантомные боли, слабый сенсорные импульсы способствуют проявлению боли.
Каузалгия – синдром, развивающийся после повреждения периферического нерва и обусловленный раздражением его симпатических волокон; характеризуется интенсивными жгучими болями, а также сосудистыми и трофическими нарушениями в зоне иннервации пораженного нерва. Основная черта каузалгии – неослабевающая интенсивность, боль усиливается с любых рецепторных зон.
Невралгия – интенсивная боль, связанная с повреждением периферических нервов (особенно толстых миелинизированных волокон), распространяющаяся по ходу ствола нерва или его ветвей, иногда с гипер- или гипостезией в зоне иннервации.
Таламический синдром – боли, возникающие в противоположной половине тела при патологическом процессе в одном из зрительных бугров.
Основные типы боли.
Проецируемая боль – возникает при повреждении крупного нервного ствола в зоне его иннервации. Например, при ударе по локтевому нерву в месте, где он проходит под кожей, вызывает неприятные болезненные ощущения в областях, снабжаемых нервом. Это происходит потому, что активация афферентных нервных волокон у локтя, проецируется в соответствующие области ЦНС. Таким образом, при проецируемой боли место, на котором действует вредящий стимул, не совпадает с местом, где эта боль ощущается.
Отраженная боль – ощущение, вызываемое ноцицептивным раздражением внутренних органов, часто локализуется не в данном органе (или не только в нем), а в отдельных поверхностных участках. Она отражается всегда на участке периферии, иннервируемым тем же сегментом СМ, что и пораженный внутренний орган.
Термин происходит от французского choс – удар, толчок.
Шок – сложный патологический процесс, возникающий при действии на организм экстремальных факторов внешней или внутренней среды, которые наряду с первичным повреждением вызывают чрезмерные и неадекватные реакции адаптивных систем, особенно САС, стойкие нарушения нейро-эндокринной регуляции, гомеостаза, особенно гемодинамики, микроциркуляции, кислородного режима организма и обмена веществ.
Сущность процесса «шок» - несогласованные изменения в обмене веществ, его циркуляторном обеспечении, возникающие вследствие расстройств нервной и гуморальной регуляции. Это патология дисрегуляции.
Шок – остро развивающийся, угрожающий жизни патологический процесс, обусловленный действием на организм сверхсильного патогенного раздражителя и характеризующийся тяжелыми нарушениями функций ЦНС, сердечно-сосудистой, дыхательной, эндокринной и других жизненно важных систем. Выход пациента из шокового состояния возможен только при проведении экстренных и эффективных лечебных мероприятий.
Этиология шока
|
- огнестрельные ранения; - тяжелые механические травмы; - распространенные ожоги; - переливание несовместимой крови; - массивная кровопотеря; |
- попадание в сенсибилизированный организм аллергенов; - значительная ишемия или некроз органов (сердца, почек, печени, кишечника). |
Основным звеном патогенеза всех видов шока является генерализованная гипоперфузия, приводящая к циркуляторной гипоксии, но начальное звено патогенеза у различный видов является также различным.
По начальному звену патогенеза выделяют следующие виды шока:
-гиповолемический - возникает из-за ↓ объема циркулирующей крови (ОЦК)
-кардиогенный - возникает из-за нарушения насосной функции сердца
-сосудистый шок - развивается вследствие ↓общего периферического сопротивления сосудов (ОПСС)
В развитие шока выделяют 3 стадии:
1) Эректильная (стадия компенсации)
2) Торпидная (стадия декомпенсации)
3) Необратимая (терминальная)
Общий патогенез и проявления шока
Независимо от тяжести клинических проявлений для шока характерно развитие 2-х последовательно развивающихся стадий: первоначальное распространенное возбуждение нейронов (стадия адаптации – эректильная стадия), а в дальнейшем – распространенное угнетение их активности (стадия декомпенсации – торпидная стадия). Фазные изменения активности цнс связаны с сильным раздражением экстеро-, интерорецепторов, повреждением нервных проводников, сплетений или ткани мозга. При шоке сознание сохраняется, но может быть затемнено, особенно в торпидную стадию, но оно не утрачивается полностью.
В эректильную стадию – стадию адаптации (компенсации) – увеличивается активность симпатико-адреналовой и гипофизарно-надпочечниковой систем, биологически активные вещества которых усиливают обмен веществ и стимулируют деятельность органов. Усиливается работа сердечно-сосудистой системы – увеличивается частота сердечных сокращений, повышается артериальное давление, уменьшается объем циркулирующей крови в почках, пищеварительном тракте, коже и мышцах, но увеличивается в мозге и сердце. Возрастает частота дыхания. Усиливается эритропоэз, часто повышается свертываемость крови. Эректильная стадия обычно непродолжительна. В последние годы ее называют адаптивной, компенсаторной, непрогрессирующей, ранней. Основными звеньями патогенеза в эту стадию являются: нейроэндокринное звено (избыточная импульсация экстеро- и энтерорецепторов, генерализованная активация нервной и эндокринной систем, гиперфункция и дисфункция физиологических систем и органов); гемодинамическое звено (нарушение центральной, органной и тканевой микроциркуляции); метаболическое звено (преобладания катаболических процессов в тканях); гипоксическое и токсемическое звенья (расстройства гемодинамики, гипоксия, интоксикация). Если процессы адаптации недостаточны, развивается вторая торпидная стадия.
В торпидную стадию – стадию декомпенсации – развиваются:
- снижение активности симпатико-адреналовой системы;
- падает уровень кортикостероидов;
- психическая и двигательная заторможенность, спутанность сознания, гипорефлексия, неэффективная нейроэндокринная регуляция;
- сердечная недостаточность, аритмии, артериальная гипотензия и коллапс, перераспределение кровотока, капилляротрофическая недостаточность;
- дыхательная недостаточность («шоковое легкое»);
- депонирование крови, изменение вязкости крови, ДВС-синдром;
- почечная недостаточность («шоковые почки»);
- печеночная недостаточность («шоковая печень»).
В процессе развития шока нередко возникают так называемые порочные круги: так, расстройство деятельности цнс приводит к нарушению дыхания и кровообращения. Угнетение этих жизненно важных функций вызывает развитие гипоксии, которая утяжеляет расстройства деятельности цнс. Таким образом, круг патологических реакций замыкается.
При шоке некоторые органы повреждаются особенно часто «шоковые органы», от тяжести их повреждения зависит жизнь больного. В «шоковом легком» нарушается микроциркуляция, это приводит к кровоизлияниям и ателектазам. При этом снижается перфузия крови через легочные капилляры, нарушается проницаемость альвеолярно-капиллярных мембран для кислорода и углекислого газа. Острое расстройство кровообращения в легком способствует развитию отека легких, что сопровождается углублением гипоксии.
В почках снижается кровоток в корковом слое, это обусловлено тем, что при ишемии почек в кровь выбрасываются вещества, вызывающие спазм артериол, в результате улучшается кровообращение мозга и сердца. Однако, ишемия самих почек приводит к развитию дистрофических изменений эпителия канальцев. Клетки эпителия слущиваются в просвет канальцев и закупоривают их. «Шоковые почки» имеют характерный вид: корковый слой бледный, пирамиды полнокровны и потому имеют буро-коричневый цвет. Четко видна граница между корковым и мозговым слоем. Длительная ишемия приводит к гибели почечной ткани, развивается корковый некроз почек, и они перестают функционировать.
Основными звеньями патогенеза в эту стадию развития шока являются:
- нейроэндокринное звено (нарушение нейроэндокринной регуляции и интеграции систем организма, распад физиологических систем организма);
- гемодинамическое, гипоксическое, токсемическое, метаболическое звенья (нарушение гемодинамики, гипоперфузии органов и тканей, нарушения микроциркуляции, развитие гипоксии и токсемии, сопровождающиеся нарушением метаболизма – усиление процессов катаболизма);
- клеточное звено (повреждение клеток и нарушение межклеточного взаимодействия, прогрессирующее угнетение жизнедеятельности организма).
В 3-ю стадию гипоксическое повреждение внутренних органов становится необратимым, развивается полиорганная недостаточность. Гипоксическое повреждение ЦНС приводит к гипоксической коме, возникает сердечная, печеночная и почечная недостаточность.
Гиповолемический шок. Возникает из-за несоответствия объема циркулирующей крови емкости сосудистого русла вследствие ↓ОЦК. Этот шок называют холодным из-за того, что при этом шоке наиболее выражена централизация кровообращения, из-за которой кожные покровы становятся бледными и холодными.
Виды гиповолемического шока:
1) Геморрагический – возникает в результате острой кровопотери (при кровопотере 25% всей крови – ок.500 мл)
2) Ожоговый шок – возникает из-за плазмопотери через ожоговую поверхность.
3) Шок при дегидратации – из-за потери воды и электролитов.
4) Травматический – из-за острой кровопотери и плазмопотери.
Патогенез гиповолемического шока описан в стадиях шока. Особенности ожогового шока и шока при дегидратации заключаются в том, что из-за потери жидкости или плазмы происходит сгущение крови, что приводит к ↑ вязкости и еще более усугубляет цикуляторную гипоксию. Травматический шок также относится к гиповолемическому т.к. развивается из-за острой кровопотери и плазмопотери из поврежденных капилляров при размозжении тканей. Течение травматического шока усугубляют:
1) Боль – т.к. сильная боль вызывает угнетение сосудисто-двигательного центра, что может вызвать расширение сосудов и децентрализацию кровообращения.
2) Жировая эмболия – которая развивается при переломах трубчатых костей и приводит к нарушению периферического кровообращения.
3) Образование медиаторов воспаления - из-за массивного повреждения тканей, которые расширяют сосуды и ↑ их проницаемость, тем самым еще больше усугубляя циркуляторную гипоксию.
Кардиогенный шок. Возникает из-за нарушения насосной функции сердца при острой сердечной недостаточности. Причины (инфаркт миокарда, миокардиты, аритмии, травма сердца, тампонада сердца). Кардиогенный шок самый тяжелый вид шока, приводит к летальности в 80% случаев из-за развития порочного круга в первую стадию шока. Порочный круг развивается из-за того, что защитные механизмы, направленные на компенсацию гемодинамики гиповолемического шока, еще больше усугубляют нарушения.
Порочный круг при кардиогенном шоке.
При нарушении насосной функции сердца происходит снижение сердечного выброса (или систолического объема), что приводит к снижению МОК, в результате чего падает САД. В ответ на это активируется САС, что сопровождается централизацией кровообращения. Перераспределение крови из периферических сосудов в центральный приводит к увеличению центрального венозного давления, и возрастает венозный возврат к сердцу. Из-за активации РАС повышается продукция альдостерона и АДГ, что приводит к ↑ задержки жидкости, ↑ ОЦК, и еще больше ↑ венозный возврат к сердцу. Увеличение ВВ к сердцу приводит к перегрузке сердца объемом, его дилатации и еще большему нарушению насосной функции сердца.
(нарушение насосной функции сердца → ↓СО → ↓МОК → ↓САД → ↑САС → ↑ВВ →перегрузка сердца объемом).
Сосудистый шок. Развивается из-за несоответствия ОЦК емкости сосудистого русла вследствие ↓ОПСС. Особенностью сосудистого шока является отсутствие первой стадии (централизации кровообращения), т.к. начальным звеном патогенеза является децентрализация кровообращения.
К сосудистым видам шока относят:
1) Нейрогенный
2) Анафилактический
3) Септический
Нейрогенный возникает из-за нарушения нервной регуляции сосудистого тонуса. Причинами могут быть травма головного мозга, ишемический и геморрагический инсульты, травма спинного мозга, неправильно проведенная спинномозговая анестезия, угнетение сосудисто-двигательного центра наркотическими веществами и лекарственными препаратами. Из-за нарушения симпатической регуляции сосудистого тонуса возникает децентрализация кровообращения, что приводит к ↓САД, развитию циркуляторной гипоксии и полиорганной недостаточности.
Анафилактический развивается по 1 типу аллергический реакций. Причиной является введение лекарственных препаратов, либо массивное поступление аллергена с пищей или ингаляционно. При первичном поступлении аллергена в организм происходит синтез Ig E, который фиксируется на поверхности тучных клеток по ходу всего сосудистого русла. Вторичное поступление аллергена приводит к его взаимодействию с Ig E на поверхности тучных клеток, из-за чего развивается дегрануляция тучных клеток и выделение гистамина, который расширяет сосуды, что приводит к ↓ ОПСС и децентрализации кровообращения. Также гистамин ↑ проницаемость сосудистой стенки, из-за чего жидкость перераспределяется из сосудов в интерстициальное пространство, что сопровождается ↓ ОЦК. Из-за децентрализации кровообращения и перераспределения жидкости происходит ↓ САД, развивается циркуляторная гипоксия и полиорганная недостаточность.
Септический (инфекционно-токсический) развивается при сепсисе, чаще вызванном Грамм отриц. флорой (но может и Г+). Пусковым моментом в развитии септического шока является циркуляция в крови эндотоксинов. Под действием эндотоксинов запускается продукция всех медиаторов воспаления. В первую очередь эндотоксины активируют систему комплимента по альтернативному пути. При активации системы комплимента активируются остальные протеазные системы крови, образование брадикинина вызывает расширение сосудов и ↑ проницаемости. Активированные свертывающая система и фибринолиза способствуют развитию ДВС- синдрома, который усугубляет течение септического шока, из-за чего он является вторым по тяжести после кардиогенного. Помимо брадикинина основными медиаторами, ответственными за развитие септического шока, являются цитокины (ИЛ-1, ФНО-β). Они расширяют сосуды и ↑ их проницаемость, из-за чего ↓ САД, развивается циркуляторная гипоксия и полиорганная недостаточность. Этот шок называют горячим, т.к. из-за расширения периферических сосудов и лихорадки кожные покровы становятся горячими и гиперемированными.
Принципы противошоковой терапии:
- по возможности устранить причину;
- снизить токсемию (применение антидотов);
- устранить болевой синдром;
- устранить гиповолемию и нарушения водного баланса (переливание консервированной крови, плазмы и других жидкостей);
- восстановить электролитной и кислотно-основной баланс;
- устранить дыхательную недостаточность (искусственная вентиляция легких);
- восстановить реологические свойства крови (реополиглюкин, маннитол);
- стабилизировать состояние стенок микрососудов и других биологических мембран (глюкокортикоиды, витамины, препараты кальция и другие мембраностабилизаторы);
- подавить свободнорадикальные и липопероксидные процессы (антиоксиданты);
- устранить гипоксию (антигипоксанты).
КОМАТОЗНЫЕ СОСТОЯНИЯ
Кома (греч. koma – глубокий сон) – крайне тяжелое состояние организма, характеризующееся глубоким угнетением центральной нервной системы, стойкой потерей сознания утратой реакций на внешние, в том числе болевые, раздражители любой интенсивности. Как и при других видах экстремальных состояний - ЭС, при коме развиваются расстройства метаболизма и нарушения регуляции многих жизненно важных функций организма.
Кома отличается от других видов ЭС по основному критерию – полной и стойкой утратой сознания.
Этиология и классификация коматозных состояний
Причины коматозных состояний разделяют на:
- экзогенные (внешние) связаны с действием факторов среды обитания;
- эндогенные связаны с возникающими в организме нарушениями и являющиеся их осложнениями.
К коматозным состояниям вызванными экзогенными факторами относятся:
- травматическая кома (повреждение головного мозга внешним механическим воздействием);
- гипо- и гипертермическая кома (общее охлаждение, перегревание, солнечный удар);
- экзотоксическая (отравление алкоголем, промышленными ядами, окисью углерода, лекарственными препаратами, грибами);
- алиментарная (при тяжелом голодании);
- гипоксическая (при дефиците кислорода во вдыхаемом воздухе);
- лучевая (при воздействии больших доз ионизирующего излучения).
Эндогенные коматозные состояния могут возникать при неблагоприятном течении многих заболеваний, при расстройствах функций различных органов и систем, неблагоприятных сдвигах важных параметров внутренней среды.
Причины эндогенных ком:
- прямое повреждение головного мозга (геморрагический и ишемический инсульт, отек мозга, опухоль, абсцесс, эпилепсия);
- общие и местные расстройства кровообращения, приводящие к гипоксии мозга (гипоксическая кома);
- нарушения системы крови (нарушение эритропоэза, гемолиз эритроцитов, кровопотеря – анемическая, гемолитическая кома);
- нарушение функций дыхательной системы (астматическая, асфиксическая кома);
- нарушение функций эндокринной системы (диабетическая, гипофизарная, тиреотоксическая кома);
- нарушения выделительной системы (уремическая кома);
- нарушения параметров внутренней среды (гипогликемическая, гиперосмолярная, ацидотическая, дегидратационная кома);
- отдельные болезни (малярийная, холерная, микседематозная кома).
Стадии, проявления, основные механизмы развития
Коматозные состояния могут развиваться молниеносно. В этих случаях происходит внезапная потеря сознания и возникают все признаки комы. Такая разновидность комы развивается при травмах головы, инсультах, эпилепсии и других состояниях. Чаще кома развивается постепенно и проходит несколько стадий развития.
Первая стадия (начальная) характеризуется беспокойством, нарушением сна, нарушением координации движений, изменениями электроэнцефалограммы.
Вторая стадия – прекома характеризуется сонливостью, спутанностью сознания, ослаблением реакции на внешние раздражители, в том числе болевые.
Третья стадия – неглубокая кома – сопор (лат. sopor – оцепенение, вялость) характеризуется потерей сознания, которое может проясняться, иногда непроизвольное мочеиспускание и дефекация.
Четвертая стадия – глубокая кома – характеризуется: полной потерей сознания, арефлексией, выпадением роговичного и зрачкового рефлексов, гипотензией, сердечной аритмией, периодическим дыханием, падением температуры тела, развитием центральных параличей, депонированием крови, изменением вязкости крови, развитием ДВС-синдрома, почечной и печеночной недостаточностью, недостаточностью полостного и мембранного пищеварения, кишечной аутоинтоксикацией и аутоинфекцией.
Продолжительность комы может длиться часами и даже сутками. В неблагоприятных случаях кома переходит в терминальное (агональное) состояние и заканчивается смертью.
Механизмы развития комы
В возникновении коматозных состояний лежит несколько общих механизмов.
Интоксикационный – связан с действием экзогенных ядов или токсических продуктов обмена веществ, подлежащих удалению из организма. Отравление окисью углерода приводит к ишемической гипоксии, алкоголь и продукты его обмена угнетают центры дыхания и кровообращения. Угнетение этих центров возникает при введении больших доз снотворных и наркотических веществ. При нарушении выделительной функции почек в крови накапливаются производные аммиака (фенол, индол). При недостатке в организме инсулина в крови накапливаются кетокислоты (ацетоуксусная, b-оксимасляная).
Гипоксический и энергетический дефицит нейронов головного мозга. Гипоксия может быть главной причиной развития комы (например, при коллапсе, отравлении окисью углерода), но чаще развивается вторично в процессе развития коматозного состояния. Может возникать в результате угнетения тканевого дыхания, или нарушения свойств крови.
Нарушение кислотно-основного состояния внутренней среды организма, из них частое и наиболее важное развитие ацидоза.
Нарушение электролитного баланса (увеличение внеклеточного калия (гиперкалиемия) и гипонатриемия.
Расстройства водного обмена. При уремической коме в результате задержки натрия в клетках возникает гипергидратация клеток, угрожающая развитием отека мозга. При наличии диареи (понос) и часто возникающей рвоты может возникнуть внеклеточная гипогидратация.
Характерными для различных коматозных состояний являются нарушения кровообращения, особенно микроциркуляции в головном мозге, угнетение дыхания и развитие периодического дыхания Чейна-Стокса и патологического дыхания Куссмауля, что нередко приводит к гибели больного.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.