
Взаимное влияние атомов в молекулах органических соединений.
Взаимное влияние атомов в молекулах органических соединений описывают с помощью пространственных и электронных эффектов.
Первые определяют доступность реакционных центров в молекуле. А под термином «электронные эффекты» понимают смещение электронной плотности в молекуле под влиянием заместителей. Это влияние может передаваться двумя путями: индуктивным и мезомерным.
Индуктивный эффект.
Под индуктивным эффектом понимают перераспределение электронной плотности по системе σ-связей. Он возникает из-за разной электроотрицательности атомов, образующих σ-связь.
Обозначается индуктивный эффект буквой I (ай).
Графически индуктивный эффект изображают стрелкой, совпадающей с σ-связью и направленной в сторону более электроотрицательного атома.
δ+ δ-
Пр: Н→ Cl
Индуктивный эффект может быть положительным (обозначается +I) и отрицательным (обозначается -I).
Отрицательным индуктивным эффектом обладают заместители, которые смещают электронную плотность σ-связи к себе. Такие заместители содержат атомы с большей электроотрицательностью, чем атом углерода.
К ним относятся например: галогены, гидроксигруппа (-ОН), аминогруппа (-NH2), карбоксильная группа (-СООН) и др. функциональные группы, а также катионы.
Пр: этанол
Н Н
↓ ↓
Н→С→С→ОН} –I/ ЭА эффект затухает.
![]() ↑ ↑
↑ ↑
Н Н подвижны.
Т.к. электроотрицательность атома кислорода больше электроотрицательности атома углерода, следовательно атом кислорода смещает электронную плотность к себе. Значит –ОН группа обладает –I.
Наличие в молекуле полярной σ-связи, приводит к возникновению частичных зарядов, за счёт поляризации ближайших σ-связей. Из-за слабой поляризуемости σ-связей индуктивный эффект затухает на третьем, четвёртом атоме в углеродной цепи.
Такие заместители понижают электронную плотность системы и их называют электроноакцепторами (обозначают заглавными буквами ЭА).
Положительным индуктивным эффектом обладают заместители, которые смещают электронную плотность от себя, в сторону атома углерода.
К ним относятся например: углеводородные радикалы, отрицательно заряженный атом кислорода (-О-), анионы, металлы.
Пр: 1) пропен-1
sp3 sp2
![]() Н3С→НС = СН2 Электроотрицательность
Сsp3 меньше
э.о. Сsp2,
Н3С→НС = СН2 Электроотрицательность
Сsp3 меньше
э.о. Сsp2,
+I/ ЭД следовательно –СН3 группа будет отталкивать (смещать) электронную плотность от себя, т.е. обладает +I.
Такие заместители повышают электронную плотность системы и называются электронодонорами (ЭД).
2) этоксид-анион (этоксид ион)
![]() δ-
δ- - Кислород обладает повышенной
электронной
δ-
δ- - Кислород обладает повышенной
электронной
![]() Н3С←СН2←О плотностью
и следовательно смещает от себя
Н3С←СН2←О плотностью
и следовательно смещает от себя
![]() +I/ ЭД электроны.
+I/ ЭД электроны.
Мезомерный эффект.
В отличие от индуктивного, мезомерный эффект встречается только в сопряжённых системах.
Мезомерный эффект – это перераспределение электронной плотности по сопряжённой системе (или по системе π-связей).
Обозначается заглавной буквой М.
Мезомерный эффект также может быть: положительным (обозначают +М) и отрицательным (обозначают -М).
Отрицательным мезомерным эффектом обладают заместители, содержащие в своём составе π-связь.
![]()
![]() К ним относятся: О
К ним относятся: О
![]() Карбонильная (альдегидная): - С
Карбонильная (альдегидная): - С
Н
![]()
![]() О
О
![]() Карбоксильная: - С
Карбоксильная: - С
ОН
![]()
![]() О
О
![]()
![]()
![]() Сульфогруппа: - S ОН = SО3Н
Сульфогруппа: - S ОН = SО3Н
О
![]()
![]() + О
+ О
![]() Нитрогруппа: - NO2 = - N
Нитрогруппа: - NO2 = - N
О─
Цианогруппа: - С≡N
Данные заместители смещают электронную плотность по сопряжённой системе к себе.
![]()
![]() Пр:
пропеналь
Пр:
пропеналь
![]()
![]()
![]() δ+ δ+ Оδ-
δ+ δ+ Оδ-
![]() Н2С=СН─С –I;–М/
ЭА
Н2С=СН─С –I;–М/
ЭА
Н
Карбонильная группа проявляет отрицательный индуктивный эффект, т.к. электроотрицательность атома кислорода больше электроотрицательности атома углерода.
Есть ли сопряжение?
В молекуле возникает π,π-сопряжение (единое π-электронное облако), которое смещается к более электроотрицательному атому кислорода.
Графически отрицательный мезомерный эффект изображается изогнутой стрелкой от середины π-связи к середине σ-связи. И передаётся без затухания. Все заместители с отрицательным мезомерным эффектом обладают и отрицательным индуктивным эффектом. Поэтому они являются электроноакцепторами.
Положительным мезомерным эффектом обладают заместители, содержащие атом с неподелённой электронной парой на р-орбитали, способной вступать в сопряжение.
![]() К
ним относятся:
К
ним относятся:
- ОН
- NH2, - NH─R, - N─R –I<+М
׀
R электронодоноры (ЭД)
- алкокси: - ОR
- меркапто: - SН
- алкилтио: - SR
- анион кислорода: - О─ +I+М
![]()
![]()
галогены: -Cl, - Br и т.д. –I>+М электроноакцепторы (ЭА)
Для данных заместителей характерно р,π-сопряжение.
Пр: этенамин
![]()
![]() δ-
δ+
δ-
δ+
![]() Н2С=СН→NH2
Н2С=СН→NH2
–I<<+М/ЭД
Графически положительный мезомерный эффект изображают изогнутой стрелочкой от неподелённой электронной пары к середине σ-связи.
Если заместитель обладает отрицательным индуктивным эффектом, но положительным мезомерным эффектом, то его действие будет зависеть от величины индуктивного и мезомерного эффектов:
1. т.к. мезомерный эффект передаётся по сопряжённой системе без затухания в отличие от индуктивного, то следовательно +М>–I.
В таком случае заместитель проявляет электронодонорное действие.
Рассмотрим действие эффектов на примерах:
1) этенамин (см. выше)
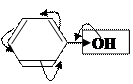
2) фенол
![]()
![]()
–I<+М/ЭД ↑ ē ρ кольца
Вывод по фенолу и этенамину: т.к. электроотрицательность атома азота меньше электроотрицательности атома кислорода, следовательно атом азота лучше отдаёт свою пару электронов в сопряжение, а значит его положительный мезомерный эффект в несколько раз больше индуктивного, чем у атома азота.
3) N-метиланилин

–I<<<+М/ЭД
2. Если отрицательный индуктивный больше положительного мезомерного, то заместитель проявит электроноакцепторное действие.
Пр: галогены
δ+ δ-![]()
![]()
![]() Н2С=СН→Cl
Н2С=СН→Cl
–I>+М/ЭА ↓ē ρ π-связи
Т.к. галогены наиболее электроотрицательные элементы и лучше контролируют свои электроны, следовательно, хуже отдают их в сопряжение.
3. Если заместитель обладает положительным индуктивным и положительным мезомерным, то он проявляет электронодонорное действие.
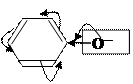
Пр: фенолят ион
![]()
+I+М/ЭД т.к. кислород в sp2- сопряжении, то электроны находящиеся на р-орбитали будут участвовать в р,π-сопряжение.
Влияние заместителей на реакционную способность органических соединений.
Алкены вступают в реакции присоединения, при этом атакующим реагентом является положительно заряженная частица – электрофил. Данная частица имеет сродство к π-электронному облаку. Реакционная способность алкенов зависит от величины электронной плотности в области π-связи. Чем выше плотность, тем выше реакционная способность.
Электронодонорные заместители повышают электронную плотность π-связи, следовательно, повышают реакционную способность.
Электроноакцепторные заместители наоборот, понижают электронную плотность π-связи и понижают реакционную способность.
Задача: Сравнить реакционную способность: пропена, этена и хлорэтена (в строку писать).
![]()
![]()
![]() sp3 sp2δ+ δ-
sp2 sp2 δ+
δ-
sp3 sp2δ+ δ-
sp2 sp2 δ+
δ-
![]()
![]() Н3С→НС
= СН2 > Н2С = СН2 > Н2С=СН→Cl
Н3С→НС
= СН2 > Н2С = СН2 > Н2С=СН→Cl
+I/ЭД ē ρ распределена –I>+М/ЭА
↑ ē ρ π-связи равномерно ↓ē ρ π-связи
![]()
![]() ↑ р.с. ↓
р.с.
↑ р.с. ↓
р.с.
по правилу против правила
Марковникова Марковникова
Ароматические соединения вступают в реакцию замещения, при этом атакующим реагентом также является электрофил. Поэтому реакционная способность зависит от величины электронной плотности π-электронного облака.
Электронодонорные заместители повышают электронную плотность ароматического кольца, следовательно, увеличивают реакционную способность и облегчают реакции замещения.
Электроноакцепторные заместители наоборот, понижают электронную плотность кольца и затрудняют реакции замещения.
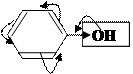
Задача: Сравнить реакционную способность: фенола, бензола, бензальдегида.

>
![]()
![]() равномерно
равномерно
–I<+М/ЭД –I;–М/ ЭА
↑ ē ρ кольца ↓ē ρ кольца
↑ р.с. ↓ р.с.
Направление реакции в бензольном кольце будет зависеть от ориентирующего действия заместителей.
Все заместители по ориентирующему действию делятся на заместители ⅠиⅡрода.
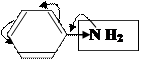
К заместителям Ⅰрода относятся заместители, обладающие +М (не зависимо от ЭД или ЭА действия): - ОН, - NH2, галогены;
и обладающие +I: ─R, анион кислорода: - О─
![]()
![]()
![]()
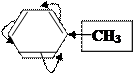
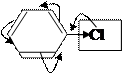
–I<+М/ЭД –I>+М/ЭА +I/ЭД
Ⅰрода Ⅰрода Ⅰрода
За счёт положительных эффектов происходит распределение электронной плотности таким образом, что она увеличивается особенно в орто- (2,6) и пара- (4) положениях.
Поэтому заместитель Ⅰрода направляет другой заместитель в орто- или пара- положения.
К заместителям Ⅱрода относятся: заместители обладающие –М (карбонильная группа, карбоксильная и др.)
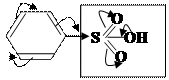
![]()
![]() За счёт –М эффекта электронная плотность в
ароматическом кольце понижается, особенно в орто- и пара- положениях. Таким
образом в мета- положении (3,5) она оказывается несколько выше.
За счёт –М эффекта электронная плотность в
ароматическом кольце понижается, особенно в орто- и пара- положениях. Таким
образом в мета- положении (3,5) она оказывается несколько выше.
–I;–М/ ЭА Поэтому заместители Ⅱрода ориентируют другой
Ⅱрода заместитель в мета-положение.
Посмотрим ориентирующее действие заместителей на нескольких примерах:
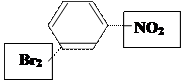
Задача: Можно ли получить один и тот же продукт при бромировании нитробензола и нитровании бромбензола?
1) бромирование нитробензола:

AlBr3
+ Br2 → + HBr
![]()
–I;–М/ ЭА м-бромнитробензол
Ⅱрода в мета-
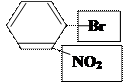 2) нитрование бромбензола:
2) нитрование бромбензола:
![]() H2SO4 + НОН
H2SO4 + НОН
![]()
![]() +
HNO3
+
HNO3
![]()
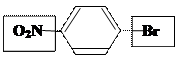
–I>+М/ЭА + HOH
Ⅰрода в орто- и пара- п-бромнитробензол
Вывод: На основе знаний о взаимном влиянии атомов в молекулах органических соединений, мы можем правильно указать эффекты заместителей, а следовательно, и их ориентирующее действие. В результате чего не сложно предсказать направление реакции и прогнозировать продукты реакции.
Примеры:
На основе знаний об электронных эффектах заместителей сравните реакционную способность в реакциях бромирования хлорбензола, бензола и фенола. Для более реакционно способного напишите уравнение реакции.

![]()
![]() <
<
–I>+М/ЭА равномерно –I<+М/ЭД
↓ē ρ кольца ↑ ē ρ кольца
↓ р.с. ↑ р.с.

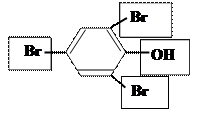 |
+ 3 Br2 → + 3 HBr
2,4,6-трибромфенол плохо растворим в
воде и выпадает в осадок.
Задача:
Сравните реакционную способность в реакциях хлорирования, укажите электронные эффекты заместителей и их ориентирующее действие для: пиридина, бензола, пиррола.


Способы разрыва ковалентной связи.
Для осуществления реакции требуется разрыв старых связей и образование новых. В зависимости от способа разрыва связи определяют механизм реакции.
Существует два способа разрыва ковалентной связи:
1. гомолитический
2. гетеролитический.
Гомолитическим путём разрывается ковалентная неполярная связь. Разрыв осуществляется таким образом, что происходит распаривание электронов, в результате образуются две одинаковые частицы, содержащие неспаренный электрон – свободные радикалы (радикальный распад связи)
Х : Х → Х· + ·Х
Обратный процесс образования ковалентной связи происходит по обменному механизму.
Пр: hν, t0
Cl • • Cl → Cl • + • Cl
Разрыв связи под действием света называется – фотолиз (фотохимический распад).
Разрыв связи под действием температуры называется – термолиз.
Если в молекуле связь порвалась по радикальному механизму, то свободные радикалы, обладая повышенной реакционной способностью атакуют связи в молекулах органических соединений и разрывают их тоже по радикальному механизму.
Полярная ковалентная связь распадается гетеролитически, т.к. атомы, образующие связь, имеют разную электроотрицательность, следовательно, электроны смещаются к более электроотрицательному атому и при разрыве связи уходят к нему.
Пр: δ+ δ- + ─
Н¦→Cl → Нٱ + ׃Cl
Оба иона обладают повышенной реакционной способностью и могут атаковывать молекулы органических соединений с целью образования связи с одним из продуктов разрыва.
Катиону, чтобы приобрести устойчивость, нужно получить электрон от атакуемой молекулы. Такие реагенты называются электрофилы («люблю электрон»). Они атакуют молекулы, имеющие π-электронное облако (т.к. электроны доступны).
Анионы, для стабилизации, должны образовать связь с какой-либо частицей за счёт своих электронов, поэтому они атакуют электрофильные центры органических молекул, т.е. атомы углерода, имеющие дробный положительный заряд (С δ+). Положительный заряд сосредоточен в ядре атома, поэтому анионы атакуют ядро и называются нуклеофильными реагентами («люблю ядро»).
В ходе химических реакций образуются промежуточные частицы. В зависимости от разрыва ковалентной связи они бывают:
- радикалы •СН3
+
- карбкатионы ٱСН3
- карбанионы ׃СН3─
Все частицы активны, т.к. неустойчивы.
В молекуле углеводородов различают Ⅱ
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.