
ФЕРМЕНТЫ - БИОЛОГИЧЕСКИЕ КАТАЛИЗАТОРЫ И
ВИТАМИНЫ
1. Введение.
2. Кинетика ферментативных реакций.
3. Строение и структура ферментов.
4. Механизм действия ферментов.
5. Классификация ферментов.
Литература:
1. Биохимия. Учебник для институтов физической культуры. Под ред. В.В.Меньшикова и Н.И.Волкова. М., ФиС, 1986. Стр. 88-102.
2. Т.Т.Березов, Б.Ф.Коровкин «Биологическая химия». М., «Медицина». 1990. Стр.92-112.
3. А.Ленинджер «Основы биохимии». М., Мир, 1985. Т.1. стр.227-272.
В живом организме постоянно происходит огромное число разнообразных химических реакций. Эти реакции протекают с огромной скоростью, в миллионы раз превышающей скорость подобных реакций в неживой природе. При этом в организме все это происходит при сравнительно низкой температуре и давлении, в ограниченном диапазоне рН среды. Например, распад белков пищи до аминокислот в пищеварительной системе происходит при 37оС за 2-3 ч., в то же время в лаборатории ту же реакцию можно провести в 0,6 н HCI при 105оС в течение 24-72 ч.
Огромная скорость реакции в живых организмах обусловлена присутствием в них ферментов.
Ферменты – это биокатализаторы, образующиеся в клетке и представляющие собой либо простые белки, либо – сложные, содержащие не аминокислотные компоненты. Ферменты, в отличие от обычных химических катализаторов, они строго специфичны, т.е. избирательно катализируют только одну свою реакцию. Ткая высокая специфичность определяется белковой природой их молекулы.
Учение о скорости химических реакции и факторах влияющих на нее называется химической кинетикой. В химической кинетике скорость реакции определяется как изменение концентрации реагирующих веществ, происходящие в единицу времени (моль/л.сек). Скорость реакции зависит от строения молекул реагирующих веществ, их концентрации, давления, температуры, наличия катализаторов и т.д. Например, с повышением температуры на каждые 10оС скорость реакции возрастает в среднем в 2-3 раза. В реакции А + В → С + Д, скорость реакции (V) определяется V=К×(А)×(В). Катализаторы снижают энергии активации.
Вещества, реакции которых ускоряют ферменты, называются – субстратами и обозначаются символом (S).
Кинетика ферментативных реакций, однако, отличается от кинетики химических реакций. В ферментативных реакциях графически зависимость скорости от концентрации субстрата описывается гиперболой, при низких концентрациях субстрата реакция имеет первый порядок (с увеличением концентрации субстрата скорость реакции увеличивается), а при высоких – нулевой (не зависит от концентрации субстрата).
Этот факт был использован Михаэлисом и Ментен для создания в 1913 г. фундаментальной теории ферментативной кинетики. В основе теории лежит предположение о том, что в процессе ферментативной реакции образуется фермент-субстратный комплекс (ЕS), который подвергается химической реакции и разрушается затем до свободного фермента и продуктов реакции:
Е + S = Е S = Е + Р
Зависимость скорости ферментативной реакции от концентрации субстрата описывается уравнением:
S max
V = max ------------- или V = ------- ---
S + Кm Km
1 + ------
S
Константа Михаэлиса (Кm) служит мерой химического средства между ферментом и субстратом, мерой их способности образовывать ферментсубстратный комплекс. Она соответствует концентрации субстрата, при которой скорость реакции (V) равна половине максимальной.
Ферменты, как отмечено выше, являются простыми белками или сложными, содержащие неаминокислотные компоненты. Последние состоят из белка и небелковой части – простетической группы. Простетическая группа получила название – кофермента, а белковая часть – апофермента.
Одной из важных (характерных) черт коферментов является то, что высшие животные организмы не могут их синтезировать и потому коферменты должны поступать в организм с пищей. Витамины, поступающие в организм человека с пищей, в большинстве случаев идентичны коферментам или структурно близки им. А в отдельных случаях некоторые витамины являются коферментами ряда ферментов (пиридоксальфосфат-В6, тиаминпирофосфат-В1, кофермент-А-пантотеновая кислота, НАД и НАДФРР, ФМН и ФАД –В2 и т.д.).
Ферменты, как и белки, имеют сложную пространственную структуру. Не все участки их молекул выполняют одинаковые функции. Некоторые функциональные группы непосредственно участвуют в связывании субстрата и его преобразовании. Их совокупность носит название активного центра. В ферментах, простых белках, активный центр представляет собой как пространственную организацию определенных аминокислот (чаще всего серина, гистидина, цистеина, аргинина, триптофана), а в сложных ферментах и простетическую группу – кофермента.
Ряд ферментов содержат два или более активных центра, т.е. обладают аллостерическими свойствами или содержат аллостерический (регуляторный) центр.Например, Nа, К –АТФаза, Са-АТФаза, фоосфолипазы и т.д.).
Пространственная структура активного центра фермента определяет специфичность его действия – способность ускорять реакции только одного субстрата или группы субстратов, сходных по строению. Различают относительную (групповую) и абсолютную специфичность. Ферменты, обладающие относительной специчностью, ускоряют реакции, характерные для определенных типов химических связей в молекулах различных веществ одного класса. Например, гидролазы – протеинкиназы, амилазы, липазы, нуклеазы и т.д. Ферменты, обладающие абсолютной специфичностью, ускоряют определенный тип реакции единственного субстрата. Так, аргиназа – катализирует только реакцию гидролиза аргинина на орнитин и мочевину.
Механизм действия ферментов состоит в том, что субстрат связывается с активным центром фермента в нескольких точках, образуя ферментсубстратный промежуточный комплекс, который после протекания химической реакции распадается с образованием продуктов и свободного фермента.
S
![]() Е
+ S
Е
+ S ![]() Е Е + Р1
+ Р2
Е Е + Р1
+ Р2
Реакции, катализируемые ферментами, протекают с различными скоростями, зависящими от:
• Количества и активности фермента;
• Концентрации субстрата;
• РН и состава среды;
• Температуры;
• Присутствия активаторов или ингибиторов.
Так как концентрацию ферментов в живой клетке трудно измерить, часто судят об активности ферментов, которая выражается в международных единицах (МЕ), соответствующих активности, превращающей 1 Мкмоль субстрата в мин.
При низких концентрациях субстрата ферментативная реакция протекает в соответствии с кинетикой реакции первого порядка, т.е. ее скорость пропорциональна концентрации субстрата. При высоких концентрациях субстрата реакция имеет нулевой порядок, т.е. фермент насыщен своим субстратом.
Для каждой ферментативной реакции существует оптимальное значение рН среды. Для большинства ферментов рН-оптимум лежит в пределах нейтральных значений рН среды, хотя существуют ферменты, максимальная активность которых проявляются в крайне кислых (пепсин, рН=1) или щелочных (аргиназа печени, рН=10 или некоторые фосфолипазы А2).
Каждая ферментативная реакция протекает наиболее быстро при определенной температуре, т.е. для каждой ферментативной реакции имеется свой температурный оптимум. Для многих ферментов это значение варьирует в пределах 35-40оС, хотя существуют ферменты, оптимальная температура для которых более 60оС. Некоторые кислые фосфолипазы А2 выдерживают кипячение в кислой среде в течение 10-15 мин.
Активаторы и ингибиторы ферментативных реакций – это соединения, ускоряющие и замедляющие ее, соответственно.
Активаторы увеличивают скорость ферментативных реакций, способствуя образования активного центра или фермент-субстратных комплексов. Часто эту роль выполняют ионы металлов: Са2+, Мg2+, Со2+, Мо2+, Fе2+ и др. Активация аллостерических ферментов достигается за счет их взаимодействия с различными органическими соединениями. Чаще всего аллостерический эффектор представляет собой низкомолекулярное вещество, являющееся промежуточным или конечным продуктом биохимического процесса, в котором участвует регуляторный фермент.
Ингибиторы ферментов бывают нескольких типов, среди них наиболее важными являются конкурентные и неконкурентные. Структура конкуренных ингибиторов сходна со структурой субстрата и поэтому они конкурируют с субстратом за место связывания с активным центром фермента. Такие ингибиторы вытесняются избытком субстрата. Неконкурентные ингибиторы реагируют не с активным центром, а с другой, также важной частью молекулы фермента (например, SН-группой), ответственной за поддержание нативной конформации белковой молекулы.
Название ферментов складывается из названия катализируемой реакции или субстрата с добавлением суффикса – аза. Все ферменты, в зависимости от типа катализируемых реакций, разделяются на 6 главных классов. Обычно используются как систематические, так и тривиальные названия ферментов.
1. Оксидоредуктазы – ускоряют окислительно-восстановительные реакции. В зависимости от способа протекания реакции различают следующие подклассы: дегидрогеназы, оксидазы, гидроксилазы и оксигеназы.
![]() Алкогольде- СН3СН2ОН
СН3СНО + 2Н
гидрогеназа
Алкогольде- СН3СН2ОН
СН3СНО + 2Н
гидрогеназа
Этанол ацетальдегид
2. Трансферазы – ускоряют перенос различных атомных групп с одной молекулы на другую. В зависимости от переносимой атомной группы разделяются на подклассы: метилтрансферазы (-СН3), ацилтрансферазы (-
СООН), фосфотрансферазы (-Н2РО4), аминотрансферазы (-NН2) и т.д.
Амино-
RСНО +
Н2NСН2R1
![]() RСООН + NН2СН2P1
трансфераза
RСООН + NН2СН2P1
трансфераза
3. Гидролазы – катализируют гидролитическое расщепление (белков, углеводов, липидов, нуклеиновых кислот) и называются в соответствии с типом разрываемой связи – пептидазы, амилазы, липазы, нуклеазы, фосфолипазы и т.д.
СН2 – О – Р1 СН2 – О – Р1
![]() Фосфолипаза А
Фосфолипаза А
![]() СН – О – Р2
СН – О – Р2
![]() СН – О – Р2
+ Н2О
СН – О – Р2
+ Н2О
СН2 – О – Р – Х СН2 – О – Р - Х
4. Лиазы – катализируют негидролитический распад органических соединений по связям С – С, С – О, С- и т.д. Они могут отщеплять СО2,
Н2О, Н3 и более сложные группы.
Декарбок-
![]() R – С –
СООН R – СНО + СО2
R – С –
СООН R – СНО + СО2 ![]() силаза О
силаза О
5. Изомеразы – ускоряют процессы внутримолекулярных перестроек, превращений одних изомеров в другие.
Фосфоглицерат-
![]() НОСН2СН-
СООН СН2-СН-СООН
НОСН2СН-
СООН СН2-СН-СООН
![]() Фосфомутаза
Фосфомутаза ![]()
Р – О Р – О ОН
6. Лигазы или синтетазы – катализируют реакции синтеза высокомолекулярных полимеров (белков, НК, полисахаридов, липидов и т.д.) из мономеров, активированных при участии АТФ или других макроэргических связей. К ним относятся: аминоацил –тРНК-синтетазы, ацетил –КоА – карбоксилазы, ДНК-полимераза, РНК-полимераза, глутаминситетаза и т.п.
R - CН – СООН + тРНК +
АТФ ![]() R – CH – COO – тPHK + АМФ + РР
R – CH – COO – тPHK + АМФ + РР
![]()
![]()
NН2 NН2
ВИТАМИНЫ.
Витамины – это группа низкомолекулярных веществ различной химической природы, необходимых для роста, жизнедеятельности и размножения организма. Они характеризуются следующими признаками:
• Не синтезируются в организме человека и животных, поэтому должны поступать с пищей;
• Не служат источником энергии или пластическим материалом клетки. Следовательно потребность организма в них невелика и составляют в сутки доли граммов (С – 0,07г., В1 – 0,002 г., В12 – 0,000003 г. и т.д.).
• Поступая с пищей в малых количествах, оказывают влияние на биохимические процессы. Большинство витаминов входит в состав активной группы (кофермента) ферментов, определяя специфичность их действия;
• При отсутствии, недостатке или избытке витамины приводят к специфическим нарушениям обмена веществ и физиологических функции и даже возникновению болезней (авитаминоз, гиповитаминоз, гипервитаминов).
Витамины делятся на две группы: водорастворимые и жирорастворимые витамины. К водорастворимым витаминам относятся: тиамин (витамин В1), никотиновая кислота, пантатеновая кислота, пиродоксин (В6), биотин, фолиевая кислота, витамин В12 и аскорбиновая кислота (Витамин С). К жирорастворимым витаминам относятся: витамины А (ретинол), Д (кальциферолы), Е (токоферолы) и К (нафтохиноны). Водорастворимые витамины.
Витамин А (тиамин). Это первый из витаминов выделенный в чистом виде. Химическая природа включает пиримидиновое и тиазольное кольца. В организме витамин А находится в форме тиаминпирофосфата
(кокарбоксилазы) во всех органах и тканях (больше всего в печени, почках, сердце, мозгу, мышцах). Он является коферментом, катализирующим декарбоксилирование кетокислот) пировиноградной, - кетоглутаровой). При недостатке В1 нарушается нормальное превращение углеводов, наблюдается повышенное накопление кетокислот, вызывает болезнь – бери-бери.
NН
- ![]() СН2 - N - СН3
СН2 - N - СН3
- ![]() СН2 - СН2ОН
СН2 - СН2ОН
Н3С
S
Витамин В1 (тиамин)
Источником витамина В1 служит зерновые продукты, не освобожденные от периферических частей и оболочек, мука грубого помола, другие растительные животные продукты.
Суточная потребность – 1,3-2,6 мг.
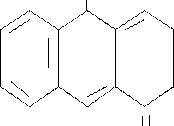
Витамин В2 (рибофлавин). По химической природе рибофлавин – производное изоаллоксазина, к которому присоединен пятиатомный спирт – рибитол.
СН2-(СНОН)3-СН2ОН
N N
Н3С - = О
 Н3С -
N
Н3С -
N
N
О
Рибофлавин в форме флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД) является простетической группой ферментов, осуществляющих перенос водорода по дыхательной цепи. Он содержится в зернах злаковых (мука грубого помола), свежих овощах, яйце, молоке, мясе.
Суточная потребность – 1,5-3 мг.
Витамин В3 (пантотеновая кислота) – состоит из пантоевой кислоты и аланина. Она является активной группой коэнзима А.
Н3С ОН
![]() НОН2С
– С – СН – СО – NН – (СН2) 2 - СООН
НОН2С
– С – СН – СО – NН – (СН2) 2 - СООН
СН3
Пантоевая кислота -Аланин
Соединение коэнзима А с уксусной кислотой – ацетил-СоА образуется не только в результате окислительного декарбоксирования пировиноградной кислоты, но и при -окисления жирных кислот, дезаминировании некоторых аминокислот, т.е. ацетил-СоА является связывающим звеном обмена углеводов, жиров и некоторых аминокислот. Поэтому пантотеновая кислота широко распространена в животном и растительном мире.
Основными пищевыми источниками ее для человека являются печень, яичный желток, дрожжи и зеленые части растений.
Суточная потребность – 3-5 мг.
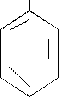
Витамин В6 (пиридоксин) – является производными пиримидина. Группа витаминов В6 включает три родственных соединения: пиридоксин, пиридоксаль и пиридоксамин, которые в биологических системах легко превращаются друг в друга.
 СНОН
СНОН
НО - - СН2ОН
Н3С
N
Активной формой витамина В6 является пиридоксальфосфат или его аминоформа- пиридоксаминфосфат, которые служат коферментами ряда важнейших ферментов, осуществляющих регуляцию белкового обмена. Наиболее важные из них – аминотрансферазы и трансаминазы. Пиридоксин входит в состав и других фермнтов – декарбоксилаз аминокислот. Пиридоксин участвует также в обмене углеводов, входя в состав фермента – фосфорилазы, который расщепляет гликоген.
Основными источниками для человека служат: хлеб, горох, фасоль, картофель, мясо. Почки, печень.
Суточная норма – 1,5-3 мг.
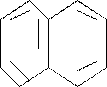
Витамин Вс (фолиевая кислота) – состоит их трех компонетов:
питеридина, параминбензойной и глутаминовой кислот.
ОН N Н О Н
![]() N - СН2 – N
- -С-N-СН-СН2-СН2-СООН
N - СН2 – N
- -С-N-СН-СН2-СН2-СООН
Н2N СООН N N
Фолиевая кислота – важный кофактор ряда сложных ферментных систем у человека. Она в форме тетрагидрофолиевой кислоты – (ТГФК) входит в состав кофакторов ферментов, осуществляющих перенос одноуглеродных групп. Некоторые производные ТГФК участвуют в биосинтезе тимина и метионина.
Витамин Вс больше всего содержится в зеленых листьях растений и дрожжах.
Суточная потребноть – 0,2 мг.
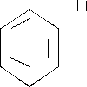
Витамин РР (никотиновая кислота) – витаминными свойствами обладают никотиновая кислота и ее амид-никотинамид.
О
 -
CООН - С - NН2
-
CООН - С - NН2
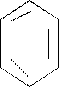 N N
N N
Витамин РР, т.е. никотинамид входит в состав никотинамидаадениндинуклеотида (НАД) и никотидамидадениндинуклеотидфосфата (НАДФ), являющихся коферментами большого числа дегидрогеназ. В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами.
Основными источниками витамина РР являются: рис, хлеб, картофель, мясо, печень, почки, марковь.
Суточная потребность – 15-25 мг.
Витамин С (аскорбиновая кислота) – это ненасыщенное соединение не содержащие карбоксильной группы. Аскорбиновая кислота способна к обратному окислению (дегидрированию и гиджрированию). Эта способность определяет ее участие в окислительно-восстановительных реакциях в качестве дополнительного переносчика водорода.
О
ОН ОН
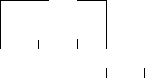 О = С – С = С – С – С –
СН2ОН
О = С – С = С – С – С –
СН2ОН
Н ОН
Однако, до сих пор не выделены ферментные комплексы, в состав простетических групп которых витамин С входит. Предполагаются, что витамин С влияет на состояние белкового обмена в мышцах (в биосинтезе коллагена); он участвует в образовании белков соединительной ткани, гормонов коры надпочечников, в регуляции обмена некоторых аминокислот.
Пищевыми источниками витамина С служат: цитрусовые, перец, салат, капуста, хрен, укроп, хотя в плодах шиповника и листьях черной смородины содержание его намного больше.
Суточная потребность – 100-200 мг.
Витамин В12 (цианкобаламин) – антианемический витамин. Это наиболее сложное вещество, сходное с порфирином гемоглобина. Витамин В12 в виде кобамидного кофермента участвует в двух типах химических реакции:
1. кофермент – метилкобаламин – в реакции трансметилирования;
2. кофермент – дезоксиаденозилкобаламин – в переносе водорода в реакциях изомеризации.
Витамин В12 является единственным витамином, синтез которого осуществляется исключительно микроорганизмами. Основные источники витамина В12 – печень (говяжья),мясо, рыба, почки, молоко, яйцо.
Суточная потребность в витамине В12 взрослого человека – 3 мкг. Жирорастворимые витамины.
Витамин А- по химической природе представляет собой циклическое соединение, включающее иноновое кольцо, два остатка изопрена и первичную спиртовую группу.
Тот витамин обнаружен только в животных продуктах: печени морских животных, рыб, молоке, сливочном масле. В растениях (красно-мякотные овощи) витамин А содержится в виде провитаминов- , и -каротинов. Наибольшей биологической активностью обладает – каротин. При распаде его в организме человека образуется две молекулы витамина А.
Н3С СН3 СН3
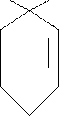
![]()
- (СН = СН – С = СН)2 - СНОН
- СН3
Витамин А принимает участие в синтезе зрительного пурпура – родопсина сетчатки глаза (является простетической группой липопротеина – опсина), в биосинтезе белков, в энергетическом обмене, регуляции образования глюкозы, в биосинтезе кортикостероидов. Недостаток его в организме человека вызывает болезнь – «куриная слепота».
Суточная потребность – 1,-2,5 мг.
Витамин Д - существует в виде нескольких соединений. Наиболее биологически активными является витамин Д3, предшественником биосинтеза которого является холестерин. В организме человека витамин Д3 образуется из 7-дигидрохолестерина под действием солнечных (ультрафиолетовых) лучей.
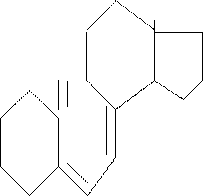
![]() СН3 СН3 СН3
СН3 СН3 СН3
- СН – (СН) - СН
СН2
СН3
НО
Витамин Д3 (холекальциферол)
Витамин Д играет важную роль в регуляции фосфорно-кальциевого обмена. Недостаточность его вызывает у детей болезнь – рахит.
Суточная норма 10-25 мкг для детей и 2,5 мкг для взрослых.
Витамин Е (токоферолы) - наибольшей витаминной активностью обладает – токоферол, представляющий собой сочетание триметилгидрохинона с одноатомным спиртом – фиотолом.
СН3
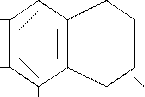 НО СН3
СН3 СН3
НО СН3
СН3 СН3
![]()
![]()
![]()
Н3С -(СН2) 3–СН–(СН2) 3–СН–(СН2)3-СН
СН3 О СН3 СН3
Витамин Е (токоферол)
Особенно существенно его роль в обмене веществ в мышечной ткани. Он участвует в синтезе макроэргического соединения – креатинфосфата, повышает активность флавиновых ферментов, восстановление цитохрома С, способствует синтезу коэнзима О и является самым лучшим жирорастворимым – антиоксидантом. Недостаточность витамина Е приводит к резкому повышению потребления кислорода (2-2,5 раза) без повышения образования макроэргов (АТФ).
Источниками витамина Е служат: растительные масла, салат, капуста, семена злаковых, мясо, сливочное масло, яичный желток.
Суточная потребность колеблется от 5 до 30 мг.
Витамин К (нафтахиноны). Его функция состоит в регуляции свертываемости крови. Является коферментом в реакции карбоксилирования глутаминовых остатков протромбина и других белков.
Наиболее богата витамином К зеленые лист каштана, крапивы, люцерны. К растительным продуктам, являющимися источниками витамина К можно отнести: капусту, шпинат, тыкву, зеленые томаты, арахисовое масло, ягоды рябины, а в животных только печень свиньи.
Суточная норма около 1 мг., так как он синтезируется микроорганизмами кишечника.
Кроме этих основных витаминов существуют другие витаминоподобные вещества, которым относятся: парааминобензойная кислота, арнитин, холин и др.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.