
№15
Уроки № 88-95 обобщающее повторение
Уроки № 93 обобщающее повторение темы «Термодинамика»
Тема урока: обобщающее повторение темы «Термодинамика»
Цели работы для учащегося:
- понимание основных понятий и формул;
- формирование навыков решения задач
Краткая теория
Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно–кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно–кинетические модели для иллюстрации своих выводов.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими (или квазистационарными, еще одно название таких процессов - равновесные).
В изобарном процессе работу идеального газа можно рассчитывать по формулам:
![]()
Подчеркнем еще раз: работу газа по расширению можно считать по этим формулам только если давление постоянно. Согласно данной формуле, при расширении газ совершает положительную работу, а при сжатии – отрицательную (т.е. газ сопротивляется сжатию и над ним нужно совершать работу чтобы оно состоялось).
Если давление нельзя считать постоянным, то работу газа находят, как площадь фигуры под графиком в координатах (p, V). Очевидно, что в изохорном процессе работа газа равна нулю.
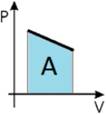
Ввиду того, что работа газа численно равна площади под графиком, становится понятно, что величина работы зависит от того, какой именно процесс происходил, ведь у каждого процесса свой график, а под ним своя площадь. Таким образом, работа зависит не только и не столько от начального и конечного состояний газа, сколько от процесса, с помощью которого конечное состояние было достигнуто.
Внутренняя энергия
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно–кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия одноатомного идеального газа рассчитывается по формулам:
![]()
Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния. Это значит, что изменение внутренней энергии не зависит от того, как система была переведена из одного состояния в другое (а зависит лишь от характеристик первоначального и конечного состояний) и всегда, в любых процессах для одноатомного идеального газа определяется выражением:
![]()
Обратите внимание: эта формула верна только для одноатомного газа, зато она применима ко всем процессам (а не только к изобарному, как формула для работы). Как видно из формулы, если температура не изменялась, то внутренняя энергия остаётся постоянной.
Первый закон термодинамики
Первый закон (начало) термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. Однако, соотношение, выражающее первый закон термодинамики, чаще записывают в немного другой форме:
![]()
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами (такая формулировка более удобна и понятна, в таком виде совсем очевидно, что это просто закон сохранения энергии).
Адиабатным (адиабатическим) называют процесс, в ходе которого система не обменивается теплотой с окружающей средой. При адиабатном процессе Q = 0. Поэтому: ΔU + A = 0, то есть: A = – ΔU. Газ совершает работу за счет уменьшения собственной внутренней энергии.
Циклы. Тепловые машины
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.
Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т.д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние.
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0.
КПД тепловой машины может быть рассчитан по формуле:
![]()
где: Q1 – количество теплоты полученное рабочим телом за один цикл от нагревателя, Q2 – количество теплоты переданное рабочим телом за один цикл холодильнику. Работа совершенная тепловой машиной за один цикл:
![]()
Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1).
Наибольший КПД при заданных температурах нагревателя T1 и холодильника T2, достигается если тепловая машина работает по циклу Карно. Цикл Карно состоит из двух изотерм и двух адиабат. КПД цикла Карно равен:
![]()
Второе начало (второй закон) термодинамики
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из–за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т.д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик У.Кельвин дал в 1851 году следующую формулировку второго закона: В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Немецкий физик Р.Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. Следует отметить, что обе формулировки второго закона термодинамики эквивалентны.
Ссылки на интернет-ресурс: https://educon.by/index.php/materials/phys/termodinamika
Задания для самостоятельного решения
Первый закон термодинамики. Принцип действия тепловых двигателей
Задание #1
Вопрос:
Из первого закона термодинамики следует, что...
Выберите несколько из 4 вариантов ответа:
1) Невозможно создать вечный двигатель
2) Количество теплоты, отданное телом всегда больше, чем уменьшение внутренней энергии этого тела
3) Изменить внутреннюю энергию газа можно только путем теплопередачи или совершения работы
4) При неизменной внутренней энергии, газом не может быть совершена работа
Задание #2
Вопрос:
Исследуя цикл Карно, можно определить...
Выберите один из 4 вариантов ответа:
1) Минимальный КПД теплового двигателя
2) Максимальный КПД теплового двигателя
3) Средний КПД теплового двигателя
4) Наиболее точный КПД теплового двигателя
Задание #3
Вопрос:
Для работы теплового двигателя необходимо...
Выберите несколько из 4 вариантов ответа:
1) Наличие рабочего тела
2) Наличие термометра
3) Цикличность процессов, происходящих в двигателе
4) Наличие паровой турбины
Задание #4
Вопрос:
В тепловом двигателе температура холодильника составляет 0 оС, а температура нагревателя равна 3073 К. Определите максимальный возможный КПД такого двигателя (в %).
Запишите число:
___________________________
Задание #5
Вопрос:
Двигатель внутреннего сгорания совершил работу, равную 55 МДж. При этом было затрачено 4,2 л бензина. Определите плотность бензина (в кг/м3), если КПД двигателя равен 40%.
Изображение:
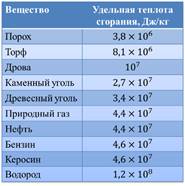
Запишите число:
___________________________
Задание #6
Вопрос:
При каком процессе газ совершает работу только за счет внутренней энергии?
Выберите один из 4 вариантов ответа:
1) При изохорном
2) При адиабатном
3) При изотермическом
4) При изобарном
Задание #7
Вопрос:
Газ, находящийся под давлением 400 кПа изотермически сжимают от 30 л до 10 л. Чему равна работа газа (в кДж), если при данном процессе он потерял 80 кДж?
Запишите число:
___________________________
Задание #8
Вопрос:
Адиабатно расширяясь, идеальный газ, масса которого равна 1 кг, совершил работу, равную 8 кДж. Найдите изменение температуры этого газа, если его молярная масса равна 50 г/моль.
Запишите число:
___________________________
Задание #9
Вопрос:
Для изменения внутренней энергии при изохорном процессе...
Выберите один из 4 вариантов ответа:
1) Газ обязательно должен быть одноатомным
2) Газ обязательно должен получить или отдать то или иное количество теплоты
3) Газ должен быть идеальным
4) Газ должен совершить работу
Задание #10
Вопрос:
При изобарном процессе газ получил 30 кДж теплоты. Если процесс происходил при давлении 40 кПа, то каково изменение объёма газа (в м3)?
Запишите число:
___________________________
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.