
Графические задачи на газовые законы с решениями
10 класс
![]() На
диаграмме РT изображен цикл идеального газа постоянной массы. Изобразите его на
диаграмме Р,V.
На
диаграмме РT изображен цикл идеального газа постоянной массы. Изобразите его на
диаграмме Р,V.
|
|
Проведем поэтапный анализ представленного цикла: 1–2: изохорический процесс; V – const; Р T 2–3: изотермический процесс; V Р¯ Т – const 3–1: изобарический процесс; V¯; Р– const; T¯ Теперь результаты поэтапного анализа перенесем на диаграмму РV Þ |
|
![]() Для постоянной
массы идеального газа представлен цикл на диаграмме РV. Изобразить этот цикл на
диаграмме VT.
Для постоянной
массы идеального газа представлен цикл на диаграмме РV. Изобразить этот цикл на
диаграмме VT.
|
|
Решение: Þ |
|
![]() Изобразите на
диаграмме РТ цикл постоянной массы идеального газа, представленный на диаграмме
РV.
Изобразите на
диаграмме РТ цикл постоянной массы идеального газа, представленный на диаграмме
РV.
|
|
Решение: Þ |
|
![]() Какая из двух
линий графика соответствует большему давлению данной массы идеального газа?
Какая из двух
линий графика соответствует большему давлению данной массы идеального газа?
Прежде всего, установим, что это за линии. Эти линии выражают прямо пропорциональную зависимость между объемом газа и его температурой, а это возможно для идеального газа только при изобарическом процессе, следовательно, изображенные линии графика – изобары.
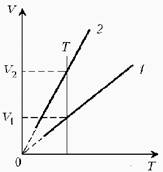 Проведем
изотерму до пересечения с обеими изобарами, а точки их пересечения спроецируем
на ось ординат (объемов). Из построения видно, что V2 > V1.
Поскольку при изотермическом процессе газ подчиняется закону Бойля–Мариотта: Р1V1
= Р2V2, то Р1 > Р2.
Проведем
изотерму до пересечения с обеими изобарами, а точки их пересечения спроецируем
на ось ординат (объемов). Из построения видно, что V2 > V1.
Поскольку при изотермическом процессе газ подчиняется закону Бойля–Мариотта: Р1V1
= Р2V2, то Р1 > Р2.
![]() При нагревании
идеального газа постоянной массы получена зависимость Р(T) при переходе из
состояния 1 в состояние 2. Как при этом переходе менялась плотность газа?
При нагревании
идеального газа постоянной массы получена зависимость Р(T) при переходе из
состояния 1 в состояние 2. Как при этом переходе менялась плотность газа?
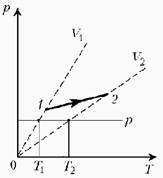
Прежде всего обратим внимание на то, что линия графика не описывается ни одним из изопроцессов («неявная форма»). Проведем через начальную и конечную точки линии графика две изохоры. Проведя еще изобару (или, как вариант, изотерму) и, спроецировав точки ее пересечения с изохорами на ось Т, убедимся, что Т2 > Т1.
При изобарическом процессе, по закону Гей-Люссака, V ~ T, следовательно, V2 > V1. А так как плотность и объем связаны обратной зависимостью (при данной массе), то ρ1 > ρ2, откуда следует, что газ расширялся, а значит, его плотность уменьшилась.
![]() Как менялась
температура постоянной идеального массы газа на протяжении цикла?
Как менялась
температура постоянной идеального массы газа на протяжении цикла?
|
|
Точки 1 и 2 лежат на одной изотерме. Проведем изотермы через характерные точки 1, 2, 3 и касательную к участку 1–2. Как следует из теории, изотермы, более удаленные от координатных осей, соответствуют более высоким температурам. В этом можно убедиться, используя методы, предложенные в предыдущих задачах Þ |
|
![]() Идеальный газ с
молярной массой М участвует в изотермическом процессе. При этом получена
зависимость между объемом V и давлением р. Представьте этот цикл на диаграмме
V, m.
Идеальный газ с
молярной массой М участвует в изотермическом процессе. При этом получена
зависимость между объемом V и давлением р. Представьте этот цикл на диаграмме
V, m.
|
|
Запишем уравнение Клапейрона–Менделеева:
По условию, T, M и R – постоянные, следовательно, m ~ рV. Рассмотрим процессы цикла поэтапно: 1–2: T = const, V = const; m ~ р; 2–3: T = const, р = const; m ~ V; 3–4: T = const, V = const; m ~ р; 4–1: T = const, р = const; m ~ V; Þ |
|
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.