
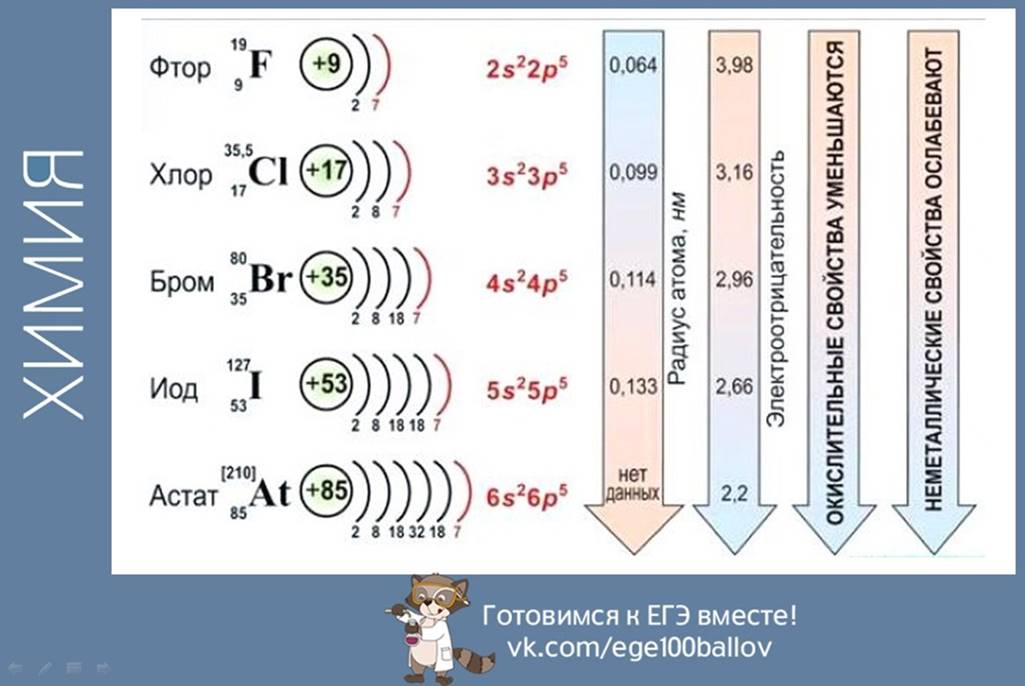
Галогены.
 Общая характеристика
Общая характеристикаготовимся н ЕГЭ вместе! vk.com/ege100ballov
 |
|||
|
Состав |
Агрегатное |
|
|
|
|
|
молекул |
состояние |
Растворимость |
Плотность |
|
|
|
|
и цвет |
|
|
кипения |
плавления |
|
|
Газ |
Воспламеняет |
1,1 |
|
|
|
|
|
нр |
(в жидком состоянии) |
-188,1 |
-219,6 |
|
|
Газ |
Растворим в |
1,57 |
|
|
|
|
Жидкость |
нр Плохо |
(в жидком состоянии) |
|
-101,0 |
|
|
Кристалли |
растворим в |
3,14 |
59,2 |
|
|
|
ческий |
Не растворим в нр |
4,94 |
185,5 |
113,6 |
Фтор в свободном виде получил впервые в 1866 г. французский ХиМИК Анри Муассан, лауреат Нобелевской премии. Свое название элемент получил от греч. фторос — разрушающий.
Бром открыт в 1826 г. французским химиком А. Баларом. Элемент назван так за своп запах (греч. бромос — зловонный).
Иод получен в 1811 г. французским ученым Б.
Куртуа, а название получил за цвет своих паров (греч. иоДэс — фиолетовый).
Галогены.
 Химические
свойства.
Химические
свойства.
готовимся н ЕГЭ вместе! vk.com/ege100balIov
 |
Хлор, бром и йод при обычных условиях реагируют со щелочными металлами, а при нагревании — с медью, железом и оловом. В результате взаимодействия образуются галогениды, которые являются солями:
ТЛ + пна|2 = 2МНа|п.
Галогены в этой реакции проявляют окислительные свойства.
З.Взаимодействиес водородом. При обычных условиях фтор реагирует с водородом в темноте со взрывом, взаимодействие с хлором протекает на свету, бром и йод реагируют только при нагревании, причем реакция с йодом обратима.
+ на!2 = 2ННа|.
Галогены в этой реакции проявляют окислительные свойства.


Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.