
На прошлых лекциях вы познакомились с основами химической термодинамики, научились термодинамическим расчетам, а самое главное определять принципиальную возможность химических превращений веществ по изменению энергии Гиббса.
Однако, термодинамика, определяя направленность химических и биохимических процессов, не рассматривает их протекание во времени, а также механизм этих процессов. Например: образование молекулы воды из водорода и кислорода протекает самопроизвольно, т.к. DGor < 0, но чтобы при 25°С прореагировал 1% водорода потребуется 3 млрд. лет.
Вопросы скоростей химических реакций и механизмы их протекания решает химическая кинетика
Химическая кинетика – это раздел химии, который изучает скорость химических реакций и зависимость её от различных факторов, а также механизмы протекания химических процессов.
В живых системах химические процессы совершаются с различными скоростями, причем сбалансированность скоростей биохимических реакций обеспечивает стационарное состояние организма. Изменение скорости какой-либо реакции может быть либо причиной развития патологии, либо лежать в основе защитной функции организма. Поэтому корректировка биохимических процессов связана с регуляцией скоростей их протекания. Так, физиотерапевтические методы основаны на изменении условий протекания процессов (локальное повышение температуры), фармакотерапевтические – введение веществ, влияющих на скорость реакций.
Хими ческая еа к ия — превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при котором ядра атомов не меняются, при этом происходит перераспределение электронов и ядер, и образуются новые химические вещества. В отличие от ядерных реакций, при химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов.
К основным понятиям химической кинетики относятся механизм и скорость химической реакции.
Механизм еак ии – это последовательность и характер стадий данного химического процесса.
В зависимости от механизма реакции могут быть:
Ø простые – протекают в одну стадию (пример: ионные реакции);
Ø сложные – протекают в несколько стадий (пример: образование воды из кислорода и водорода).
Под ско остью химической еак ии следует понимать число элементарных актов химического взаимодействия за единицу времени в единице реакционного пространства (Р.П.).
Кинетика – это наука о скоростях процессов.
Химическая кинетика рассматривает скорости и механизм химических реакций. Важнейший параметр кинетики – время протекания процесса.
Скорости реакций зависят от многих факторов: природы реагирующих веществ, концентрации, температуры, давления, присутствия катализаторов, а в случае фазовых превращений – также от ряда других условий (состояния поверхности раздела фаз, условий тепло- и массообмена и др.). Задача кинетики состоит в выяснении роли этих факторов и в установлении механизма реакций и фазовых превращений.
Химическая кинетика включает в себя два раздела:
1) формально-математическое описание скорости реакции без учета действительного механизма самой реакции (формальная кинетика); 2) учение о механизме химического взаимодействия.
В формальной кинетике скорость химической реакции представляется в зависимости только от концентрации реагирующих веществ.
Закономерности формальной кинетики позволяют:
1) определить кинетические параметры химической реакции (константу скорости, период полупревращения и др.);
2) распространить полученные закономерности на сложные многостадийные химические реакции, характерные для технологических процессов; 3) классифицировать химические реакции.
Вещества, вступающие в процесс химического превращения, называются исходными веществами.
Вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакции.
Вещества, образующиеся в одних стадиях процесса химического превращения и расходующиеся в других стадиях этого же процесса, называются промежуточными веществами.
Реакции образования и расходования промежуточных веществ называются промежуточными реакциями.
Химическая реакция, протекающая в одной фазе, называется гомогенной химической реакцией (реакция в растворе).
Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией (реакция на поверхности катализатора). Следует отметить, что в гетерогенном процессе оба реагирующих вещества могут находиться в одной фазе. Так, гидрирование этилена
С2Н4 + Н2 → С2Н6
идет на поверхности катализатора, например, никеля. Однако оба реагирующих
вещества находятся в одной фазе (в газовой фазе над поверхностью катализатора).
Сложные химические реакции, в которых одни стадии являются гомогенными, другие – гетерогенными, называют гомогенно-гете огенными.
Гомофазным называется процесс, в котором все компоненты: исходные, промежуточные и конечные вещества – находятся в пределе одной фазы. (Например, реакция нейтрализации кислоты щелочью в растворе является гомогенным гомофазным процессом).
Гетерофазным называется процесс, в котором компоненты образуют более чем одну фазу (например, гидрирование этилена на никелевом катализаторе является гетерогенным гомофазным процессом – процесс идет на границе фаз металла и газа, а исходные вещества и продукт реакции находятся в одной газовой фазе).
Основной величиной в химической кинетике является скорость реакции.
Ско ость химической еак ии – это изменение концентрации вещества в единицу времени в единице объема. В общем случае скорость реакции меняется с течением времени и поэтому её лучше определять как производную от концентрации реагирующего вещества по времени (при постоянном объеме системы):
dC
![]() ,
d
,
d
где – скорость, выраженная убылью концентрации с реагирующего вещества;
– время.
Так как с течением времени концентрация реагирующих веществ уменьшается, поэтому перед производной ставят знак «минус» («–»), (скорость – величина положительная).
При взаимодействии двух или более веществ скорость реакции можно выразить через производную от концентрации любого вещества.
аА + bВ → сС + dD
![]() 1
dCA 1 dCB 1 dCC 1
dCD
1
dCA 1 dCB 1 dCC 1
dCD
а d b d c d d d
Равенство имеет место при соблюдении стехиометрического соотношения между участниками реакции.
Изменение концентрации от времени выражается кинетической кривой (C f ()).
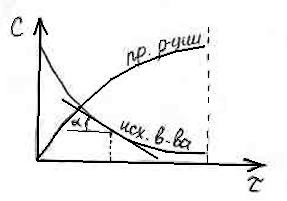
Зная кинетическую кривую для какого-либо компонента, можно легко определить скорость его накопления или расходования графическим дифференцированием кинетической кривой.
Тангенс угла наклона касательной к кинетической кривой есть графическая интерпретация скорости химической реакции.
dC
tg ![]()
d
Крутизна кинетической кривой характеризует истинную скорость химической реакции в определенный момент времени. Кроме того, по кинетическим кривым можно определить порядок и константу скорости реакции.
В общем случае химическая кинетика изучает оптимальные условия ведения процесса только для термодинамически разрешенных реакций.
Химическая кинетика имеет 2 постулата: I. О независимости протекания реакции.
Если процесс протекает через ряд стадий, то предполагается, что скорость каждой отдельной стадии не зависит от скорости остальных стадий.
II. Скорость химической реакции прямо пропорциональна концентрации исходных веществ (ЗДМ).
аА + bВ → сС + dD
kCAn1 CBn2
Данная запись выражения скорости реакции называется кинетическим у авнением.
![]() f (,c,T,...) C
мольлс кмольм3 с
f (,c,T,...) C
мольлс кмольм3 с
Скорость химической реакции зависит от концентрации исходных веществ, от температуры, времени, катализатора и природы веществ.
k – константа скорости. Она численно равна скорости реакции при концентрации
веществ, равных единице.
Константа скорости k не зависит от концентрации реагентов и времени (k f (C,)). Она зависит от температуры, наличия катализатора и природы веществ (k f (T,катализатор, природа вещества)).
n1порядок реакции по веществу А частные порядки
n2порядок реакции по веществу В
По ядок – это показатель степени при концентрации данного вещества в кинетическом уравнении.
В случае одностадийного процесса показатели степеней равны стехиометрическим коэффициентам: n1 a; n2 b.
Сумму порядков реакции по всем реагирующим веществам называют порядком реакции (nn1 n2).
Константы скорости реакций различного порядка имеют разную размерность и являются разными физическими величинами, сопоставление их абсолютных значений лишено какого бы то ни было смысла.
![]() 1 ;
1 ;
Константа скорости первого порядка: с
![]() л ;
л ;
Константа скорости второго порядка: мольс
см6
Константа скорости
третьего порядка: ![]() 2 .
2 .
моль с
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
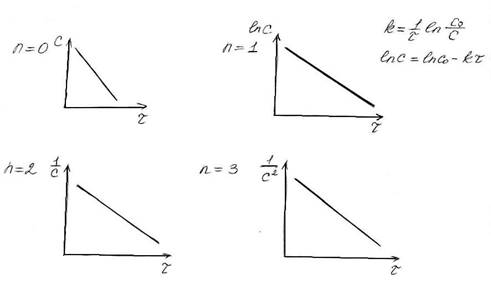
I. По порядку реакции. n = 0, 1, 2, 3, дробный; II. По молекулярности.
Молекуля ность еак ии – это количество молекул, которые принимают участие единовременно в одном акте столкновений. Молекулярность можно определить, лишь установив механизм реакции. В зависимости от числа реагирующих молекул (частиц), участвующих в элементарном акте, различают одномолекулярные (мономолекулярные), двухмолекулярные, тримолекулярные реакции.
К одномолекулярным реакциям типа А→Р относятся процессы распада молекулы на более простые составные части и реакции изомеризации. Двухмолекулярными называются элементарные реакции вида: А+В→Р и 2А→Р (Н2+J2=2HJ, HJ+HJ=H2+J2, CH3COOCH3+H2O=CH3COOH+CH3OH и т.д.). Значительно реже встречаются трехмолекулярные реакции А+2В→Р или 3А→Р. Во всех случаях вид и количество образующихся продуктов реакции не имеет значения, так как молекулярность определяется только числом молекул веществ, реагирующих в элементарном акте.
Порядок реакции устанавливается экспериментально.
Молекулярность и порядок реакции могут совпадать, а могут и различаться. Молекуля ность и по ядок еак ии совпадают только для простых реакций, протекающих только в одну элементарную стадию без участия посторонних молекул. Молекуля ность и по ядок еак ии не совпадают в трех основных случаях:
1) для сложных реакций;
2) для гетерогенных реакций;
3) для реакций с избытком одного из реагирующих веществ.
КИНЕТИЧЕСКИЕ УРАВНЕНИЯ РЕАКЦИЙ РАЗЛИЧНОГО ПОРЯДКА
Разграничение реакций по порядку происходит по формальному признаку – сумме показателей степеней в кинетических уравнениях химических реакций, что ограничивает возможности формальной кинетики. Тем не менее формальная кинетика дает возможность использовать математические зависимости для нахождения кинетических параметров. Все приведенные ниже зависимости справедливы для простых гомогенных реакций в закрытых системах при постоянных объеме и температуре (V=const, T=const).
РЕАКЦИИ НУЛЕВОГО ПОРЯДКА (n=0).
В этом случае скорость реакции постоянна, так как постоянны концентрации компонентов реакции. kС0 k.
Рассмотрим реакцию омыления сложного эфира:
О О
СН3 С\//ОС2Н5 Н2ОkatCH3 C//\ С2Н5ОН
OH
Скорость омыления эфира будет описываться следующим уравнением:
kСH0 2O Cэф.
// \
1 избыток
Если взять большой избыток воды, то её концентрация будет постоянной и кинетическое уравнение примет вид:
kCэф.
Можно сказать, что порядок реакции по частному порядку компонента воды будет нулевым.
Таким образом, большой избыток одного из реагентов уменьшает порядок реакции на определенную величину.
В общем случае кинетическое уравнение реакции нулевого порядка имеет вид:
kC0 k k – кинетическое у авнение нулевого по ядка
Например, реакция А→Р и её скорость описывается уравнением kCА, если вещество А взять в большом избытке, то получим:
kCA0 k
\\ 1
Константа скорости данной реакции равна:
dC
k
![]() d
d
Разделим переменные и проинтегрируем данное уравнение:
kd dC k C const
При 0 постоянная интегрирования равна начальной концентрации С0 (const=
С0), тогда получаем:
1
kC0 C ; k
![]() (C0
C)
при n=0
(C0
C)
при n=0
![]() В
качестве критерия скорости реакции нередко используется время половинного
превращения 1, называемое периодом
полураспада.
В
качестве критерия скорости реакции нередко используется время половинного
превращения 1, называемое периодом
полураспада.
2
![]() Пе иод полу аспада 1 – это время, в течение
которого прореагирует половина
Пе иод полу аспада 1 – это время, в течение
которого прореагирует половина
2
взятого вещества.
1 1
![]() 1 → С
1 → С ![]() С0
; k1 C0
С0
; k1 C0
![]() C0
C0
2
![]() 22 2
22 2
C0 – пе иод полу аспада для еак ии нулевого по ядка
1
![]() 2 2k
2 2k
Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
РЕАКЦИИ ПЕРВОГО ПОРЯДКА (n=1).
Примером реакции, строго подчиняющейся уравнению первого порядка, является реакция термического разложения ацетона (хотя реакция в действительности протекает по сложному механизму):
СН3СОСН3 → СО + СН3СН3
Если обозначить концентрацию ацетона в каждый момент времени через С, то при постоянной температуре скорость реакции будет:
dC 1
![]() kC d
kC d
Разделив переменные и проинтегрировав уравнение, получим: dC
kd ![]()
C dC
kd ![]() C k lnC
const
C k lnC
const
При 0 постоянная интегрирования const= lnС0, тогда:
![]() C0 (1) k lnC0
lnC
ln
C0 (1) k lnC0
lnC
ln
C
![]() 1 C0
(2)
1 C0
(2)
k ln
C
Уравнения (1) и (2) – различные формы кинетического уравнения реакции первого порядка. Они дают возможность вычислить концентрацию реагирующего вещества в любой момент времени по известной величине константы скорости или, наоборот, найти константу скорости реакции при заданной температуре путем определения концентрации в любой момент времени. Выразим период полураспада для реакции первого порядка:
1 C0 k 1 ln21 ln2 k ln
![]()
![]()
![]() 1 C0 /2 1 2 k
1 C0 /2 1 2 k
2 2
Таким образом, время полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества и обратно пропорционально константе скорости реакции.
Эту зависимость можно представить графически в координатах С f (). Так как время половинного превращения в этом случае будет одинаковым, то в каждый момент времени можно определить концентрацию реагирующего вещества.
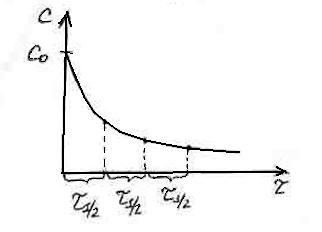
Для практических целей выгоднее выражать скорость по убыли вещества. Пусть V=const, в момент начала реакции 0, число молей реагирующего вещества равно а. Через секунд прореагировало х молей вещества А. Тогда в этот момент времени а х dC 1 dx dx
![]() концентрация вещества А
будет С
kC или
концентрация вещества А
будет С
kC или ![]() k(a x),
k(a x),
V d V d d
k где k
![]() . После разделения переменных и
интегрирования уравнение будет иметь V
. После разделения переменных и
интегрирования уравнение будет иметь V
вид:
ln(a x) kconst
При 0, х=0 const lna , поэтому
1 a
![]() k ln
k ln
a x
А→Р (V=const)
Исходное количество молей (=0) a
Через время (сек) ax
а х
Концентрация через
время (сек)
![]()
V
РЕАКЦИИ ВТОРОГО ПОРЯДКА (n=2).
Кинетическое уравнение реакции второго порядка:
kC1
C2
Если C1 C2
C,
то kC2.
![]() dCd
kC2.
Разделим переменные и проинтегрируем: kd
dCd
kC2.
Разделим переменные и проинтегрируем: kd ![]() CdC2
и получим:
CdC2
и получим:
1 1 1 1
![]() k
( ) у
авнения еак ий вто ого по ядка; 1
k
( ) у
авнения еак ий вто ого по ядка; 1
![]()
C C0 2 C0k
C C0 2 C0k
Для реакций второго порядка время полупревращения и константа скорости реакции обратно пропорциональны начальной концентрации исходного вещества С0.
Уравнение будет несколько сложнее для реакции между веществами, концентрации которых неодинаковы (СА СВ).
А+В→Р (V=const)
Исходное количество молей (=0) a b
Через время (сек) ax bx
Концентрация через (сек)
![]() а
х
b
x
а
х
b
x
V V
k
Окончательно
получим: (k
![]() ) V
) V
a b
1 1 (a x)b
![]() k ln
у авнение еак ии вто ого по ядка; 1 x
k ln
у авнение еак ии вто ого по ядка; 1 x
a
b
a(b x) k ![]()
a(a x)
РЕАКЦИИ ТРЕТЬЕГО ПОРЯДКА (n=3).
Эти реакции встречаются очень редко. Примерами могут служить реакции:
2NO+O2 → 2NO2; 2CO+O2 → 2CO2
Основное кинетическое уравнение для реакции третьего порядка имеет вид: dC
![]() kC1
C2
C3
d
kC1
C2
C3
d
Если C1 C2 C3 C , уравнение примет вид: kC3.
![]() dCd
kC3; kd
dCd
kC3; kd ![]() dCC3
dCC3
1 1 1 3
![]()
![]() k 2( 2 C02 ) 12 2kC02
k 2( 2 C02 ) 12 2kC02
C
Время полупревращения и константа скорости реакции третьего порядка обратно пропорциональны квадрату начальной концентрации вещества.
Для любого n-го порядка время полупревращения можно выразить по формуле:
2n1 1
![]() 1
(n1)kC0n1 к оме еак ии пе
вого по ядка (n=1)
1
(n1)kC0n1 к оме еак ии пе
вого по ядка (n=1)
2
Для каждого порядка реакции существует своя собственная зависимость концентрации от времени.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.